| |
| Med Sci (Paris). 40(11): 837–847. doi: 10.1051/medsci/2024153.De la découverte des hormones incrétines aux doubles et triples agonistes GIP / GLP-1 / glucagon Franck Phan,1 Romane Bertrand,2 Chloé Amouyal,1 and Fabrizio Andreelli1* 1Service de diabétologie, CHU Pitié-Salpêtrière
,
Paris
,
France 2Université Paris-Diderot, Unité de biologie fonctionnelle et adaptative / CNRS UMR 8251
,
Paris
,
France |
Vignette (© Fabrizio Andreelli).
L’obésité est une maladie chronique en pleine expansion. Ses nombreuses complications incluent le diabète de type 2, dont le traitement repose avant tout sur un changement de mode de vie (régime alimentaire et activité physique), mais également sur des médicaments [
1
]. Malgré la disponibilité de nombreuses classes de médicaments, utilisées en monothérapie ou en combinaison, une proportion non négligeable des patients ne retrouve pas un équilibre glycémique satisfaisant, ce qui les expose aux complications touchant les petits vaisseaux (néphropathie, neuropathie, rétinopathie) et les gros vaisseaux (accidents cardio-vasculaires) [
2
]. La difficulté de contrôler l’équilibre glycémique chez ces personnes s’explique par le fait que la maladie associe à la fois une insulinorésistance multitissulaire (dont le point de départ est le développement d’un excès pondéral de situation tronculaire ou abdominale) et une carence relative en insulinosécrétion, dont l’aggravation progressive semble quasi inéluctable [
3
]. La découverte des hormones incrétines s’inscrit dans une approche thérapeutique nécessaire et innovante du dysfonctionnement de la cellule β pancréatique et de l’excès pondéral [
4
]. Cette découverte, outre le bénéfice thérapeutique qui en a résulté pour les personnes atteintes de diabète de type 2, a renouvelé la physiopathologie de la maladie. Nous focaliserons cet article sur les effets des hormones incrétines sur le contrôle glycémique.
|
Histoire de la découverte des incrétines Soigner les diabètes par l’intestin : une drôle d’idée !
Les diabètes sucrés, dont les formes graves sont caractérisées par l’association d’une perte de poids sans perte d’appétit, d’une polyurie (urine abondante) et d’une polydipsie (soif intense), sont connus depuis l’antiquité. Le diabète de type 1 en était le type le plus redoutable car entraînant le décès par acidose et cachexie en l’absence de son seul traitement, l’insulinothérapie. Mais en 1902, la situation change avec l’avènement de l’hormonologie et la découverte de la sécrétine dans des extraits de jéjunum
1
[
5
]. L’intestin apparut ainsi comme une source probable d’autres hormones aux effets potentiellement thérapeutiques. En 1929, deux fractions intestinales furent ainsi séparées chimiquement : une fraction agissant sur la fonction exocrine du pancréas et une autre fraction agissant sur sa fonction endocrine. Cette dernière a reçu l’appellation de « fraction incrétine » [
6
]. Les difficultés techniques pour isoler la ou les substances hypoglycémiantes intestinales, puis la découverte de l’insuline (l’hormone hypoglycémiante produite par les cellules β du pancréas) et la survenue des deux guerres mondiales peuvent expliquer l’arrêt des recherches dans ce domaine jusqu’aux années 1960.
L’effet incrétine formellement démontré
Dans les années 1950, la mise au point du dosage radio-immunologique de l’insuline permit non seulement de confirmer la carence absolue en insuline chez les personnes atteintes de diabète de type 1 et la carence relative en insuline chez les personnes atteintes de diabète de type 2 [
7
], mais aussi d’étudier plus précisément l’insulinémie lors du test de l’hyperglycémie provoquée par voie orale [
8
]. C’est dans ce contexte nouveau d’étude de la sécrétion d’insuline que McIntryre
et al
. [
9
], d’une part, et Elrick
et al
. [
10
], d’autre part, montrent, dans les années 1960, que le glucose stimule plus efficacement la sécrétion d’insuline lorsqu’il est administré par voie orale que lorsqu’il est administré par voie intraveineuse. La mise en évidence de cet « effet incrétine » confirme ainsi le concept d’une sécrétion par l’intestin, lors du repas, d’un ou plusieurs facteurs ciblant le pancréas endocrine afin d’amplifier l’insulinosécrétion. Ce processus est formalisé en « axe entéro-insulaire » par Roger Hunger en 1969 [
11
]. Les travaux de recherche ultérieurs aboutiront à l’identification du GIP (
glucose-dependent insulinotropic polypeptide
) en 1969, puis du GLP-1 (
glucagon-like peptide-1
) en 1987, comme étant les deux principales hormones incrétines. Même si l’on sait aujourd’hui que l’effet incrétine dépend également du type d’alimentation, de la présence ou non d’un surpoids, de la flore intestinale et du système nerveux entérique, l’identification du GIP et du GLP-1 a immédiatement ouvert des perspectives thérapeutiques. La découverte de la réduction de l’effet incrétine chez les personnes atteintes d’un diabète de type 2 suggérait en effet qu’un dysfonctionnement de la transmission de l’information entre l’intestin et la cellule β pancréatique était à l’origine de leur carence relative en insuline et donc de leur hyperglycémie chronique [
12
,
13
].
|
Physiologie des hormones incrétines Origine et sécrétion des hormones incrétines
Les hormones GIP et GLP-1 sont des peptides constitués respectivement de 42 et 30 acides aminés. Elles sont sécrétées par les cellules entéroendocrines L et K, qui représentent environ 1 % des cellules intestinales, et qui sont disséminées dans le tractus intestinal. Les cellules L, sécrétant le GLP-1, sont présentes dans l’iléon et dans le côlon, tandis que les cellules K, sécrétant le GIP, sont situées dans la partie supérieure (
i.e
. proximale) de l’intestin grêle [
14
]. Ces deux hormones sont issues de peptides précurseurs différents. Le GLP-1 est un des produits du clivage du proglucagon, comportant 160 acides aminés, par la prohormone convertase 1/3 (PCSK 1/3), tandis que le GIP résulte de la maturation du pré-pro-GIP, constitué de 153 acides aminés.
|
Liste des abréviations
GIP :
glucose-dependent insulinotropic polypeptide
GLP-1 :
glucagon-like peptide-1
PCSK 1/3 : prohormone convertase 1/3
GLUT2 /SGLT1 :
glucose transporter 2 / sodium glucose cotransporter
GPR120 (FFAR4) :
G-protein-coupled receptor 120 (free fatty acid receptor 4)
GPR40 (FFAR1) :
G-protein-coupled receptor 40 (free fatty acid receptor 1)
CaSR :
Ca2+ sensing receptor
PEPT1 :
peptide transporter 1
T1R et T2R :
taste receptor families 1 and 2
ERK :
extracellular signal-regulated kinases
PDX-1 :
pancreatic and duodenal homeobox 1
DPP-IV : dipeptidyl peptidase-4
GRP :
gastrin-releasing peptide
SNAC :
salcaprozate de sodium
RyR :
ryanodine receptor
IP3R :
inositol 1,4,5-trisphosphate receptor
EPAC2 :
exchange protein directly activated by cAMP 2
PKA : protéine kinase A
|
Même s’il existe un taux basal de sécrétion des hormones incrétines, celles-ci sont principalement sécrétées au cours du repas. Mais il est difficile d’en étudier la sécrétion car elles sont facilement dégradées lors du prélèvement. Les conditions et les techniques de dosage ont cependant évolué, offrant une meilleure précision des mesures. Ces difficultés expliquent les résultats contradictoires de la littérature scientifique, comme le fait de considérer le GLP-1 comme l’hormone exclusive de l’effet incrétine, alors que chez le sujet sain, la sécrétion de GIP lors du repas est quantitativement plus importante [
15
]. La sécrétion de GLP-1 lors du repas dépend de la détection, dans la lumière intestinale, de substrats tels que des monosaccharides (principalement le glucose, mais également le galactose et le fructose)
via
un cotransporteur glucides/Na
+
(GLUT2 / SGLT1)
2
, des lipides (surtout les acides gras insaturés)
via
GPR120 (FFAR4) et GPR40 (FFAR1), et des acides aminés, isolés (surtout glutamine et glycine) ou sous la forme de peptides
via
le
Ca2+ sensing receptor
(CaSR) et le
peptide transporter 1
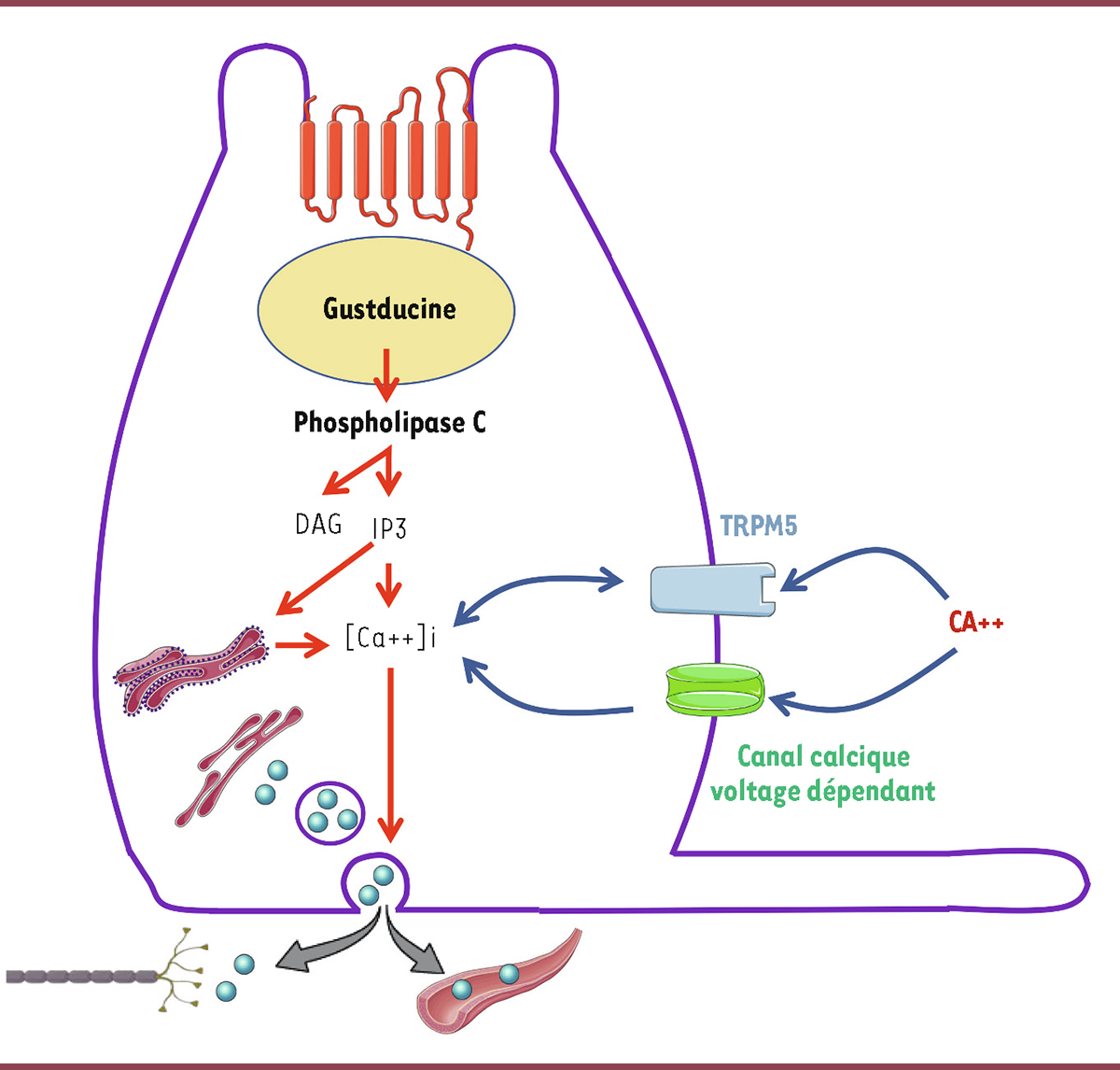
(PEPT1). La sécrétion de GIP, quant à elle, est principalement stimulée par le glucose et, dans une moindre mesure, par les acides aminés et les acides gras à longue chaîne. Par ailleurs, les cellules produisant le GLP-1 expriment des récepteurs du goût (T1R et T2R), qui sont également présents sur la langue, et dont la signalisation intracellulaire implique une protéine G particulière, la gustducine (
Figure 1
) [
16
]. Cette voie de signalisation, qui implique la phospholipase C, puis l’inositol-3-phosphate et le diacylglycérol, entraîne la mobilisation des réserves de calcium intracellulaires et, finalement, l’exocytose des vésicules contenant le GLP-1 au pôle basal de la cellule. La déficience en récepteurs gustatifs ou en gustducine chez la souris, ainsi que la présence d’un haplotype d’un sous-type de récepteur gustatif (TAS2R9), provoquent une réduction de la sécrétion de GLP-1 et une altération de l’homéostasie du glucose [
17
]. Cela suggère que la détection des aliments dans la cavité buccale contribue à déclencher la sécrétion des hormones incrétines (par anticipation de la digestion du repas), qui est ensuite amplifiée par la détection intraluminale des aliments dans l’intestin.
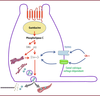 | Figure 1.
Sécrétion de GLP-1 par la cellule L entéro-endocrine
. La détection du glucose active la gustducine, qui à son tour active la phospholipase C, ce qui augmente les concentrations intracellulaires de diacyl-glycéral (DAG) et d’inositol-3 phosphate (IP-3). Grâce à la libération des ions calcium (Ca
2+
) stockés dans le réticulum endoplasmique et l’entrée de Ca
2+
dans la cellule par les transporteurs TRPM5 et le canal Ca
2+
voltage-dépendant, l’augmentation de la concentration intracellulaire de Ca
2+
déclenche l’exocytose des vésicules contenant le GLP-1 ou le GIP.
|
Actions physiologiques des incrétines : hormones et neurotransmetteurs
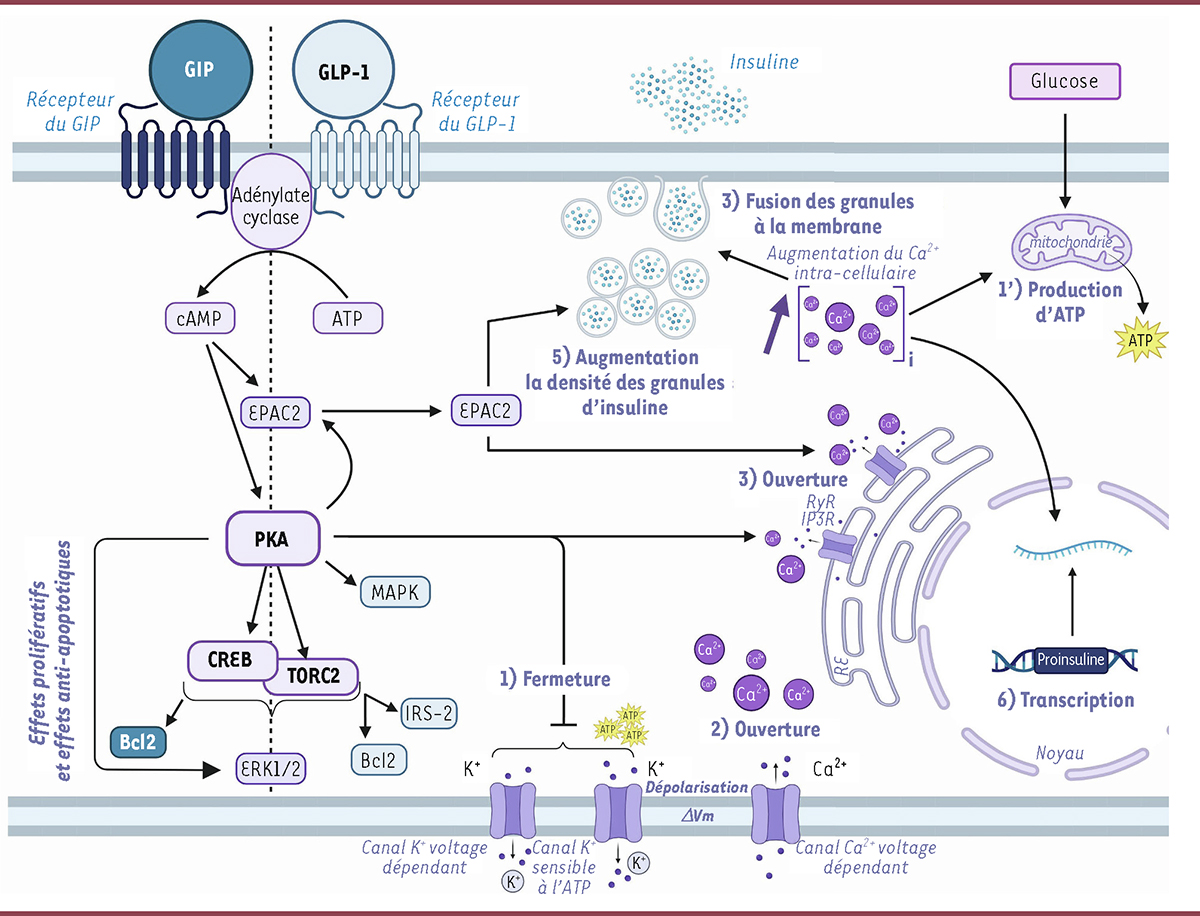
Les récepteurs du GIP et celui du GLP-1 sont associés à une protéine G, elle-même couplée à l’adénylate cyclase. La liaison de ces hormones à leur récepteur augmente donc la concentration d’AMP cyclique (AMPc) dans la cellule, ce qui active la protéine kinase A (PKA) et entraîne l’augmentation de la concentration intracellulaire d’ions calcium nécessaire à leurs effets physiologiques, dont la sécrétion d’insuline (
Figure 2
) [
14
]. Par d’autres voies de signalisation (ERK, PDX-1), les deux hormones incrétines ont également, dans les modèles murins de diabète de type 2, des effets de renforcement de la viabilité cellulaire et anti-apoptotiques sur les cellules β pancréatiques [
14
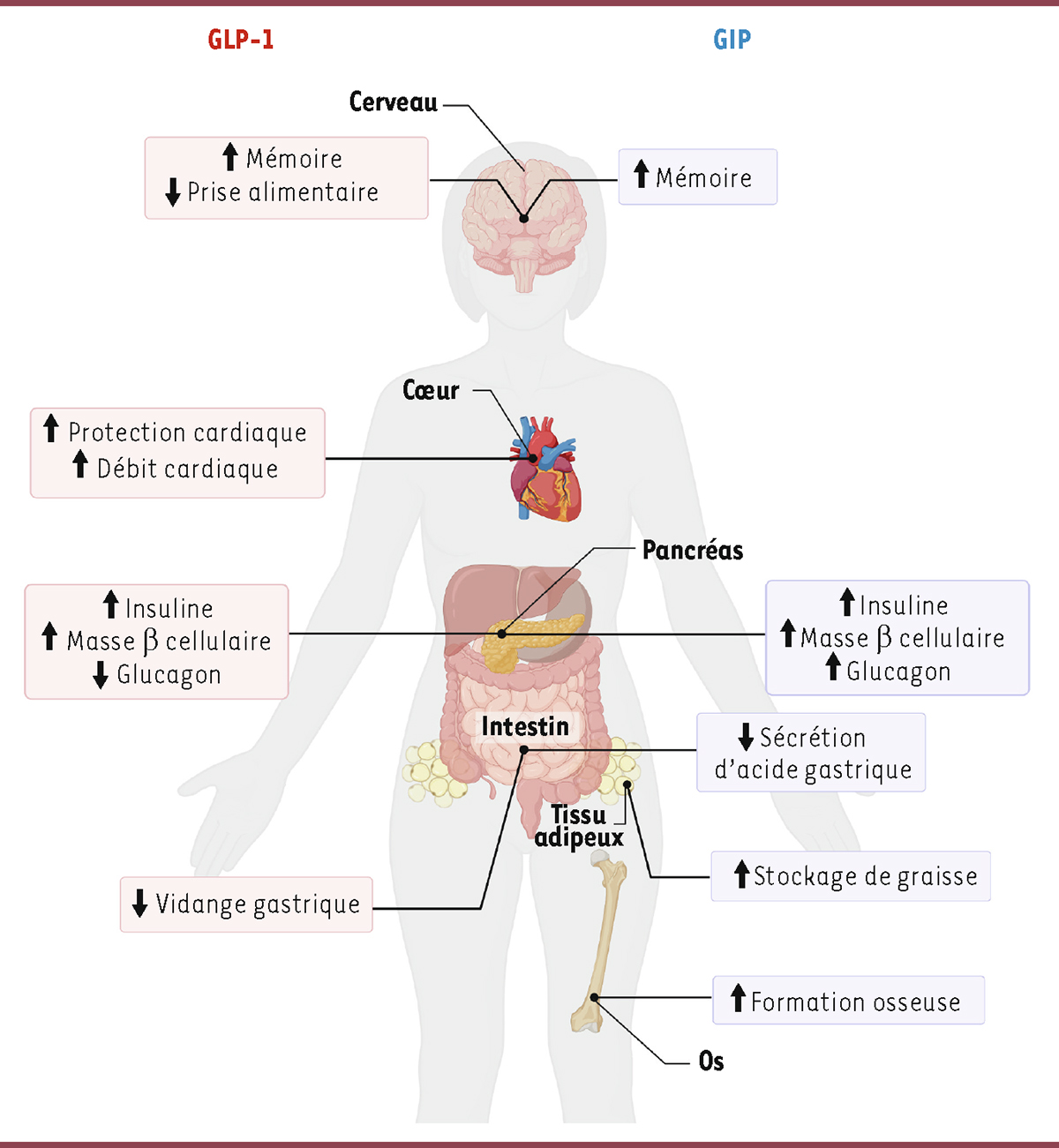
]. On conçoit donc l’importance de ces hormones pour la viabilité et la fonctionnalité du pancréas endocrine, et le fait que leur déficience puisse contribuer à l’altération de sa masse fonctionnelle. Au-delà de leur effet sur la glycémie, le GIP et le GLP-1 ont d’autres effets importants (
Figure 3
) [
18
,
19
].
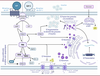 | Figure 2.
Potentialisation de la sécrétion de l’insuline par les hormones incrétines GLP-1 et GIP
. Le GIP et du GLP-1 se lient à leurs récepteurs couplés aux protéines G situés dans la membrane plasmique des cellules β pancréatiques ce qui entraîne l’activation de l’adénylate cyclase qui catalyse la conversion de l’adénosine triphosphate (ATP) en adénosine monophosphate cyclique (AMPc), un second messager clé dans cette voie d’amplification. L’augmentation de la concentration de l’AMPc permet l’activation de la protéine kinase A (PKA) et de la protéine EPAC2 (
guanine-exchange protein directly activated by cAMP
). La PKA entraîne alors la fermeture des canaux potassiques (K
+
) sensibles à l’ATP (1), tout comme l’ATP synthétisé par les mitochondries en réponse au glucose (1’). La PKA entraîne également l’inhibition du canal K
+
voltage-dépendant (1). Ces fermetures de canaux K
+
provoquent une dépolarisation de la membrane plasmique, ce qui entraîne l’ouverture des canaux Ca
2+
voltagedépendants (2), et donc l’entrée de Ca
2+
dans la cellule β pancréatique. L’augmentation des concentrations intracellulaires de Ca
2+
est également liée à la stimulation des canaux calciques RyR (
ryanodine receptor
) et IP3R (
inositol 1,4,5-trisphosphate receptor
) de la membrane du réticulum endoplasmique (3) par des mécanismes dépendant de PKA et EPAC2. Les concentrations accrues du Ca
2+
intracellulaire déclenchent finalement l’exocytose, c’est-à-dire la fusion des granules contenant l’insuline avec la membrane plasmique (4). L’activation de EPAC2 augmente la densité des granules contenant l’insuline près de la membrane plasmique, ce qui potentialise la sécrétion d’insuline (5). L’augmentation de la concentration intracellulaire de Ca
2+
favorise également la transcription du gène codant la proinsuline, augmentant ainsi la synthèse d’insuline (6) ainsi que la production mitochondriale d’ATP, ce qui prolonge la dépolarisation de la membrane plasmique (1’).
|
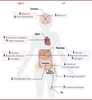 | Figure 3.
Effets physiologiques des hormones incrétines
.
Le GLP-1 agit directement sur le pancréas endocrine, le tractus gastro-intestinal, le cœur et le cerveau. Le GIP agit également sur le pancréas endocrine, le cerveau, le tractus gastrointestinal, mais aussi sur les os et le tissu adipeux.
|
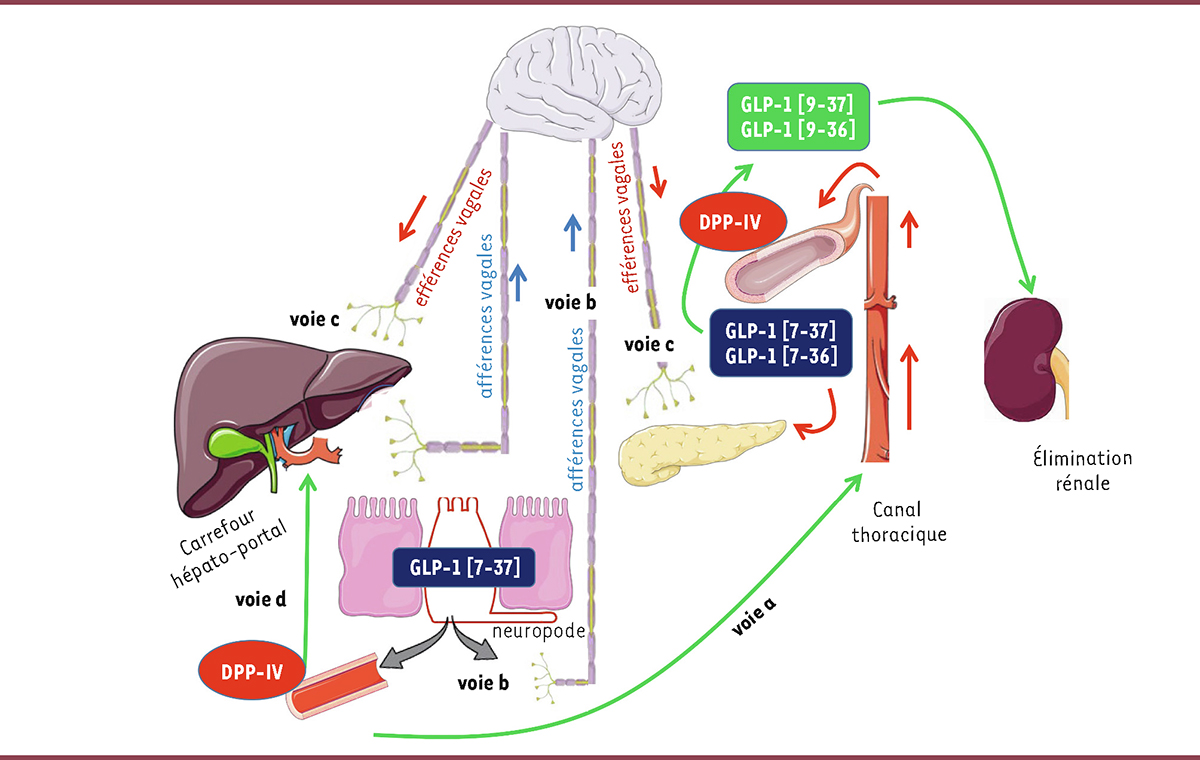
Si on considère que l’appareil digestif est le lieu de sécrétion des incrétines quantitativement le plus important, il est remarquable de constater qu’une fois libérées dans les vaisseaux digestifs par les cellules K ou L, ces deux hormones sont quasi-immédiatement dégradées par la dipeptidyl peptidase-4 (DPP-IV) endothéliale. Cette enzyme, qui clive les dipeptides histidine-alanine à partir de l’extrémité N-terminale des protéines, transforme le GLP-1 actif (GLP-1[7-37]) en GLP-1 inactif (GLP-1[9-37]) et le GIP actif (GIP[1-42]) en GIP inactif (GIP[3-42]), avant qu’ils soient éliminés par voie rénale (
Figure 4
). Ainsi, la demi-vie du GLP-1 actif est de 2 minutes et celle du GIP actif de 5 à 7 minutes, et seulement 10 % du GLP-1 sécrété dans les vaisseaux sanguins de l’intestin est retrouvé dans la circulation générale [
20
].
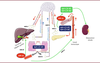 | Figure 4.
Mécanismes d’action du GLP-1
. Le GLP-1 est sécrété au pôle baso-latéral des cellules L intestinales. Il peut agir en tant qu’hormone en gagnant la circulation générale par le canal lymphatique thoracique (faible dégradation car secteur dépourvu de DPP-IV, voie a), pour atteindre ensuite ses tissus et organes cibles. Il peut également agir en tant que neurotransmetteur en activant les fibres spinales et parasympathiques afférentes situées le long du neuropode des cellules L (voie b) ou les fibres afférentes du système nerveux autonome traversant la paroi de la veine porte (carrefour hépato-portal, voie d). Dans les deux cas, le GLP-1 peut contrôler la production hépatique de glucose et la sécrétion d’insuline par l’intermédiaire du système nerveux autonome, après relais des afférences dans le tronc cérébral et l’hypothalamus et l’activation des fibres efférentes du nerf vague (voie c).
|
Comment des hormones à la durée de vie aussi courte peuvent-elles avoir autant d’effets physiologiques sur divers organes clefs du métabolisme (foie, pancréas endocrine, cerveau) ? Au moins trois mécanismes peuvent en rendre compte. Un premier mécanisme est de retarder la dégradation de ces hormones par la DPP-IV. L’équipe de David d’Alessio a montré qu’une partie du GLP-1 sécrété lors du repas pouvait s’associer aux micelles lipidiques et emprunter le circuit lymphatique digestif puis le canal thoracique, seul site de l’organisme dépourvu de l’enzyme DPP-IV, ce qui permet aux hormones incrétines de rejoindre la circulation sanguine générale, puis d’atteindre leurs tissus cibles (
Figure 4, voie a
) [
21
]. Un second mécanisme est de permettre à ces hormones d’agir sur des organes situés à distance du lieu de sécrétion grâce au système nerveux autonome, ce qui repose sur la capacité qu’ont le GIP et le GLP-1 d’agir aussi comme des neurotransmetteurs dans l’intestin lui-même. Les cellules entéroendocrines possèdent en effet un prolongement cellulaire, appelé neuropode, qui interagit avec les fibres du système nerveux entérique, et ces dernières peuvent ainsi détecter le GIP et le GLP-1 libérés en tant que neurotransmetteurs, avant leur dégradation par la DPP-IV (
Figure 4, voie b
) [
22
]. Stimulées par le GIP ou le GLP-1, les fibres afférentes du nerf vague activent le noyau du tractus solitaire (situé dans le tronc cérébral), qui transmet l’information à l’hypothalamus (éminence médiane, noyau paraventriculaire), au système limbique, au noyau parabrachial de la protubérance annulaire, et au thalamus [
23
]. Les fibres efférentes du nerf vague (issues du noyau moteur dorsal de ce nerf) véhiculent alors le message nerveux vers les organes périphériques, provoquant une partie des effets physiologiques des incrétines : sécrétion d’insuline, contrôle de la production hépatique de glucose, etc. (
Figure 4, voie c
) [
20
]. Des boucles réflexes existent entre le noyau du tractus solitaire et le noyau moteur du nerf vague, qui amplifient le réflexe de type vagovagal et permettent la détection d’un signal périphérique (ici, un nutriment ou une hormone incrétine) transmis par les fibres afférentes digestives au noyau du tractus solitaire, suivie d’une réponse adaptée (ici, la sécrétion d’insuline) d’un organe périphérique recevant les efférences du nerf vague issues de son noyau moteur [
23
]. Celui-ci a d’ailleurs été reconnu comme un régulateur essentiel de l’insulinosécrétion dès la fin des années 1970, bien avant le questionnement sur les mécanismes d’action des hormones incrétines [
23
]. Un exemple de ce type de boucle de contrôle essentiellement vagale a été mis en évidence au carrefour hépato-portal (
Figure 4, voie d
), où des fibres nerveuses vagales traversant la paroi de la veine porte jusqu’à sa lumière sanguine et possédant des récepteurs du GLP-1 (et possiblement des récepteurs du GIP) détectent l’hormone et relaient le signal vers le tronc cérébral et le noyau du tractus solitaire [
24
,
25
]. Ainsi, que ce soit au site même de sécrétion digestive des hormones incrétines ou lors de leur passage dans la veine porte, ce mécanisme de détection du GIP et du GLP-1 par le système nerveux autonome permet à ces peptides de contrôler la sécrétion d’insuline par le pancréas ou la production de glucose par le foie sans qu’il leur soit nécessaire d’atteindre physiquement ces organes. Enfin, un troisième mécanisme, concernant cette fois les hormones incrétines circulantes, est d’atteindre directement certaines structures cérébrales par diffusion passive non saturable,
via
les organes circumventriculaires (situés principalement autour des troisième et quatrième ventricules cérébraux) qui, au contraire de la barrière hématoencéphalique étanche, offrent des espaces de diffusion et d’échange avec le secteur vasculaire [
26
]. Ces structures particulières permettent la diffusion du GIP et du GLP-1 contenus dans le sang, en particulier vers les noyaux du nerf vague, à travers l’
area postrema
, et vers l’hypothalamus,
via
l’éminence médiane. Les neurones du noyau moteur du nerf vague, riches en récepteurs du GLP-1, peuvent ainsi être activés directement par cette hormone
via
ce mécanisme de diffusion [
27
], en plus du processus de détection du GLP-1 par les fibres vagales afférentes susmentionné. Mais c’est ce dernier processus qui paraît être le plus important pour le contrôle de la sécrétion d’insuline. En fait, les contributions respectives de l’action directe (par voie sanguine) et de l’action indirecte (par voie nerveuse) des hormones incrétines sur leurs tissus cibles restent à ce jour indéterminées. Très récemment, dans des modèles pré-cliniques, a été proposée l’existence d’une véritable coopération entre GIP et GLP-1, dans laquelle le bol alimentaire stimule d’abord la sécrétion de GIP (les cellules produisant le GIP étant situées dans la partie proximale de l’intestin), qui agit alors localement comme un neurotransmetteur et active les afférences vagales. En retour, les efférences vagales ou les neurones entériques libèrent l’acétylcholine ou le GRP (
gastrin-releasing peptide
), qui stimulent la sécrétion de GLP-1 par les cellules entéro-endocrines situées dans la partie distale de l’intestin. Lorsque le bol alimentaire atteint l’iléon, le contact direct des nutriments avec ces cellules stimule ensuite la sécrétion de GLP-1 de manière plus soutenue [
28
].
|
Hormones incrétines et diabète de type 2 Carence en hormones incrétines et diabète de type 2
Chez les patients présentant un diabète de type 2, on constate, lors des repas, une réduction de la sécrétion du GIP et du GLP-1 en réponse au glucose par rapport à des individus témoins, donc un défaut de réactivité de l’effet incrétine (responsable en partie de l’insuffisance de l’insulinosécrétion) [
15
]. Les causes de ce défaut sont encore discutées, avec l’hypothèse d’une désensibilisation des cellules entéroendocrines à la détection des nutriments dans un contexte d’alimentation hypercalorique, de perturbation du microbiote intestinal et d’inflammation intestinale de bas grade [
15
]. Quoi qu’il en soit, on pouvait s’interroger sur l’efficacité de l’administration des hormones incrétines pour améliorer la sécrétion d’insuline en cas de diabète de type 2.
Le diabète de type 2 se caractérise par de multiples anomalies de la sécrétion d’insuline. La phase précoce de la sécrétion (correspondant aux 7 à 10 premières minutes après son déclenchement), la plus importante pour réduire la production hépatique de glucose lors du repas (réduction de la néoglucogenèse hépatique et stockage du glucose alimentaire sous forme de glycogène), est réduite en cas de diabète de type 2. En revanche, la phase secondaire d’amplification de la sécrétion, prolongée dans le temps (nécessaire pour la captation du glucose par les tissus périphériques), est préservée chez les patients, voire amplifiée. Cette cinétique anormale de la sécrétion de l’insuline explique l’hyperglucagonémie relative dans le diabète de type 2, par un défaut du contrôle physiologique de la sécrétion de glucagon par l’insuline, défaut qui contribue à pérenniser l’hyperglycémie chronique [
29
]. Contrairement aux autres médicaments hypoglycémiants, les agonistes du récepteur du GLP-1 améliorent la phase précoce de l’insulinosécrétion et la glucagonémie des patients, ce qui explique leur efficacité thérapeutique [
30
]. Notons que l’action insulinosécrétrice du GIP et du GLP-1 n’existe que lorsque la glycémie augmente, ce qui limite le risque d’hypoglycémie pour la personne traitée par ces agonistes. Cela suggère que ces hormones agissent en améliorant la sensibilité des cellules β pancréatiques aux fluctuations glycémiques, un mécanisme utile pour le traitement du diabète de type 2 si l’on considère que l’hyperglycémie chronique désensibilise ces cellules au glucose, ce qui favorise le déficit de sécrétion d’insuline [
31
].
Vers l’emploi thérapeutique des hormones incrétines : d’abord le GLP-1
Le constat, chez des personnes atteintes de diabète de type 2, d’une restauration de l’effet incrétine par l’administration de GLP-1, et non par celle de GIP, a conduit à développer l’utilisation thérapeutique du GLP-1 [
32
]. Dans la plupart des essais thérapeutiques que nous résumons ici (multicentriques, randomisés en double aveugle contre placebo ou comparateur actif), les patients inclus sont atteints de diabète de type 2 et présentent des glycémies insuffisamment contrôlées, malgré un traitement de fond par la metformine seule ou en association avec d’autres médicaments hypoglycémiants. L’efficacité des nouveaux traitements est évaluée, lors d’un suivi des participants de 52 semaines en moyenne, par l’amélioration de la glycémie par rapport au moment de l’inclusion dans l’essai diminution du taux de l’hémoglobine glyquée (HbA1c), qui traduit l’équilibre du diabète pendant les trois mois précédant la mesure et par la perte de poids (pour les effets cardiovasculaires et rénaux, voir [
33
]).
Deux stratégies sont proposées pour augmenter la disponibilité en GLP-1 en cas de diabète de type 2. La première est d’empêcher la dégradation du GLP-1 endogène en réduisant l’activité de la DPP-IV par l’action d’inhibiteurs spécifiques de l’enzyme (famille des gliptines), dont le chef de file, la sitagliptine, a été commercialisé en France en 2007. Ces molécules sont disponibles seules (une prise orale par jour) ou en association (avec la metformine, en deux prises par jour). L’inhibition de la DPP-IV obtenue n’est pas complète, mais elle suffit à restaurer des taux physiologiques de GLP-1 endogène, ce qui entraîne une baisse du taux d’HbA1c (de 0,6 % en moyenne par rapport au placebo), avec un effet neutre sur le poids et un faible risque hypoglycémique [
34
]. L’autre stratégie est d’administrer au patient du GLP-1 dont la structure a été modifiée afin de le rendre résistant à la dégradation par la DPP-IV. L’administration, par voie sous-cutanée, de cet analogue du GLP-1 produit alors l’équivalent d’un taux de GLP-1 supra-physiologique, et entraîne des effets métaboliques et pondéraux plus puissants. La première étude clinique montrant que le GLP-1 [7-37] synthétique provoquait une sécrétion d’insuline chez le sujet sain et chez le sujet atteint de diabète de type 2 se heurtait néanmoins à la demi-vie très courte de la molécule [
35
]. C’est dans ce contexte que la découverte de l’exendine-4, isolée de la salive du lézard
Gila Monster
, a changé considérablement le développement des thérapies ciblant le système incrétine. De structure proche de celle du GLP-1, et avec son effet insulinotrope
3
, l’exendine-4 possède une résistance naturelle à la DPP-IV et une demi-vie de plusieurs heures [
36
]. Ces caractéristiques ont permis sa commercialisation comme premier analogue de GLP-1, sous la dénomination commune internationale d’exénatide (
Figure 5
) [
37
]. Il aura donc fallu attendre plusieurs décennies après la découverte des hormones incrétines pour pouvoir traiter le diabète de type 2 par un analogue d’une de ces hormones !
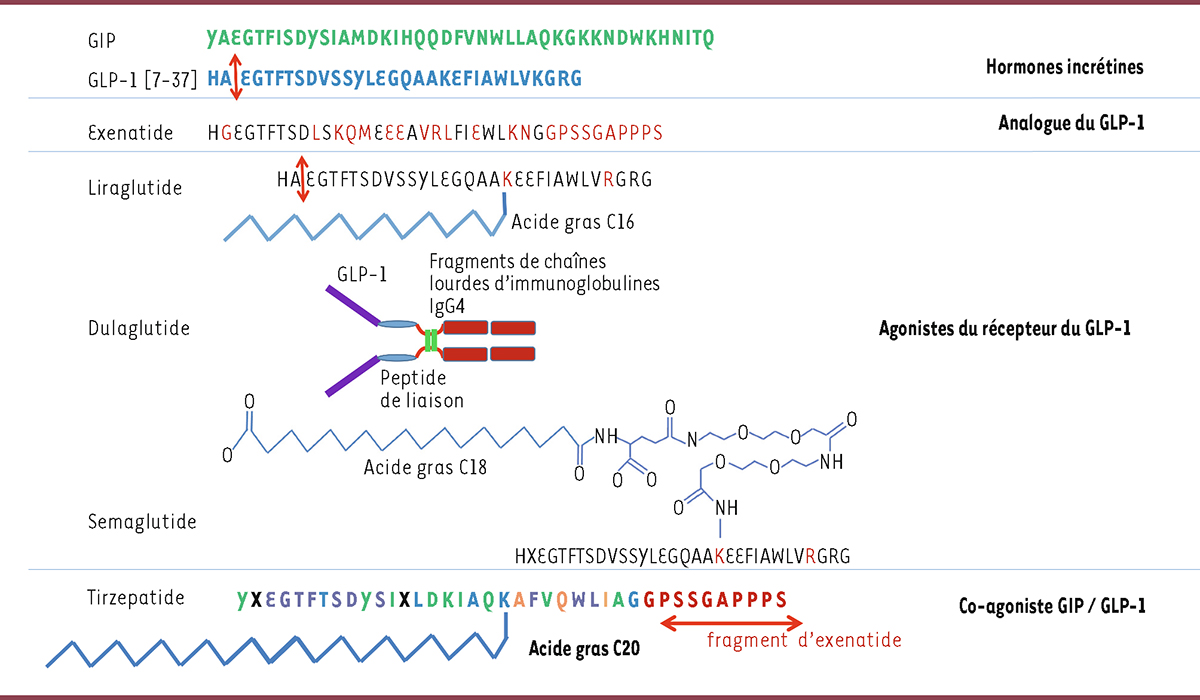
 | Figure 5.
Molécules thérapeutiques analogues du GLP-1 et du GIP disponibles avec une indication thérapeutique pour le diabète de type 2
. L’exénatide a une demi-vie plus longue que le GLP-1 actif grâce à une substitution de l’acide aminé en position 2 (alanine remplacée par glycine) conférant une résistance à la dégradation par la dipeptidyl peptidase-4 (DPP-IV), qui reconnaît les motifs histidine-alanine). Le liraglutide résulte d’une part, de l’ajout (par un
linker
) d’un acide gras à 16 atomes de carbone sur la lysine en position 16 du GLP-1 [7-37] et, d’autre part, du remplacement de la lysine en position 34 par une arginine. Le dulaglutide résulte de la fusion de deux molécules d’un analogue du GLP-1 (identique au GLP-1 natif à 90 %) reliées par un peptide de liaison à deux fragments de chaîne lourde d’immunoglobuline IgG4. Le sémaglutide résulte de deux substitutions d’acides aminés (alanine en position 2 remplacée par l’acide 2-aminoisobutyrique, et lysine en position 34 remplacée par une arginine) par rapport au GLP-1 [7-37]. En position 26, une lysine est liée à un acide gras à 19 atomes de carbone par un
linker
, ce qui permet une forte liaison à l’albumine, une réduction de la clairance rénale et une augmentation de la demi-vie. Les séquences peptidiques du GIP et du GLP-1 ont des acides aminés en commun. Le tirzépatide, co-agoniste GIP / GLP-1, a une plus forte affinité pour le récepteur du GIP que pour celui du GLP-1 car sa structure est basée sur celle du GIP natif (acides aminés en vert), qui contient des acides aminés communs avec le GLP-1 (en violet). Pour augmenter la demi-vie de la molécule, les acides aminés en position 2 et 13 du GIP et du GLP-1 natifs ont été remplacés par l’acide 2-aminoisobutyrique, ce qui confère au tirzépatide une résistance à la dégradation par la DPP-IV. La demi-vie de la molécule de tirzépatide est également augmentée par l’ajout d’un acide gras à 20 atomes de carbone (par une liaison avec une lysine en position 20 du GLP-1 natif) qui permet sa liaison à l’albumine. Enfin, l’addition d’une partie de l’exénatide à la partie C-terminale du tirzépatide est une troisième modification allongeant la demi-vie de la molécule. La flèche rouge indique le site d’action de l’enzyme DPP-IV sur la séquence d’acides aminés histidine-alanine (HA). Pour le tirzépatide, les acides aminés proviennent du GIP (en vert), du GLP-1 (en bleu), ou de l’exénatide (en rouge), ou sont communs au GIP et au GLP-1 (en violet), ou ne sont présents ni dans le GIP ni dans le GLP-1 (en orange) ; X indique l’acide 2-aminoisobutyrique.
|
L’efficacité des analogues du GLP-1 sur le contrôle glycémique et l’excès pondéral s’est renforcée au fur et à mesure du développement de nouvelles molécules (
Tableau I
), avec des effets indésirables essentiellement digestifs, qui s’estompent avec le temps, et un faible risque hypoglycémique.
Tableau I.
| Catégorie de molécule |
Molécule (DCI) |
Nom du programme clnique |
Laboratoire pharmaceutique |
Mode d’administration |
Posologie |
Baisse du poids en kg par rapport à l’inclusion |
Baisse de l’HbA1c par rapport à l’inclusion |
Réf. |
| Analogue de GLP-1 |
Exenatide |
AMIGO |
AstraZeneca AB |
Bi-quotidien (SC) |
5-10 μg / 2 fois par jour |
– 2,8 kg |
– 0,86 % |
[
37
]
|
|
| Exenatide |
AMIGO |
AstraZeneca AB |
Hebdomadaire (SC) |
2 mg / semaine |
– 3,7 kg |
– 1,90 % |
[
37
]
|
|
| Agoniste du récepteur du GLP-1 |
Liraglutide |
LEAD |
Novo Nordisk A/S |
Quotidien (SC) |
0,6 ou 1,2 ou 1,8 mg/jour |
– 4,2 kg |
– 0,40 % |
[
38
]
|
|
| Dulaglutide |
AWARD |
Eli Lilly and Company |
Hebdomadaire (SC) |
0,75 ou 1,5 ou 3 ou 4,5 mg/ semaine |
– 5 kg |
– 3,20 % |
[
40
–
42
]
|
|
| Semaglutide |
SUSTAIN |
Novo Nordisk A/S |
Hebdomadaire (SC) |
0,25 ou 0,5 ou 1 mg/semaine |
– 4,2 kg |
– 2,00 % |
[
43
–
44
]
|
|
| Semaglutide |
PIONEER |
Novo Nordisk A/S |
Quotidien (PO) |
3, 7 ou 14 mg/ jour |
– 2,9 kg |
– 1,00 % |
[
45
–
46
]
|
|
| Bi-agoniste GIP / GLP-1 |
Tirzepatide |
SURPASS |
Eli Lilly and Company |
Hebdomadaire (SC) |
1, 5, 10 et 15 mg/ semaine |
– 11,3 kg |
– 1,94 % |
[
50
–
51
]
|
Résumé des premières études cliniques portant sur les différentes classes de médicaments analogues du GLP-1 ou du GIP et leurs effets sur la glycémie et la perte de poids
.
PO : prise orale ; SC : voie sous-cutanée ; HbA1c : hémoglobine glyquée.
|
Les agonistes du récepteur du GLP-1, développés par la suite, produisaient des effets pondéraux plus puissants que les analogues du GLP-1 en raison de modifications plus complexes de la structure du GLP-1 (7-37) (
Figure 5
) introduites afin d’induire une résistance accrue à la dégradation par la DPP-IV et d’augmenter la durée de vie de la molécule (
Tableau I
). Le premier de ces agonistes, le liraglutide, dont la demi-vie était de 11 à 15 heures, permettait une administration quotidienne (par injection sous-cutanée) [
38
]. L’étape suivante, capitale, a été le développement d’agonistes à administration hebdomadaire, résultat de nouvelles modifications de la molécule permettant une résistance accrue à la DPP-IV. Les premiers représentants de cette classe de molécules ont été le dulaglutide (demi-vie de 4,7 jours, permettant une seule injection par semaine), commercialisé comme hypoglycémiant en 2014 [
39
–
42
], puis le sémaglutide, commercialisé en 2017 [
43
,
44
]. Le sémaglutide oral est une formulation originale du sémaglutide par association à un dérivé d’acide gras (salcaprozate de sodium) qui augmente sa solubilité et facilite sa diffusion à travers les parois membranaires, tout en assurant une protection contre sa dégradation dans l’estomac [
45
,
46
]. Pris 30 minutes avant un repas, le sémaglutide oral (3, 7 ou 14 mg/jour) est un exemple très rare d’un médicament peptidique à prise orale [
47
] (
→
).
(→) Voir la Synthèse de É. Larger,
m/s
n° 1, janvier 2021, page 53
|
Le développement des co-agonistes GIP/GLP-1
Des travaux réalisés dans des modèles pré-cliniques avaient montré que le GLP-1, administré seul, n’avait qu’un faible effet de régulation pondérale [
48
,
49
].
En revanche, les agonistes du GIP évitaient la surcharge pondérale résultant d’un régime hypercalorique, en contrôlant la prise alimentaire et en préservant l’insulinosécrétion par un puissant effet anti-apoptotique sur les cellules β pancréatiques [
15
]. Pour tenter d’obtenir un effet supplémentaire de réduction pondérale dans le diabète de type 2, il semblait donc utile de développer des molécules co-agonistes GIP-GLP-1. Le premier membre de cette famille de molécules, le tirzépatide, a pour base la structure du GIP natif, mais combine des acides aminés présents dans le GIP et dans le GLP-1, positionnés à des sites stratégiques de la molécule. Cette protéine chimérique a une affinité plus forte pour le récepteur du GIP que pour celui du GLP-1 (
Tableau I
). Les résultats des essais cliniques effectués avec cette molécule (programme SURPASS) ont montré que l’activation combinée des deux récepteurs des hormones incrétines a des effets métaboliques et pondéraux supérieurs à ceux des agonistes du récepteur du GLP-1 [
50
,
51
].
L’hyperglucagonémie relative en cas de diabète de type 2 reste difficile à contrôler. Le constat que la plupart des patients diabétiques de type 2 ont une sécrétion excessive de glucagon participant à la physiopathologie de l’hyperglycémie a conduit à des stratégies pharmacologiques de réduction de la signalisation hépatique du glucagon, qui provoque une production hépatique excessive de glucose [
52
]. De multiples études ont montré que cette stratégie permettait de normaliser la glycémie dans plusieurs modèles murins du diabète [
52
]. Des essais thérapeutiques chez l’homme en utilisant des antagonistes du récepteur du glucagon ont également confirmé cet effet bénéfique sur l’hyperglycémie, mais se sont heurtés à l’existence d’effets indésirables, en particulier une détérioration de la fonction hépatique, ce qui a conduit à limiter leur développement. Par ailleurs, des composés tri-agonistes, comportant une partie de la structure moléculaire du glucagon associée au GIP et au GLP-1, sont en cours de développement. Dans l’innovation pharmacologique pour le traitement du diabète de type 2, il est paradoxal de voir apparaître des co-agonistes GLP-1/glucagon ou des tri-agonistes glucagon / GIP / GLP-1 capables d’activer les récepteurs de ces trois hormones. Une telle stratégie repose sur le constat que l’administration d’une formulation hydrosoluble du glucagon à des souris rendues obèses par un régime hypercalorique, non seulement induisait une perte de poids, mais aussi améliorait leur glycémie avec la même efficacité que l’exendine-4 [
52
] ! Il semblait donc intéressant d’associer les actions « non glycémiques » du glucagon (comme l’augmentation de la dépense énergétique, la réduction de la prise alimentaire et l’effet lipolytique) à l’effet d’insulinosécrétion et de contrôle pondéral des agonistes du GIP et du GLP-1. Le développement de telles molécules pour traiter le diabète de type 2 chez l’homme est en cours, et les résultats d’un premier essai clinique montrant, chez des patients suivis pendant 12 semaines, une perte de poids et une baisse du taux de l’HbA1c (
Eli Lilly and Company
), sont prometteurs [
53
].
|
L’histoire de la découverte des hormones incrétines GIP et GLP-1 fournit un bel exemple d’une recherche translationnelle partant de l’observation de l’effet incrétine et de son altération en cas de diabète de type 2 chez l’homme et dans des modèles murins, jusqu’au développement de médicaments hypoglycémiants fondé sur des modifications chimiques de ces deux hormones. L’effet conjugué, hypoglycémiant et de baisse de poids, de ces traitements dépend de la dose de médicament administrée, mais également de la résistance de la molécule thérapeutique à la dégradation par la DPP-IV et de l’allongement de sa demi-vie par rapport à celle des hormones naturelles. Les effets indésirables de ces médicaments (en particulier l’hypoglycémie) sont rares, et leur profil de sécurité cardiovasculaire est favorable. Le concept même de biet tri-agonistes ouvre la voie au développement de molécules innovantes dont la puissance d’effet sur le diabète de type 2 et l’excès pondéral est inédite, et permet désormais d’envisager un contrôle métabolique proche de celui obtenu par la chirurgie bariatrique. |
Footnotes |
Franck Phan et Romane Bertrand déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. Fabrizio Andreelli déclare des activités de consultant auprès du laboratoire Elli Lilly and Company
.
|
2.
Fosse-Edorh
S
,
Fagot-Campagna
A
,
Detournay
B
,
et al.
.
Impact of socio-economic position on health and quality of care in adults with type 2 diabetes in France : the Entred 2007 study.
.
Diabet Med
.
2015;
;
32
:
:1438.
–
44
.
3.
Matthews
DR
,
Cull
CA
,
Stratton
IM
,
Holman
RR
,
Turner
RC.
UKPDS 26 : Sulphonylurea failure in non-insulin-dependent diabetic patients over six years. UK Prospective Diabetes Study (UKPDS) Group.
.
Diabet Med
.
1998;
;
15
:
:297.
–
303
.
4.
Bastin
M
,
Andreelli
F.
Dual GIP-GLP1-receptor agonists in the treatment of type 2 diabetes: a short review on emerging data and therapeutic potential.
.
Diabetes Metab Syndr Obes
.
2019;
;
12
:
:1973.
–
85
.
5.
Starling
EH.
The chemical correlation of the functions of the body.
.
Lancet
.
1905;
;
2
:
:339.
–
41
.
6.
La Barre
MJ.
Sur les possibilités d’un traitement du diabète par l’incrétine.
.
Bull Mem Acad R Med Belg
.
1932;
;
12
:
:620.
–
34
.
7.
Berson
SA
,
Yalow
RS
,
Bauman
A
,
et al.
.
Insulin-I 131 metabolism in human subjects : demonstration of insulin binding globulin in the circulation of insulin treated subjects.
.
J Clin Invest
.
1956;
;
35
:
:170.
–
90
.
8.
John
H.
Glucose tolerance and its value in diagnosis.
.
J Metab Res
.
1992;
;
1
:
:497.
–
548
.
9.
McIntryre
N
,
Holdsworth
CD
,
Turner
DS.
New interpretation of oral glucose tolerance.
.
Lancet
.
1964;
;
4
:
:20.
–
1
.
10.
Elrick
H
,
Stimmler
L
,
Hlad
CJ
Jr
,
Aray
Y.
Plasma insulin response to oral and intravenous glucose administration.
.
J Clin Endocrinol Metab
.
1964;
;
24
:
:1076.
–
82
.
11.
Unger
RH
,
Eisentraut
AM.
Entero-insular axis.
.
Arch Intern Med
.
1969;
;
123
:
:261.
–
6
.
12.
Creutzfeldt
W
,
Ebert
R
,
Nauck
M
,
Strckmann
F.
Disturbances of the entero-insular axis.
.
Scand J Gastroenterol
.
1983;
;
18
:
:111.
–
9
.
13.
Nauck
M
,
Stöckmann
F
,
Ebert
R
,
Creutzfeldt
W.
Reduced incretin effect in type 2 (non-insulin-dependent) diabetes.
.
Diabetologia
.
1986;
;
29
:
:46.
–
52
.
14.
Drucker
DJ.
Mechanisms of action and therapeutic application of glucagon-like peptide-1.
.
Cell Metab
.
2018;
;
27
:
:740.
–
56
.
15.
Nauck
MA
,
Meier
JJ.
The incretin effect in healthy individuals and those with type 2 diabetes : physiology, pathophysiology, and response to therapeutic interventions.
.
Lancet Diabetes Endocrinol
.
2016;
;
4
:
:525.
–
36
.
16.
Margolskee
RF
,
Dyer
J
,
Kokrashvili
Z
,
et al.
.
T1R3 and gustducin in gut sense sugars to regulate expression of Na
+
-glucose cotransporter 1
.
.
Proc Natl Acad Sci USA
.
2007;
;
104
:
:15075.
–
80
.
17.
Dotson
CD
,
Zhang
L
,
Xu
H
,
et al.
.
Bitter taste receptors influence glucose homeostasis.
.
PLoS One
.
2008;
;
3
:
:e3974.
.
18.
McLean
BA
,
Wong
CK
,
Campbell
JE
,
et al.
.
Revisiting the complexity of GLP-1 action from sites of synthesis to receptor activation.
.
Endocr Rev
.
2021;
;
42
:
:101.
–
32
.
19.
Usdin
TB
,
Mezey
E
,
Button
DC
,
et al.
.
Gastric inhibitory polypeptide receptor, a member of the secretin-vasoactive intestinal peptide receptor family, is widely distributed in peripheral organs and the brain.
.
Endocrinology
.
1993;
;
133
:
:2861.
–
70
.
20.
Holst
J. J.
The physiology of glucagon-like peptide 1.
.
Physiol Rev
.
2007;
;
87
:
:1409.
–
39
.
21.
D’Alessio
D
,
Lu
W
,
Sun
W
,
et al.
.
Fasting and postprandial concentrations of GLP-1 in intestinal lymph and portal plasma : evidence for selective release of GLP-1 in the lymph system.
.
Am J Physiol
.
2007;
;
293
:
:R2163.
–
9
.
22.
Bohórquez
DV
,
Liddle
RA.
The gut connectome : making sense of what you eat.
.
J Clin Invest
.
2015;
;
125
:
:888.
–
90
.
23.
Mussa
BM
,
Verberne
AJ.
The dorsal motor nucleus of the vagus and regulation of pancreatic secretory function.
.
Exp Physiol
.
2013;
;
98
:
:25.
–
37
.
24.
Vahl
TP
,
Tauchi
M
,
Durler
TS
,
et al.
.
Glucagon-like peptide-1 (GLP-1) receptors expressed on nerve terminals in the portal vein mediate the effects of endogenous GLP-1 on glucose tolerance in rats.
.
Endocrinology
.
2007;
;
148
:
:4965.
–
73
.
25.
Burcelin
R
,
Da Costa
A
,
Drucker
D
,
et al.
.
Glucose competence of the hepatoportal vein sensor requires the presence of an activated glucagon-like peptide-1 receptor.
.
Diabetes
.
2001;
;
50
:
:1720.
–
8
.
26.
Buller
S
,
Blouet
C.
Brain access of incretins and incretin receptor agonists to their central targets relevant for appetite suppression and weight loss.
.
Am J Physiol Endocrinol Metab
.
2024;
;
326
:
:E472.
–
80
.
27.
Wan
S
,
Coleman
FH
,
Travagli
RA.
Glucagon-like peptide-1 excites pancreas-projecting preganglionic vagal motoneurons.
.
Am J Physiol Gastrointest Liver Physiol
.
2007;
;
292
,
:G1474.
–
82
.
28.
Müller
TD
,
Finan
B
,
Bloom
SR
,
et al.
.
Glucagon-like peptide 1 (GLP-1).
.
Mol Metab
.
2019;
;
30
:
:72.
–
130
.
29.
Müller
WA
,
Faloona
GR
,
Aguilar-Parada
E
,
Unger
RH.
Abnormal a-cell function in diabetes. Response to carbohydrate and protein ingestion.
.
N Engl J Med
.
1970;
;
283
:
:109.
–
15
.
30.
Gandasi
NR
,
Gao
R
,
Kothegala
L
,
et al.
.
GLP-1 metabolite GLP-1(9-36) is a systemic inhibitor of mouse and human pancreatic islet glucagon secretion.
.
Diabetologia
.
2024;
;
67
:
:528.
–
46
.
31.
Cheruiyot
A
,
Hollister-Lock
J
,
Sullivan
B
,
et al.
.
Sustained hyperglycemia specifically targets translation of mRNAs for insulin secretion.
.
J Clin Invest
.
2023;
;
134
:
:e173280.
.
32.
Nauck
MA
,
Heimesaat
MM
,
Orskov
C
,
et al.
.
Preserved incretin activity of glucagon-like peptide 1 [7-36 amide] but not of synthetic human gastric inhibitory polypeptide in patients with type-2 diabetes mellitus.
.
J Clin Invest
.
1993;
;
91
:
:301.
–
7
.
33.
Hu
EH
,
Tsai
ML
,
Lin
Y
,
et al.
.
A Review and meta-analysis of the safety and efficacy of using glucagon-like peptide-1 receptor agonists.
.
Medicina (Kaunas)
.
2024;
;
60
:
:357.
.
34.
Tricco
AC
,
Antony
J
,
Khan
PA
,
et al.
.
Safety and effectiveness of dipeptidyl peptidase-4 inhibitors versus intermediate-acting insulin or placebo for patients with type 2 diabetes failing two oral antihyperglycaemic agents : a systematic review and network meta-analysis.
.
BMJ Open
.
2014;
;
4
:
:e005752.
.
35.
Nathan
DM
,
Schreiber
E
,
Fogel
H
,
et al.
.
Insulinotropic action of glucagon like peptide-I-(7–37) in diabetic and nondiabetic subjects.
.
Diabetes Care
.
1992;
;
15
:
:270.
–
6
.
36.
Eng
J.
Exendin peptides.
.
Mt. Sinai J Med
.
1992;
;
59
:
:147.
–
9
.
37.
Knop
FK
,
Brønden
A
,
Vilsbøll
T.
Exenatide : pharmacokinetics, clinical use, and future directions.
.
Expert Opin Pharmacother
.
2017;
;
18
:
:555.
–
71
.
38.
Moon
S
,
Lee
J
,
Chung
HS
,
et al.
.
Efficacy and safety of the new appetite suppressant, Liraglutide : A meta-analysis of randomized controlled trials.
.
Endocrinol Metab (Seoul)
.
2021;
;
36
:
:647.
–
60
.
39.
Glaesner
W
,
Vick
AM
,
Millican
R
,
et al.
.
Engineering and characterization of the long-acting glucagon-like peptide-1 analogue LY2189265, an Fc fusion protein.
.
Diabetes Metab Res Rev
.
2010;
;
26
, :
:287.
–
96
.
40.
Jendle
J
,
Grunberger
G
,
Blevins
T
,
et al.
.
Efficacy and safety of dulaglutide in the treatment of type 2 diabetes : a comprehensive review of the dulaglutide clinical data focusing on the AWARD phase 3 clinical trial program.
.
Diabetes Metab Res Rev
.
2016;
;
32
:
:776.
–
90
.
41.
Bonora
E
,
Frias
JP
,
Tinahones
FJ
,
et al.
.
Effect of dulaglutide 3.0 and 4.5 mg on weight in patients with type 2 diabetes : Exploratory analyses of AWARD-11.
.
Diabetes Obes Metab
.
2021;
;
23
:
:2242.
–
50
.
42.
Frias
JP
,
Bonora
E
,
Cox
DA
,
et al.
.
Glycaemic efficacy of an expanded dose range of dulaglutide according to baseline glycated haemoglobin (HbA1c) subgroup : Post hoc analysis of AWARD-11.
.
Diabetes Obes Metab
.
2021;
;
23
:
:2819.
–
24
.
43.
Knudsen
LB
,
Lau
J.
The discovery and development of liraglutide and semaglutide.
.
Front Endocrinol (Lausanne)
.
2019;
;
10
:
:155.
.
44.
Mahapatra
MK
,
Karuppasamy
M
,
Sahoo
BM.
Semaglutide, a glucagon like peptide-1 receptor agonist with cardiovascular benefits for management of type 2 diabetes.
.
Rev Endocr Metab Disord
.
2022;
;
23
:
:521.
–
39
.
45.
Andersen
A
,
Knop
FK
,
Vilsbøll
T.
A pharmacological and clinical overview of oral semaglutide for the treatment of type 2 diabetes.
.
Drugs
.
2021;
;
81
:
:1003.
–
30
.
46.
Avgerinos
I
,
Michailidis
T
,
Liakos
A
,
et al.
.
Oral semaglutide for type 2 diabetes : A systematic review and meta-analysis.
.
Diabetes Obes Metab
.
2020;
;
22
:
:335.
–
45
.
47.
Larger
E.
Un analogue du
glucagon-like peptide 1
(GLP1) administré par voie orale : une nouveauté dans le traitement du diabète de type 2
.
.
Med Sci (Paris)
.
2021;
;
37
:
:53.
–
8
.
48.
Scrocchi
LA
,
Brown
TJ
,
MaClusky
N
,
et al.
.
Glucose intolerance but normal satiety in mice with a null mutation in the glucagon-like peptide 1 receptor gene.
.
Nat Med
.
1996;
;
2
:
:1254.
–
8
.
49.
Mroz
PA
,
Finan
B
,
Gelfanov
V
,
et al.
.
Optimized GIP analogs promote body weight lowering in mice through GIPR agonism not antagonism.
.
Mol Metab
.
2019;
;
20
:
:51.
–
62
.
50.
Finan
B
,
Ma
T
,
Ottaway
N
,
et al.
.
Unimolecular dual incretins maximize metabolic benefits in rodents, monkeys, and humans.
.
Sci Transl Med
.
2013;
;
5
:
:209ra151.
.
51.
Frías
JP
,
Davies
MJ
,
Rosenstock
J
,
et al.
.
Tirzepatide versus semaglutide once weekly in patients with type 2 diabetes.
.
N Engl J Med
.
2021;
;
385
:
:503.
–
15
.
52.
Wewer
Albrechtsen NJ
,
Holst
JJ
,
Cherrington
AD
,
et al.
.
100 years of glucagon and 100 more.
.
Diabetologia
.
2023;
;
66
:
:1378.
–
94
.
53.
Urva
S
,
Coskun
T
,
Loh
MT
,
et al.
.
LY3437943, a novel triple GIP, GLP-1, and glucagon receptor agonist in people with type 2 diabetes : a phase 1b, multicentre, double-blind, placebo-controlled, randomised, multiple-ascending dose trial.
.
Lancet
.
2022;
;
400
:
:1869.
–
81
.
|