| |
| Med Sci (Paris). 40(10): 737–747. doi: 10.1051/medsci/2024116.Le vaccin contre la dengue Un défi scientifique majeur et un enjeu de santé publique Philippe Desprès,1 Dominique Salmon,2 Laurent Bellec,3 André Cabié,4 and Marie-Lise Gougeon5* 1Processus infectieux en milieu insulaire tropical (PIMIT), Université de La Réunion, Inserm U1187, CNRS 9192, IRD 249, Plateforme technologique CYROI, Sainte-ClotildeLa RéunionFrance 2Institut FournierParisFrance 3Groupe hospitalier Centre BretagnePontivyFrance 4Service de maladies infectieuses et tropicales, CHU de MartiniqueFort-de-France
,
France
;
PCCEI, Univ Montpellier, Inserm, EFSMontpellier
,
France
;
CIC Antilles Guyane, Inserm CIC1424Fort-de-FranceFrance 5Unité Immunité innée et virus, Institut PasteurParisFrance |
Vignette (© Marie-Lise Gougeon).
La dengue est une arbovirose provoquée par la transmission d’un des quatre sérotypes du virus de la dengue (DENV 1-4) par les moustiques du genre (Ae.), principalement
Ae. aegypti
et
Ae. albopictus
. L’expression clinique de la dengue varie, notamment en fonction de l’âge de l’individu et du nombre d’infections qu’il a subies antérieurement par l’un des quatre sérotypes. Lors du premier contact avec l’un des sérotypes viraux (appelé dengue primaire), les manifestations cliniques sont souvent absentes (formes asymptomatiques) chez l’enfant, et modérées chez l’adolescent et l’adulte. Lors d’un contact avec un deuxième sérotype de dengue (appelé dengue secondaire), la réponse immunitaire initiale peut être inadaptée et induire des formes graves de l’infection : il s’agit du phénomène de
facilitation immunologique
. Lors d’un contact avec un troisième ou quatrième sérotype de dengue (dengue post-secondaire), les manifestations cliniques sont habituellement modérées. Ce modèle d’infection n’est qu’indicatif et des formes graves peuvent aussi survenir lors d’une première infection par l’un des sérotypes de DENV.
La dengue évolue le plus souvent vers la guérison en moins d’une semaine. Cependant, dans 2 à 4 % des cas, des formes graves peuvent survenir brutalement après 3 à 5 jours d’évolution de la maladie. Lorsque ce type d’aggravation se produit, l’évolution peut être rapidement fatale. Les situations à risque de dengue grave sont la grossesse (en particulier au troisième trimestre), les âges extrêmes de la vie, les pathologies chroniques, comme le diabète, l’obésité, l’insuffisance cardiaque, l’asthme, les hépatopathies chroniques et les syndromes drépanocytaires majeurs. Depuis 2009, l’Organisation mondiale de la santé (OMS) a défini la dengue sévère comme une dengue au cours de laquelle surviennent des complications mettant en jeu le pronostic vital, qui peuvent être la conséquence d’un syndrome de fuite plasmatique non contrôlée, d’une atteinte viscérale grave (foie, cœur, système nerveux central, etc.) ou de la décompensation d’une pathologie chronique préexistante. La mortalité de ces formes graves touche 0 à 2 % des individus si le traitement est précoce, mais est supérieure à 10 % en cas de prise en charge retardée [
1
].
Dans cet article, nous décrivons la situation épidémiologique de la dengue dans le monde, mais aussi en Europe, en France et dans ses départements et territoires d’outremer (DROM), les caractéristiques de l’immunité antivirale et vaccinale, les vaccins homologués ou bientôt disponibles, ainsi que les défis posés par le développement d’un vaccin protecteur contre les 4 sérotypes. Nous concluons par une réflexion sur la prévention de la dengue et le rôle d’un programme de vaccination sur le contrôle de la propagation du virus en Europe et dans les DROM français. |
La dengue dans le monde
La dengue est la maladie vectorielle qui s’étend le plus rapidement dans le monde [
2
]. Son incidence a été multipliée par 10 en seulement 20 ans [
3
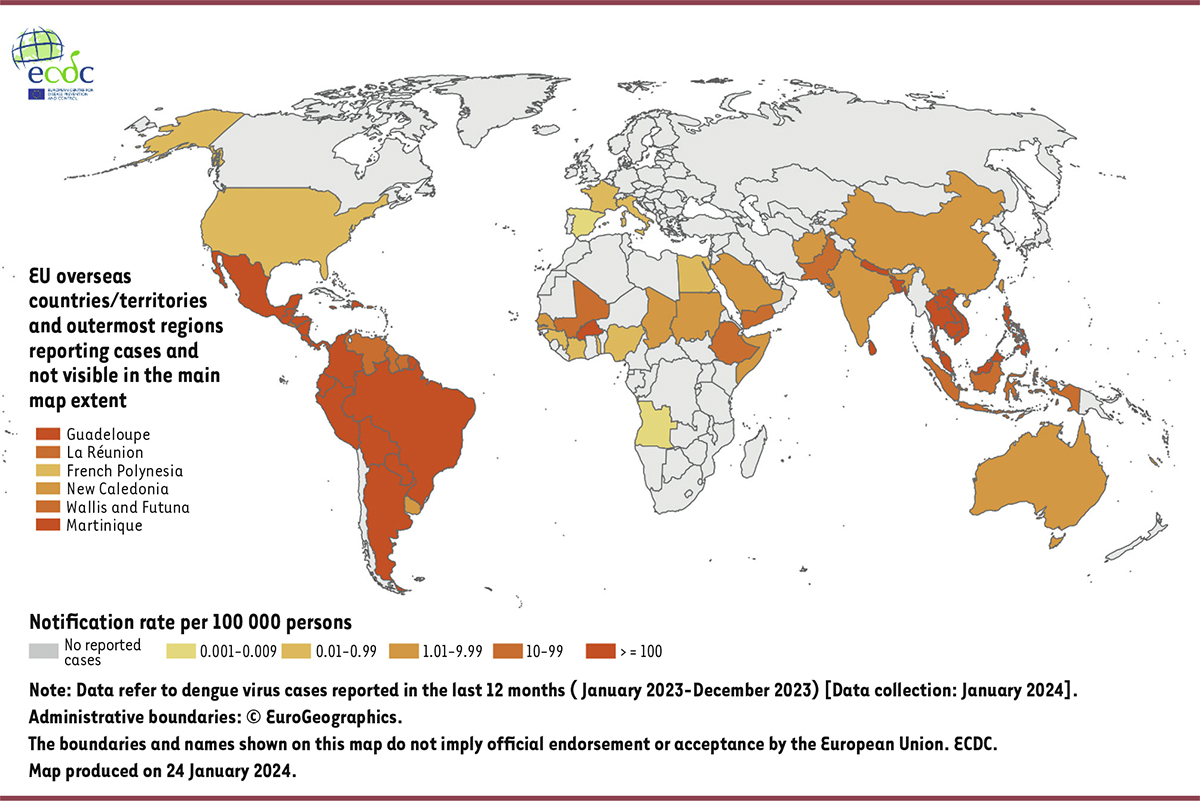
]. En 2023, un record historique de plus de cinq millions de cas et plus de 5 000 décès liés à la dengue ont été signalés par les états membres de l’OMS, incluant l’Afrique, les Amériques (qui comptent 80 % des cas enregistrés dans le monde), l’Asie du Sud-Est, les Régions du Pacifique occidental et de la Méditerranée orientale (
Figure 1
). Ces chiffres sont probablement une sous-estimation de la réelle charge de morbidité, car la plupart des infections primaires sont asymptomatiques et la déclaration de la dengue n’est pas obligatoire dans de nombreux pays. Limitée initialement aux régions tropicales, la dengue s’est progressivement étendue aux régions aux climats tempérés, du fait, notamment, de l’extension des territoires colonisés par les vecteurs [
4
]. La transmission de la dengue est marquée par de grandes épidémies cycliques au cours desquelles les sérotypes circulants peuvent varier. Les sérotypes DENV-3 et DENV-4 ont été plus fréquemment détectés en 2023, après plusieurs années de prédominance des sérotypes DENV-1 et DENV-2. Néanmoins, neuf pays d’Amérique latine sont déjà hyper-endémiques pour la dengue et signalent la co-circulation des quatre sérotypes. La
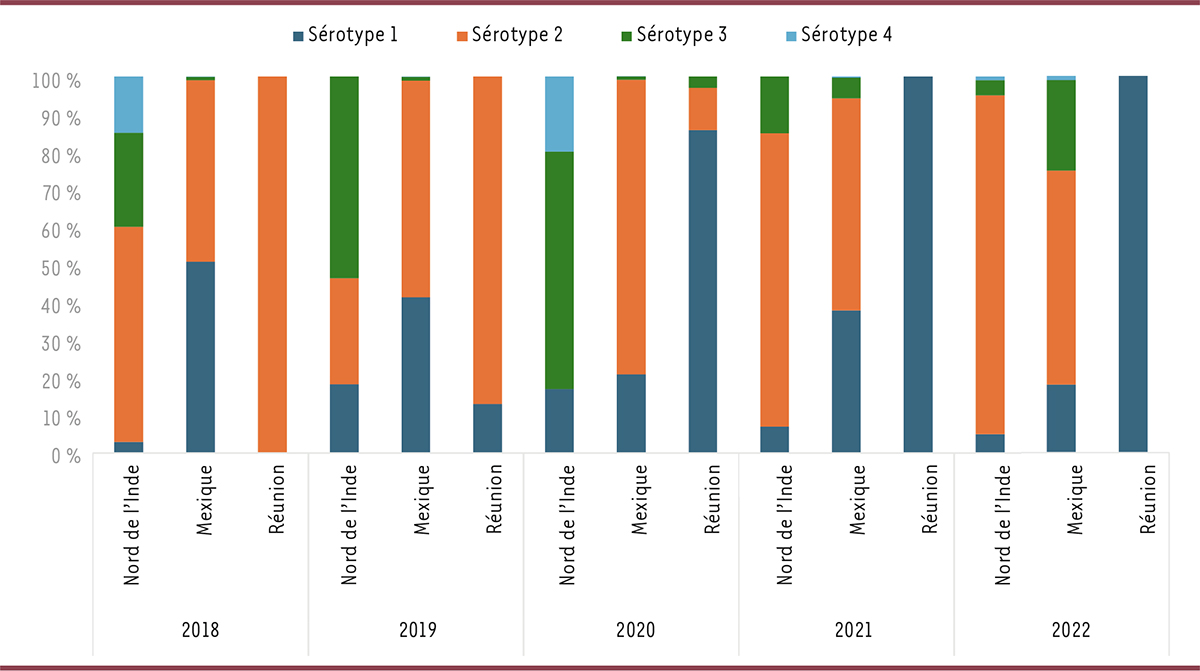
Figure 2
présente l’évolution depuis 2018 de la répartition des différents sérotypes de dengue en Asie du Sud (Nord de l’Inde), en Amérique Centrale (Mexique) et dans le Sud Est de l’océan Indien (département français de La Réunion).
 | Figure 1.
Cas de dengue dans le monde (janvier 2023-décembre 2023)
.
La couleur, du jaune (faible) au rouge (fort), indique le nombre de cas déclarés. Source :
European Centre for Disease Prevention and Control
[
6
].
|
 | Figure 2.
Évolution dans le temps (2018-2022) de la répartition des 4 sérotypes de dengue au nord de l’Inde, au Mexique et à La Réunion
(d’après [
59
–
62
]).
|
L’extension du territoire des vecteurs
Ces dernières décennies ont été marquées par une évolution de la répartition dans le monde des deux vecteurs principaux de la dengue :
Ae. aegypti
, originaire d’Afrique et retrouvé dans toutes les régions tropicales et sub-tropicales, et
Ae. albopictus
, ou moustique tigre, originaire de l’Asie du Sud-Est. Ces moustiques sont bien adaptés aux habitats urbains. L’extension de leur répartition est liée à plusieurs facteurs : 1) le réchauffement climatique des zones tempérées et l’adaptabilité
d’Ae. albopictus
, liée à sa grande plasticité écologique et physiologique ; 2) l’accélération de l’urbanisation, qui entraîne une multiplication d’habitats insalubres sans réseau d’assainissement ; 3) l’accroissement démographique remarquable au cours de ces dernières décennies ; et 4) l’explosion des échanges mondiaux, en particulier ceux liés aux trafics maritime et aérien [
1
,
5
].
Risque actuel de la dengue en Europe
En Europe, plus de 22 000 cas d’infections par le virus de la dengue ont été déclarés en 2023 [
6
], dont environ 90 % étaient liés aux voyages. En 2010, les premières transmissions locales de la dengue liées à la présence d’
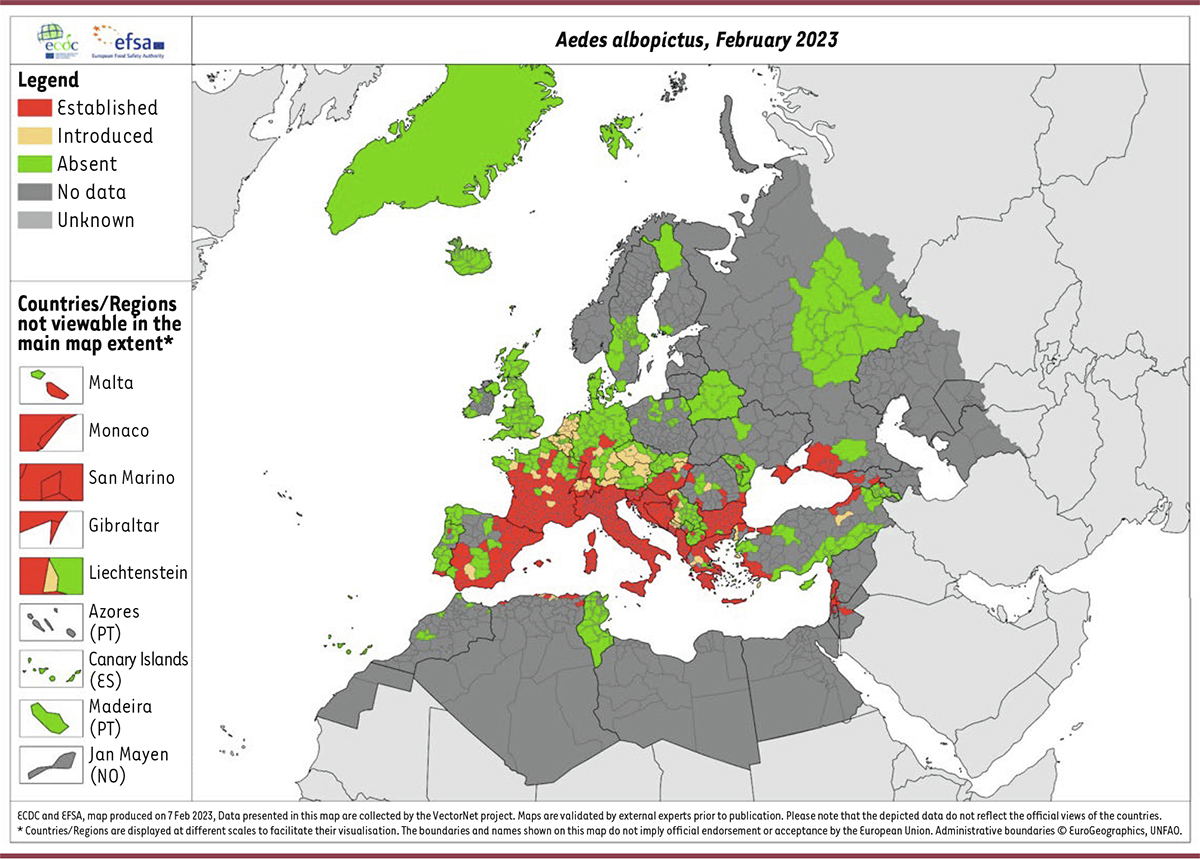
Ae. albopictus
ont été signalées en Europe (en France et en Croatie) puis dans plusieurs foyers européens. Le moustique vecteur s’est installé en Europe en raison de sa tolérance et de son adaptation aux températures tempérées.
Ae. albopictus
circule désormais dans plus de 13 pays européens (
Figure 3
) et sa vitesse d’expansion territoriale est estimée à plus d’une centaine de km par an.
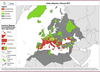 | Figure 3.
Distribution du moustique tigre (Aedes albopictus) en Europe (février 2023).
(en rouge, établi ; en jaune, introduit ; en vert, absent). Source :
European Centre for Disease Prevention and Control
[
58
].
|
Des cas autochtones sporadiques et des flambées épidémiques ont été signalés en 2023 en Europe du Sud, dont l’Espagne, l’Italie et le midi de la France. Il est probable que le nombre réel de cas de dengue est sous-estimé car les tests de détection de la dengue ne sont pas systématiques en l’absence d’antécédents de voyage et d’une suspicion clinique. La dengue en France métropolitaine et dans les territoires ultramarins La France métropolitaine
En France métropolitaine, 65 cas autochtones de dengue ont été déclarés en 2022, et 45 cas en 2023, dont 3 cas confirmés en Île de France. Ils s’ajoutent à plus de 2 000 autres cas importés, majoritairement des DROM français [
7
]. En 2024, le premier cas de dengue autochtone a été rapporté début juillet, après plus de 1 600 cas importés depuis le début de l’année
1
. La colonisation par le moustique vecteur
Ae. albopictus
a été observée dans 71 des 96 départements métropolitains (
Figure 3
) [
8
]. Ce constat a conduit à la mise en place de mesures spécifiques de protection individuelle, de lutte contre les gites larvaires et de démoustication avec les agences régionales de santé (ARS).
Les territoires ultramarins français
En Guyane et dans les Antilles françaises, la dengue est endémique, avec des épidémies cycliques. En Guyane, l’année 2023 a été marquée par une épidémie majeure recensant plus de 16 000 cas cliniquement évocateurs, dont 9 690 cas confirmés [
9
]. Les sérotypes DENV-2 et DENV-3 circulaient de façon concomitante. Aux Antilles (Guadeloupe, Martinique, Saint Barthelemy), une importante épidémie, qui a sévi en 2023, continue de s’intensifier en 2024, recensant plus de 17 000 patients suspectés de dengue, avec un sérotype DENV-2 prédominant.
Sur l’île de la Réunion, une succession de vagues épidémiques a été détectée depuis 2017, la dernière épidémie datant de 2022. En 2023, la Réunion était en phase inter-épidémique de dengue [
10
]. DENV-2 a circulé exclusivement pendant 2 ans, remplacé par DENV-1, à présent exclusif.
En Polynésie française, l’absence de circulation du virus depuis trois ans a été suivie d’une alerte en novembre 2023 (13 cas autochtones) qui se poursuit en 2024 (6 cas début février 2024) [
11
].
|
L’immunité antivirale est-elle protectrice contre la dengue ? Immunité et dengue sévère
La dengue est une infection aiguë dont les manifestations peuvent être aisément confondues avec d’autres infections microbiennes, en particulier dans les régions tropicales [
12
]. Parmi les personnes infectées par le virus de la dengue, environ 60 à 80 % sont asymptomatiques et moins de 5 % des cas symptomatiques développent une forme sévère de la maladie. Bien que les quatre sérotypes du virus de la dengue partagent de fortes similitudes antigéniques, ces virus restent suffisamment distincts entre eux pour ne pas conférer une immunité protectrice croisée à long terme. L’immunité acquise en réponse à l’infection par l’un des sérotypes ne confère donc une immunité protectrice que contre le sérotype infectant. Le risque de développer une forme sévère est plus important lors d’une dengue secondaire que lors d’une dengue primaire, en particulier lorsque le sérotype infectant est différent de celui responsable de la primo-infection. Parmi les causes possibles de cette aggravation, le mécanisme de facilitation immunologique (ou en anglais,
antibody-dependent enhancement
, ADE) est fortement suspecté. Ce phénomène se produit lors d’une infection virale quand des anticorps non neutralisants préexistent chez l’hôte, facilitant l’entrée du virus dans certaines cellules, et parfois aussi sa réplication [
13
,
14
]. D’autres facteurs peuvent contribuer à la sévérité de la dengue, notamment les variations génétiques des souches virales circulantes. En effet, si la virulence propre aux souches virales circulantes peut conditionner la sévérité de l’infection, le risque de développer les formes graves de la maladie est variable selon le sérotype viral infectant. Par rapport aux trois autres sérotypes, le sérotype 2 du virus de la dengue (DENV-2) est plus fréquemment observé dans les cas de dengue hémorragique, la forme grave de l’infection [
15
]. Des mutations originales, qui pourraient contribuer à la pathogénicité virale, ont été identifiées dans la protéine NS1 (
non-structural protein 1
), une composante majeure du pouvoir pathogène du virus [
16
,
17
], de la souche DENV-2 responsable de l’importante épidémie de dengue à la Réunion en 2018 [
18
]. L’évolution vers des formes sévères de dengue découle également de facteurs de prédisposition d’un individu, liés notamment à la génétique individuelle de sensibilité à l’infection virale, ou populationnelle. En effet, des déterminants génétiques individuels ou de groupe conditionnent la sensibilité individuelle à l’infection par le virus DENV et probablement le risque de développer des formes graves de la maladie [
19
,
20
]. L’existence de tels déterminants génétiques de sensibilité à la dengue pourrait expliquer le risque plus élevé des populations d’origine européenne ou asiatique à développer une dengue sévère, qui est rarement observée parmi les individus originaires d’Afrique [
21
]. D’autres facteurs de prédisposition liés à l’évolution vers des formes sévères de dengue incluent l’âge du sujet infecté (le risque de dengue sévère est plus élevé chez les enfants et les personnes âgées), et l’existence de syndromes métaboliques qui pouvent fragiliser la mise en place d’une immunité antivirale protectrice. Le pouvoir pathogène des souches virales circulantes et les facteurs de prédisposition d’une population ciblée par le virus devront être pris en compte dans le développement d’un vaccin efficace contre la dengue sévère [
22
].
Que nous enseigne l’infection naturelle sur l’immunité dirigée contre les quatre sérotypes de DENV ?
La réponse à l’infection débute au niveau cutané, lorsque la piqûre d’un moustique infecté inocule le virus et des protéines salivaires du vecteur, déclenchant le recrutement des cellules immunitaires innées, en particulier les cellules de Langerhans et les cellules dendritiques (DC) myéloïdes [
23
,
24
]. La migration vers les organes lymphoïdes des DC infectées déclenchera ensuite les réponses adaptatives humorales et cellulaires spécifiques du sérotype de DENV infectant [
25
,
26
]. Les anticorps produits lors d’une première infection neutraliseront le sérotype homologue. Les principales cibles des anticorps neutralisants sont les épitopes de la protéine d’enveloppe, de structure quaternaire, exposés à la surface du virion. Ces anticorps inhibent la liaison du virus à ses récepteurs d’entrée exprimés par la cellule hôte. Ils inhibent aussi la fusion de la particule virale internalisée avec les membranes des endosomes, étape initiatrice d’un cycle viral productif [
27
]. Cette immunité humorale homotypique, qui fait suite à la primo-infection, est protectrice et de longue durée [
28
]. Elle s’accompagne d’une immunité croisée contre les autres sérotypes viraux, mais celle-ci sera faible et de courte durée. Une seconde infection, par un sérotype différent, sera associée à un risque accru de progression vers une dengue hémorragique [
29
] associée à une ADE [
13
,
14
]. Lors de cette réaction immunitaire, les anticorps circulants, de classe IgG, spécifiques du sérotype primo-infectant, sont inefficaces à neutraliser un sérotype hétérologue responsable d’une inféction ultérieure. Complexés aux virions et se liant aux récepteurs qui leur sont dédiés, les FcR (récepteur du fragment Fc des IgG), ces IgG favoriseront l’entrée du second virus dans des cellules réfractaires à l’infection, entraînant une augmentation de la virémie et des réponses inflammatoires, et contribuant à l’hyperperméabilité vasculaire [
30
]. La sécrétion active de la protéine virale NS1, facteur de virulence comparable à une toxine, qui se lie aux cellules endothéliales du poumon, du cerveau ou du foie, explique également l’hyperperméabilité vasculaire. Elle modifie en effet la perméabilité de la barrière endothéliale vasculaire, à l’origine de fuite plasmatique caractéristique des formes hémorragiques de la dengue sévère. Une étude récente conforte l’importance des anticorps facilitants dans la dengue sévère en démontrant l’existence d’un possible corrélat entre des titres élevés d’anticorps non neutralisants et les charges virales importantes retrouvées habituellement dans les formes graves de la maladie [
31
]. À côté des anticorps neutralisants, l’immunité cellulaire spécifique contribue également à la protection contre les 4 sérotypes de DENV. Des études menées chez les personnes guéries de la dengue ont révélé l’existence de lymphocytes T avec de fortes réactions croisées visà-vis des différents sérotypes viraux [
32
]. L’infection virale aiguë est à l’origine d’une réponse de lymphocytes T CD8
+
qui sont principalement dirigés contre les protéines virales NS3, NS4b, et NS5 du sérotype infectant. Ces lymphocytes, aux fonctions cytotoxiques anti-virales, expriment le marqueur lymphocytaire de localisation cutanée (
cutaneous lymphocyte-associated antigen
, CLA), qui les oriente vers le site anatomique de la piqûre du moustique, où le virus a été inoculé. L’accumulation cutanée de ces lymphocytes T CD8
+
suggère leur rôle potentiellement protecteur en cas d’infection virale [
33
]. Les lymphocytes T CD4
+
, quant à eux, ont pour cibles préférentielles les protéines structurales de la capside, de l’enveloppe, et la protéine sécrétée NS1 du virus. Chez des sujets protégés contre la maladie, une association entre protection et présence de lymphocytes T CD4
+
spécifiques du sérotype infectant, exprimant les allèles HLA-DRB1 du complexe majeur d’histocompatibilité de classe II et fortement polarisés vers un phénotype cytotoxique mémoire, a été établie, suggérant le rôle protecteur de cette population de lymphocytes contre la maladie [
34
].
Quels sont les corrélats de protection ? Un corrélat de protection est défini comme un marqueur de la réponse immunitaire qui est statistiquement associé à la protection contre la maladie ou l’infection. Les corrélats de protection peuvent varier en fonction du statut immunitaire de l’individu, du sérotype du virus, et des tests immunologiques utilisés. Dans le cas de la dengue, ces corrélats ne sont pas clairement définis, mais des travaux récents, qui caractérisent l’immunité des formes asymptomatiques de l’infection virale, contribuent à leur identification.
Le risque de manifester des signes cliniques de la dengue augmente avec l’âge, et il est plus faible chez les enfants âgés de moins de 10 ans [
35
]. Grâce à une approche intégrée d’analyse de profils d’expression génique et de taux sériques de cytokines inflammatoires chez des enfants virémiques infectés par DENV-1, Simon-Lorière
et al
. ont montré que l’absence de symptômes est associée à une activation accrue des réponses adaptatives humorale et cellulaire, et à des mécanismes de rétrocontrôle appropriés, conduisant à l’élimination du virus sans activation immunitaire excessive [
36
].
Ces observations sont compatibles avec le rôle essentiel des anticorps neutralisants dans la réponse immunitaire protectrice [
37
,
38
]. En effet, l’étude de Bos
et al
. [
39
], réalisée dans une cohorte pédiatrique, montre que la protection contre la dengue symptomatique est corrélée à des titres élevés d’anticorps neutralisants préexistants. La réactivité croisée de ces anticorps préexistants est un facteur supplémentaire important de protection contre la dengue clinique, comme observé pour les sérotypes DENV-1 et DENV-2. Pour le sérotype DENV-3, la lyse des virions et la cytolyse des cellules infectées par le virus, sont en revanche primordiales pour la protection contre la maladie, lorsque ces fonctions lytiques préexistent à l’infection par ce sérotype [
40
]. Enfin, à titres équivalents, la capacité des anticorps neutralisants à inhiber l’entrée des particules virales entrée dans une cellule exprimant ou pas DC-SIGN (
dendritic cellspecific intercellular adhesion molecule-3 grabbing nonintegrin
), une lectine de type C facteur d’attachement et récepteur d’entrée du DENV, est associée à une évolution différente de l’infection [
39
].
Les titres d’anticorps neutralisants représentent donc un paramètre important pour différencier les individus protégés vis-à-vis de la dengue clinique de ceux qui ne le sont pas. Mais d’autres composantes de la réponse immunitaire, incluant la qualité des anticorps et d’autres fonctions, telles que celles dépendant du complément, doivent être considérées comme de potentiels corrélats de protection dans la conception et l’évaluation des vaccins contre la dengue. |
Vaccins contre la dengue, défis et futurs développements Les défis
Actuellement, il n’existe aucun médicament prophylactique ou curatif efficace contre la dengue. La molécule JNJ-1802, qui bloque l’interaction entre les protéines virales NS3 et NS4B au sein du complexe de réplication virale du DENV, s’est révélée prometteuse dans les études précliniques [
41
]. Des anticorps monoclonaux thérapeutiques contre la dengue sont également en cours d’étude [
42
].
Dans ce contexte, le développement d’un vaccin reste indispensable. Néanmoins, pour une protection simultanée et efficace contre les quatre sérotypes, il est nécessaire que la formulation d’un tel vaccin soit tétravalente. Le développement de vaccins contre la dengue a commencé dans les années 1920, et la vaccination est encore reconnue comme le dispositif central de la lutte contre la propagation de la dengue sévère à travers le monde. Néanmoins, la mise au point d’un vaccin sûr et efficace est entravée par la nécessaire induction d’une immunité protectrice contre les quatre sérotypes du DENV, et par l’éventualité que l’immunité partielle induite contre un sérotype puisse aggraver, en particulier par ADE, les symptômes de la maladie à la suite d’une infection hétérotypique ultérieure [
43
].
Les défis sont multiples, liés, en particulier, à l’absence de modèle animal pour reproduire à l’identique l’infection humaine, à la difficulté, pour les vaccins tétravalents réplicatifs, d’éviter un risque d’immunodominance développé par l’un des quatre sérotypes de DENV qui composent le vaccin, au constat que l’efficacité clinique n’est pas obligatoirement corrélée à des marqueurs immunologiques, et enfin à la nécessité de réaliser de très vastes essais d’efficacité, et de les prolonger sur le long-terme pour démontrer les effets bénéfiques du vaccin et son innocuité sur diverses populations et divers paramètres cliniques. Les stratégies vaccinales contre la dengue : premiers succès et interrogations
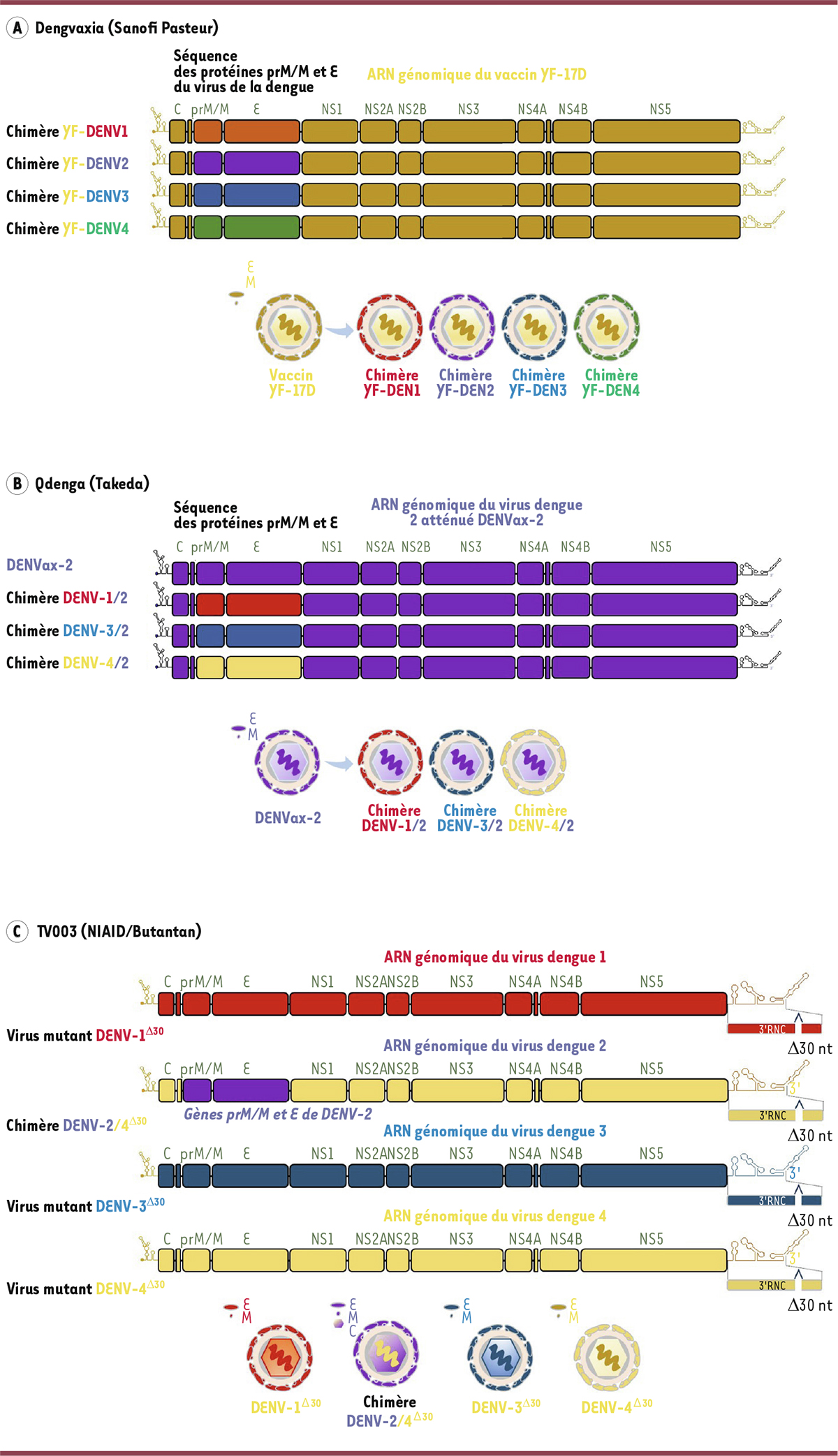
Bien que de nombreuses approches aient été explorées, les vaccins les plus avancés contre la dengue sont tous tétravalents et fondés sur des virus vivants atténués recombinants. La
Figure 4
décrit les constructions vaccinales et le
Tableau I
détaille les caractéristiques d’efficacité de deux vaccins actuellement autorisés et d’un troisième vaccin en cours de développement au Brésil, que nous présentons ici.
 | Figure 4.
Les vaccins contre la Dengue. Développement de vaccins vivants atténués par génétique inverse
.
Les virus vivants atténués sont obtenus par la méthode de génétique inverse qui nécessite le clonage de l’ARN génomique (environ 10-11 kilobases) issus des quatre DENV sous la forme d’un seul ou de plusieurs ADN complémentaires qui sont insérés dans des vecteurs plasmidiques. Les gènes viraux clonés ont été conçus de telle manière qu’ils puissent être modifiés par mutagenèse dirigée et permettre la production de virus chimères associant des séquences issues de différents virus.
A
.
Le vaccin Deng-vaxia est composé de quatre virus chimères qui dérivent du clone moléculaire du vaccin vivant 17D du virus de la fièvre jaune (en or). La séquence des glycoprotéines d’enveloppe d’origine a été remplacée par celles des quatre DENV (rouge, violette, bleue et verte) pour générer des virus chimères dont le génome viral correspond au virus 17D tandis que les protéines de surface sont celles de DENV.
B
.
Le vaccin Qdenga est composé de quatre DENV dont trois sont des chimères. Le clone moléculaire du virus vaccinal DENVax 2 (en violet) été modifié par génétique inverse pour remplacer la séquence des glycoprotéines d’enveloppe d’origine par celles des autres sérotypes, 1 (en rouge), 3 (en bleu) et 4 (en jaune). Le génome des virus chimères correspond à DEN-Vax-2 tandis que les protéines de surface du virion proviennent de DENV-1, DENV-3 ou DEN-4.
C
.
Le vaccin TV003 regroupe quatre DENV mutants portant chacun une délétion de 30 nt (∆30) à l’extrémité 3’ de la région non-codante (RNC) en 3’ du génome viral. Cette délétion est responsable de l’atténuation des DENV. Le clone moléculaire DENV-2 est le seul virus chimérique dont l’ARN génomique correspond à DENV-4 et les protéines d’enveloppe sont celles de DENV-2 (en violet).
|
Tableau I.
|
Dengvaxia |
Qdenga |
TV003 |
|
Phase de l’essai clinique
|
III
|
III
|
III
|
|
|
Schéma vaccinal
|
0, 6, 12 mois |
0, 3 mois |
1 dose |
|
|
Âge
|
2 à 14 ans |
6 à 16 ans |
2 à 59 ans |
|
|
Efficacité à court terme (référence)
|
25 mois (post 1
re
dose)
[
44
]
|
27 mois (post 1
re
dose)
[
48
]
|
2 ans
[
53
]
|
|
| Contre la dengue virologiquement confirmée |
|
|
59,2 %
2 à 5 ans : 33,7 %
6 à 11 ans : 59,5 %
12 à 14 ans : 74,4 %
|
72,7 %
4 à 5 ans : 55,9 %
6 à 11 ans : 75,4 %
12 à 16 ans : 76,8 %
|
79,6 %
2 à 6 ans : 80,1 %
7 à 17 ans : 77,8 %
18 à 59 ans : 90,0 %
|
|
| Contre une hospitalisation |
67,2 % |
89,2 % |
NA |
|
| Contre la dengue virologiquement confirmée selon le sérotype |
|
| DENV-1 |
50,0 % |
69,0 % |
89,5 % |
|
| DENV-2 |
35,0 % |
90,8 % |
69,6 % |
|
| DENV-3 |
78,4 % |
51,4 % |
NA |
|
| DENV-4 |
75,3 % |
50,4 % |
NA |
|
| Contre la dengue virologiquement confirmée selon le statut sérologique |
|
| Séropositif |
74,3 % |
74,8 % |
89,2 % |
|
| Séronégatif |
35,5 % |
67,0 % |
73,6 % |
|
|
Efficacité à long terme (référence)
|
60 mois (post 1
re
dose)
[
12
]
|
57 mois (post 1
re
dose)
[
49
]
|
60 mois
|
|
| Contre dengue virologiquement confirmée |
|
|
NA |
61,2 % |
ND |
|
| Contre une hospitalisation |
Total : ND
Séropositif : 79 %
Séronégatif : 41 %
|
84,1 %
Séropositif : 85,9 %
Séronégatif : 79,3 %
|
ND |
|
|
Bénéfice / risque
|
Surrisque d’hospitalisation post-vaccinale pour la dengue chez l’enfant séronégatif de 2 à 8 ans |
Moins efficace sur le DENV-3 Trop peu de données sur le DENV-4 |
Pas de données sur le DENV-3 et le DENV-4 |
Efficacité des trois vaccins contre la dengue
(Dengvaxia, Qdenga, et TV003). ND : non disponible ; NA : non applicable.
|
CYD-TDV (Dengvaxia) a été le premier vaccin approuvé (depuis 2015) par les autorités de réglementation d’une vingtaine de pays d’Europe, d’Asie, d’Amérique latine et des États-Unis, pour la prévention de la dengue contre les quatre sérotypes du DENV. CYD-TDV est un vaccin vivant atténué réplicatif, qui utilise la souche vaccinale de la fièvre jaune 17D (YF17D) dans laquelle les régions codant la protéine membranaire (prM) et l’enveloppe (E)
2,
de YF17D ont été remplacées par celles issues des quatre sérotypes de DENV (
Figure 4A
). Il est administré selon un schéma de trois doses espacées de six mois. Ce vaccin a été testé pour sa capacité à réduire les formes symptomatiques de dengue, confirmée virologiquement, dans un essai clinique de phase III multicentrique. Cet essai a été réalisé chez des enfants âgés de 2 à 14 ans dans plusieurs pays d’Asie où la dengue est endémique. CYD-TDV a montré une efficacité globale contre la dengue, virologiquement confirmée, de 59,2 %, avec une efficacité contre la dengue hémorragique très importante : 80 % après une première injection et 88 % après trois injections. Cependant, l’efficacité vaccinale est variable en fonction du sérotype puisqu’elle n’est que de 35 % contre DENV-2, alors qu’elle est supérieure à 75 % contre DENV-3 et DENV-4, et 50 % contre DENV-1 (
Tableau I
) [
44
]. Pour expliquer son efficacité modeste contre DENV-2, une des hypothèses avancées est l’absence de protéines non structurales (NS) du virus dans la formulation vaccinale. En effet, les anticorps neutralisants et les réponses lymphocytaires T CD8+ contre les protéines NS contribuent potentiellement à la protection vaccinale [
45
]. Après un suivi de 3 ans, il s’est avéré que les enfants âgés de 2 à 5 ans, vaccinés et séronégatifs, étaient 8 fois plus à risque d’être hospitalisés pour une forme grave de dengue que les enfants n’ayant pas été vaccinés. Ce surrisque est lié au statut sérologique des individus avant la vaccination. En effet, si l’efficacité du vaccin est de 76 % chez les sujets ayant été préalablement exposés à la dengue, elle est réduite à 39 % chez les sujets séronégatifs. Chez ces derniers, le déclenchement d’une ADE lors d’une infection ultérieure serait responsable des complications et de la survenue d’une dengue sévère [
46
]. Suite à ces résultats, et compte tenu de la faible séroprévalence de la dengue sur l’île de la Réunion et à Mayotte, la Haute autorité de santé (HAS) n’a pas recommandé l’utilisation de Dengvaxia dans ces territoires. Cependant, dans les territoires français d’Amérique (Antilles et Guyane) où la dengue circule plus largement, la vaccination peut être proposée, à l’initiative du médecin, seulement pour les personnes âgées de 9 à 45 ans ayant une précédente infection avérée par le virus de la dengue.
TAK-003 (Qdenga) est un vaccin tétravalent vivant atténué. Il a été construit à partir d’une souche atténuée de DENV, DENV-2-PDK-53, après 3 mutations aux locus 5’NC-NS1 et NS3, et plusieurs passages en culture cellulaire, pour alterer sa capacité de réplication chez le moustique
Ae. aegypti
et chez l’homme [
47
]. Ces souches mutées et attténuées constituent l’ossature des quatre virus utilisés dans le vaccin (
Figure 4B
). Évalué dans un essai de phase III en double aveugle chez des enfants âgés de 4 à 16 ans, dans 8 pays où la dengue est endémique, l’efficacité globale de ce vaccin contre la dengue, virologiquement confirmée, était, après 2 doses de vaccin, de 72,7 % 2 ans après l’administration de la première dose [
48
]. Cependant, l’analyse stratifiée de son efficacité varie selon les groupes d’âge, mais aussi selon les sérotypes (
Tableau I
) et le statut sérologique initial. Le suivi à long-terme, 57 mois post-première dose, des enfants et adolescents vaccinés, a montré une bonne efficacité du TAK-003 contre les quatre sérotypes de DENV, lorsque les participants étaient séropositifs avant vaccination. Chez les participants séronégatifs avant vaccination, pour lesquels aucun surrisque d’hospitalisation n’a été détecté après 4 ans et demi de suivi, l’efficacité du vaccin a été démontrée contre le DENV-1 et le DENV-2, mais pas contre le DENV-3, et une faible circulation de DENV-4 pendant l’essai vaccinal a empêché l’évaluation de son efficacité contre ce sérotype [
49
]. La comparaison de l’immunogénicité des deux vaccins CYD-TDV et TAK-003 suggère que les réponses immunitaires induites, non seulement par les protéines prM et E, mais aussi par les protéines de capside et les 7 protéines non structurale NS de DENV-2 contenues dans TAK-003, ont contribué à l’efficacité élevée de la protection contre le DENV-2. Le profil d’efficacité de TAK-003 diffère également de celui du CYD-TDV car il n’y a pas, au cours des premières années de suivi, d’indication d’un risque accru de sévérité de la maladie après la vaccination par TAK-003 chez les participants naïfs de la dengue. Mais cela nécessite d’être confirmé par un suivi à plus long terme. TAK-003 a été approuvé par la Commission européenne en 2022, chez les personnes âgées de 4 ans et plus, indépendamment d’une exposition antérieure à la dengue. Il est recommandé par l’OMS pour les zones endémiques depuis septembre 2023 [
50
]. Il est maintenant inclus dans le programme d’immunisation national pour les adolescents au Brésil [
51
].
Une troisième approche, développée par le
National Institute of Allergy and Infectious Diseases
(NIAID), est fondée sur des vaccins tétravalents vivants atténués à dose unique. Parmi ces vaccins, TV003 (en phase III) et TV005 (en phase II) sont des candidats de premier plan. Ils sont composés de trois virus complets (DENV-1, DENV-3 et DENV-4) contenant tous les gènes viraux codant les protéines structurales et non structurales de type sauvage, et d’un virus chimérique, dans lequel les gènes codant prM et E de DENV-4 ont été remplacés par ceux de DENV-2. Ces virus sont atténués par une délétion commune de 30 (Δ30) ou de 31 (Δ31) nucléotides dans la région non traduite (UTR,
untranslated region
) en 3’ du génome viral (
Figure 4C
) [
52
].
L’institut Butantan, au Brésil, a développé le vaccin Butantan-DV, fondé sur la formulation de TV003, contenant les virus DENV-1, DENV-3 et DENV-4 atténués, et une chimère DENV-2/DENV-4. Dans un essai de phase III contre placebo, Butantan-DV a été administré à plus de 10 000 enfants et adultes dans cinq régions géographiques du Brésil [
53
]. Une seule administration de ce vaccin a protégé contre la dengue symptomatique induite par DENV-1 et DENV-2 chez 89,2 % des sujets ayant été préalablement exposés au virus, et 73,6 % chez des sujets naïfs (
Tableau I
) [
53
]. La protection contre les sérotypes 3 et 4 n’a pas pu être étudiée car ces virus ne circulaient pas au cours de la période de suivi.
Quels enseignements peut-on tirer du développement des vaccins chimériques atténués en termes d’immunité vaccinale ?
Les avancées récentes dans le développement des trois vaccins CYD-TDV, TAK-003 et Butantan-DV ont apporté de nouvelles informations permettant de mieux caractériser l’immunité vaccinale protectrice, notamment : 1) si l’activité neutralisante des anticorps est une composante essentielle de la réponse immunitaire protectrice, d’autres fonctions des anticorps, telles que celles dépendant des récepteurs Fc (FcR), pourraient être des corrélats de protection ; 2) l’obtention d’une protection immunitaire robuste nécessite une immunisation avec un génome DENV le plus complet possible et incluant les protéines NS, en particulier NS1, cibles des lymphocytes T CD8
+
, qui contribuent de manière importante à l’immunité protectrice homotypique et hétérotypique [
54
] ; 3) la nécessité d’inclure l’évaluation des réponses lymphocytaires T CD4
+
et T CD8
+
dans les essais d’efficacité, puisqu’elles sont associées à la protection vaccinale ; 4) l’obligation de suivre sur le long-terme l’innocuité des candidats vaccins, à cause des effets facilitant l’infection qu’ils pourraient induire ; 5) la recherche de nouveaux corrélats de protection, qui pourrait être menée à partir des données des réponses humorales et cellulaires des essais d’efficacité de phase III des vaccins CYD-TDV, TAK-003 et Butantan-DV. En particulier, la recherche d’anticorps non neutralisants associés à une protection contre la dengue symptomatique [
39
,
40
].
|
Rôle attendu de la vaccination dans la lutte contre la dengue dans l’Union européenne et les territoires ultramarins français
Le développement d’un vaccin contre la dengue est à considérer en santé publique, non seulement pour les départements et régions d’outre-mer (DROM) où la dengue est endémique, notamment en Guyane, en Guadeloupe, en Martinique, à Mayotte et à La Réunion, mais aussi pour les pays de l’Union européenne dans lesquels on observe une installation progressive de la dengue, avec une fréquence accrue de cas autochtones de plus en plus fréquents. Entre 2010 et 2023, 275 cas autochtones ont en effet été enregistrés sur le continent de l’Union européenne, et 45 cas dans l’Hexagone en 2023. La transmission du virus de la dengue en Europe repose principalement sur le moustique
Ae. albopictus
. Les conditions météorologiques actuelles sont propices à la propagation de ce vecteur, à la réplication du virus dans ces moustiques et à la transmission de la dengue.
Actuellement, deux vaccins contre la dengue sont autorisés en France, Dengvaxia et Qdenga. La HAS [
55
] n’a pas encore intégré le vaccin contre la dengue dans ses recommandations vaccinales, mais celles-ci indiquent que le vaccin Dengvaxia peut être proposé dans les territoires français d’Amérique (Antilles et Guyane), exclusivement pour les personnes âgées de 9 à 45 ans ayant la preuve d’une infection antérieure. L’Agence européenne des médicaments (EMA,
European Medicines Agency
) a autorisé en décembre 2022 le vaccin Qdenga (TAK-003) en Europe chez l’adulte, l’adolescent et l’enfant dès l’âge de 4 ans, quel que soit leur statut sérologique, avec un schéma d’administration de deux doses sous-cutanées à 3 mois d’intervalle. Ce vaccin est approuvé et recommandé pour des populations spécifiques en Indonésie, en Thailande, au Brésil et en Argentine. La mise à disposition récente du vaccin Qdenga a conduit à une réévaluation par la HAS de la stratégie de vaccination contre la dengue. Dans un document publié le 5 juillet 2024, la HAS recommande la mise en place de la vaccination contre la dengue par le vaccin Qdenga pour les enfants et adolescents âgés de 6 à 16 ans, résidant dans les territoires français d’Amérique (Antilles et Guyane), dont les parents ou tuteurs légaux sont dans la capacité de produire une preuve documentée d’une infection antérieure à la dengue ou cliniquement diagnostiquée [
56
]. La mise en œuvre d’une stratégie de dépistage pré-vaccinal pour confirmer une infection antérieure par le virus de la dengue est difficilement réalisable, en raison de la faible spécificité et sensibilité des tests sérologiques disponibles. De plus, la réactivité croisée des tests diagnostiques entre les différents flavivirus (notamment le virus Zika, le virus West Nile et le virus de la fièvre jaune) peut aboutir à des résultats sérologiques faussement positifs.
Les enjeux de santé publique, en France, sont d’assurer une vaccination efficace, sans surrisque de développement de dengue sévère chez les personnes sans épisode connu d’infection préalable par le DENV, d’assurer une protection contre la dengue symptomatique et diminuer les taux d’hospitalisation dans les DROM endémiques pour la maladie et prévenir le risque dans l’Hexagone, et de réduire significativement la mortalité associée aux manifestations les plus graves de la dengue. Parallèlement au développement de vaccins, la prévention devra continuer de reposer sur la lutte antivectorielle, dont le but est de limiter la prolifération des moustiques. Elle repose sur une surveillance entomologique, la destruction des gites larvaires, des opérations de démoustication lors de la survenue de cas d’arboviroses, et des programmes de lutte biologique reposant sur la bactérie
Wolbachia
, une bactérie présente chez plus de 70 % des insectes, capable d’agir sur leur reproduction et de réduire la transmission des virus [
57
].
|
Les auteurs souhaitent remercier Wahida Tabet-Aoul (Takeda) pour la relecture du manuscrit, et Andrew Lane (Lane Medical Writing), financé par Takeda, pour son soutien éditorial sous la direction des auteurs. Le contenu de ce manuscrit, l’interprétation finale et la décision de le soumettre à médecine/sciences ont été pris par les auteurs en toute indépendance
.
|
Footnotes |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. Laurent Bellec a une activité de consultant rémunéré pour l’entreprise Takeda
.
|
1.
Guzman
MG
,
Gubler
DJ
,
Izquierdo
A
,
et al.
Dengue infection.
.
Nat Rev Dis Primers
.
2016;
;
2
:
:16055.
.
2.
Balmaseda
A
,
Hammond
SN
,
Perez
L
,
et al.
Serotype-specific differences in clinical manifestations of dengue.
.
Am J Trop Med Hyg
2006;
;
74
:
:449.
–
56
.
4.
Messina
JP
,
Brady
OJ
,
Scott
TW
,
et al.
Global spread of dengue virus types : mapping the 70 year history.
.
Trends Microbiol
2014;
;
22
:
:138.
–
46
.
5.
Marques-Toledo
CA
,
Bendati
MM
,
Codeco
CT
,
et al.
Probability of dengue transmission and propagation in a non-endemic temperate area : conceptual model and decision risk levels for early alert, prevention and control.
.
Parasit Vectors
2019;
;
12
:
:38.
.
7.
Zatta
M
,
Brichler
S
,
Vindrios
W
,
et al.
Autochthonous dengue outbreak, Paris region, France, September-October 2023.
.
Emerg Infect Dis
2023;
;
29
:
:2538.
–
40
.
10.
Santé Publique France.
.
Point Epidémiologique Régional : La Réunion
.
.
Dengue;
,
25 janvier 2024. pe_reunion_20240125(5).pdf.
.
12.
Paz-Bailey
G
,
Adams
LE
,
Deen
J
,
et al.
Dengue.
.
Lancet
2024;
;
403
:
:667.
–
82
.
13.
Bournazos
S
,
Gupta
A
,
Ravetch
JV
.
The role of IgG Fc receptors in antibody-dependent enhancement.
.
Nat Rev Immunol
2020;
;
20
:
:633.
–
43
.
14.
Sarker
A
,
Dhama
N
,
Gupta
RD
.
Dengue virus neutralizing antibody : a review of targets, cross-reactivity, and antibody-dependent enhancement.
.
Front Immunol
.
2023;
;
14
:
:1200195.
.
15.
Prommalikit
P
and
Thisyakom
U.
Dengue virus virulence and disease severity.
.
Southeast Asian J Trop Med Public Health
2015;
;
46
:
:35.
–
42
16.
Inizan
C
,
Miier
M
,
Prot
M
,
et al.
Viral evolution sustains a dengue outbreak of enhanced severity.
.
Emerg. Microbes Infect
2021;
;
10
:
:536.
–
44
17.
Lebeau
G
,
Lagrave
A
,
Ogire
E
,
et al.
Viral toxin NS1 implication in dengue pathogenesis making it a pivotal role target in development of efficient vaccine.
.
Vaccines
2021;
;
9
:
:946.
18.
Ogire
E
,
Diaz
O
,
Vidalain
O
,
et al.
Instability of the NS1 glycoprotein from La Reunion 2018 dengue 2 virus (Cosmopolitan-1 genotype) in Huh7 cells is due to lysine residues on positions 272 and 324.
.
Int J Mol Sci
2021;
;
22
:
:1951.
.
19.
Coffey
LL
,
Mertens
E
,
Brehin
AC
,
et al.
Human genetic determinants of dengue virus susceptibility.
.
Microbes Infection
2009;
;
11
:
:143.
–
56
.
20.
Pare
G
,
Neupane
B
,
Eskandarian
S
,
et al.
Genetic risk for dengue hemorragic fever and dengue fever in multiple ancestors.
.
EBioMed
51
;
2020;
:
:102584.
.
21.
Oliveira
M
,
Lert-itthipporn
W
,
Cavadas chakit
K.
Joint ancestry and association test indicate two distinct pathogenic pathways involved in classical dengue fever and dengue shock syndrome.
.
PLoS Negl. Trop. Dis
.
2018;
;
12
:
:e0006202.
.
22.
Sharp
TM
,
Anderson
KB
,
Katzelnick
LC
,
et al.
Knowledge gaps in the epidemiology of severe dengue impede vaccine evaluation.
.
Lancet Infect Dis
2022;
;
22
:
:e42.
–
51
.
23.
Helgers
LC
,
Keijzer
NCH
,
van Hamme
JL
,
et al.
Dengue virus infects human skin Langerhans cells through langerin for dissemination to dendritic cells.
.
J Invest Dermatol
2023;
;
144
(
(5)
) :
:1099.
–
111
.
24.
Wu
SJ
,
Grouard-Vogel
G
,
Sun
W
,
et al.
Human skin Langerhans cells are targets of dengue virus infection.
.
Nat Med
2000;
;
6
:
:816.
–
20
.
25.
Fernandes-Santos
C
,
Azeredo
EL
.
Innate immune response to dengue virus : toll-like receptors and antiviral response.
.
Viruses
2022;
;
14
:
:992.
.
26.
Ooi
EE
,
Kalimuddin
S
.
Insights into dengue immunity from vaccine trials.
.
Sci Transl Med
2023;
;
15
:
:eadh3067.
.
27.
Clapham
HE
,
Rodriguez-Barraquer
I
,
Azman
AS
,
et al.
Dengue virus (DENV) neutralizing antibody kinetics in children after symptomatic primary and postprimary DENV infection.
.
J Infect Dis
2016;
;
213
:
:1428.
–
35
.
28.
Montoya
M
,
Gresh
L
,
Mercado
JC
,
et al.
Symptomatic versus inapparent outcome in repeat dengue virus infections is influenced by the time interval between infections and study year.
.
PLoS Negl Trop Dis
2013;
;
7
:
:e2357.
.
29.
Wilder-Smith
A
,
Ooi
EE
,
Horstick
O
,
et al.
Dengue.
.
Lancet
2019;
;
393
:
:350.
–
63
.
30.
Modhiran
N
,
Kalayanarooj
S
,
Ubol
S
.
Subversion of innate defenses by the interplay between DENV and pre-existing enhancing antibodies : TLRs signaling collapse.
.
PLoS Negl Trop Dis
2010;
;
4
:
:e924.
.
31.
Waggoner
JJ
,
Katzelnick
LC
,
Burger-Calderon
R
,
et al.
Antibody-dependent enhancement of severe disease is mediated by serum viral load in pediatric dengue virus infections.
.
J Infect Dis
2020;
;
221
:
:1846.
–
54
.
32.
Tian
Y
,
Grifoni
A
,
Sette
A
,
et al.
Human T cell response to dengue virus infection.
.
Front Immunol
2019;
;
10
:
:2125.
.
33.
Rivino
L
,
Kumaran
EA
,
Thein
TL
,
et al.
Virus-specific T lymphocytes home to the skin during natural dengue infection.
.
Sci Transl Med
2015;
;
7
:
:278ra35.
.
34.
Weiskopf
D
,
Bangs
DJ
,
Sidney
J
,
et al.
Dengue virus infection elicits highly polarized CX3CR1+ cytotoxic CD4+ T cells associated with protective immunity.
.
Proc Nat Acad Sci USA
2015;
;
112
:
:E4256.
–
63
.
35.
Thai
KT
,
Nishiura
H
,
Hoang
PL
,
et al.
Age-specificity of clinical dengue during primary and secondary infections.
.
PLoS Negl Trop Dis
2011;
;
5
:
:e1180.
.
36.
Simon-Loriere
E
,
Duong
V
,
Tawfik
A
,
et al.
Increased adaptive immune responses and proper feedback regulation protect against clinical dengue.
.
Sci Transl Med
2017;
;
9
:
:eaal5088.
.
37.
Buddhari
D
,
Aldstadt
J
,
Endy
TP
,
et al.
Dengue virus neutralizing antibody levels associated with protection from infection in Thai cluster studies.
.
PLoS Negl Trop Dis
2014;
;
8
:
:e3230.
.
38.
Katzelnick
LC
,
Montoya
M
,
Gresh
L
,
et al.
Neutralizing antibody titers against dengue virus correlate with protection from symptomatic infection in a longitudinal cohort.
.
Proc Nat Acad Sci USA
2016;
;
113
:
:728.
–
33
.
39.
Bos
S
,
Graber
AL
,
Cardona-Ospina
JA
,
et al.
Protection against symptomatic dengue infection by neutralizing antibodies varies by infection history and infecting serotype.
.
Nat Commun
2024;
;
15
:
:382.
.
40.
Dias
AG
,
Jr.
,
Atyeo
C
,
Loos
C
,
et al.
Antibody Fc characteristics and effector functions correlate with protection from symptomatic dengue virus type 3 infection.
.
Sci Transl Med
2022;
;
14
:
:eabm3151.
.
41.
Goethals
O
,
Kaptein
SJF
,
Kesteleyn
B
,
et al.
Blocking NS3-NS4B interaction inhibits dengue virus in non-human primates.
.
Nature
2023;
;
615
:
:678.
–
86
.
42.
Tien
SM
,
Chang
PC
,
Lai
YC
,
et al.
Therapeutic efficacy of humanized monoclonal antibodies targeting dengue virus nonstructural protein 1 in the mouse model.
.
PLoS Pathog
2022;
;
18
:
:e1010469.
.
43.
Martinez
DR
,
Metz
SW
,
Baric
RS
.
Dengue vaccines : the promise and pitfalls of antibody-mediated protection.
.
Cell Host Microbe
2021;
;
29
:
:P13.
–
22
.
44.
Capeding
MR
,
Tran
NH
,
Hadinegoro
SR
,
et al.
Clinical efficacy and safety of a novel tetravalent dengue vaccine in healthy children in Asia : a phase 3, randomised, observer-masked, placebo-controlled trial.
.
Lancet
2014;
Jul 10 ;
384
:
:1358.
–
65
.
45.
Biswal
S
,
Reynales
H
,
Saez-Llorens
X
,
et al.
Efficacy of a tetravalent dengue vaccine in healthy children and adolescents.
.
New Engl J Med
2019;
;
381
:
:2009.
–
19
.
46.
Shukla
R
,
Ramasamy
V
,
Shanmugam
RK
,
et al.
Antibody-dependent enhancement : a challenge for developing a safe dengue vaccine.
.
Front Cell Infect Microbiol
2020;
;
10
:
:572681.
.
47.
Huang
CY
,
Butrapet
S
,
Tsuchiya
KR
,
et al.
Dengue 2 PDK-53 virus as a chimeric carrier for tetravalent dengue vaccine development.
.
J Virol
2003;
;
77
:
:11436.
–
47
.
48.
Lopez-Medina
E
,
Biswal
S
,
Saez-Llorens
X
,
et al.
Efficacy of a dengue vaccine candidate (TAK-003) in healthy children and adolescents two years after vaccination.
.
J Infect Dis
2022;
;
225
(
(9)
) :
:1521.
–
32
.
49.
Tricou
V
,
Yu
D
,
Reynales
H
,
et al.
Long-term efficacy and safety of a tetravalent dengue vaccine (TAK-003) : 4.5-year results from a phase 3, randomised, double-blind, placebo-controlled trial.
.
Lancet Glob Health
2024;
;
12
:
:e257.
–
70
.
50.
Freedman
DO.
A new dengue vaccine (TAK-003) now WHO recommended in endemic areas ; what about travellers?
J Travel Med
2023;
;
30
:
:taad132.
.
51.
Alves
L.
Brazil to start widespread dengue vaccinations.
.
Lancet
2024;
;
403
:
:133.
.
52.
Alvarez
DE
,
De Lella Ezcurra
AL
,
Fucito
S
,
et al.
Role of RNA structures present at the 3’UTR of dengue virus on translation, RNA synthesis, and viral replication.
.
Virology
2005;
;
339
:
:200.
–
12
.
53.
Kallas
EG
,
Cintra
MAT
,
Moreira
JA
,
et al.
Live, attenuated, tetravalent Butantan-dengue vaccine in children and adults.
.
New Engl J Med
2024;
;
390
:
:397.
–
408
.
54.
Weiskopf
D
,
Cerpas
C
,
Angelo
MA
,
et al.
Human CD8+ T-cell responses against the 4 dengue virus serotypes are associated with distinct patterns of protein targets.
.
J Infect Dis
2015;
;
212
:
:1743.
–
51
.
57.
Reveillaud
J
,
Bordenstein
SR
,
Cruaud
C
,
et al.
The Wolbachia mobilome in Culex pipiens includes a putative plasmid.
.
Nat Commun
2019;
;
10
:
:1051.
.
59.
Vincent
M
,
Paty
MC
,
Gerardin
P
,
et al.
From dengue outbreaks to endemicity : Reunion Island, France, 2018 to 2021.
.
Euro Surveill
2023;
;
28
:
:2200769.
.
62.
Prakash
O
,
Verma
AK
,
Paliwal
A
,
et al.
Circulating serotypes andgenotypes of dengue virus in North India : An observational study.
.
Journal of Vector Borne Diseases
2024;
;
61
:
:117.
.
|