| |
| Med Sci (Paris). 40(10): 722–724. doi: 10.1051/medsci/2024123.FGL1, une nouvelle cible pour le traitement de l’anémie ? Thanina Medjbeur,1 Jean Personnaz,1 and Léon Kautz1* 1IRSD, Université de Toulouse, Inserm, INRAE, ENVT, Univ Toulouse III - Paul Sabatier (UPS)ToulouseFrance MeSH keywords: |
L’anémie est un problème majeur de santé publique, qui touche près d’un tiers de la population mondiale [
1
]. Elle se caractérise par un nombre de globules rouges (érythrocytes) fonctionnels, ou un taux d’hémoglobine, inférieur à la normale. Les origines de l’anémie sont multiples, mais les formes prédominantes sont causées par une carence en fer ou sont associées à un trouble du métabolisme du fer. Outre ses fonctions dans le métabolisme énergétique ou la synthèse des nucléotides, le fer, constituant essentiel de l’hémoglobine contenue dans les globules rouges, permet la fixation et le transport de l’oxygène dans le sang par cette protéine. Un déficit en fer, par l’anémie qui en résulte, peut donc entraîner une oxygénation tissulaire insuffisante, avec les diverses complications qui peuvent en découler. Inversement, un excès de fer peut favoriser la production de radicaux libres et devenir toxique, en particulier pour le foie, où il est stocké en grande majorité. Les surcharges en fer sont à l’origine de complications irréversibles, qui représentent la principale cause de mortalité chez les personnes atteintes d’hémochromatose ou de thalassémie. La quantité de fer dans l’organisme est donc finement régulée afin d’empêcher la survenue de symptômes liés à un déficit ou à un excès.
|
Un organisme humain adulte contient 3 à 4 g de fer, principalement dans les globules rouges (60-70 %), ainsi que dans le foie sous forme de réserve (25 %) [
2
]. Le fer circulant dans le sang provient majoritairement du recyclage des globules rouges sénescents par les macrophages, et de l’absorption, dans le duodénum, du fer contenu dans le bol alimentaire. Le fer est exporté hors des entérocytes, des hépatocytes et des macrophages par l’intermédiaire de la ferroportine, la seule molécule exportatrice de fer connue. Ce processus est contrôlé par l’hepcidine, une hormone peptidique synthétisée par le foie, qui se fixe sur la ferroportine, et entraîne son occlusion et sa dégradation, avec pour conséquence la séquestration du fer dans ces cellules [
3
] (
→
).
(→) Voir la Nouvelle de G. Nicolas, S. Vaulont,
m/s
n° 1, janvier 2005, page 7
L’expression du gène de l’hepcidine (
HAMP
) est modulée à l’étape transcriptionnelle en fonction des besoins en fer de l’organisme, principalement par la voie de signalisation BMP/SMAD [
4
] (
→
).
(→) Voir la Nouvelle de MP. Roth, H. Coppin,
m/s
n° 8-9, août-septembre 2009, page 678
La fixation des ligands BMP2 et 6 à un complexe de récepteurs à activité tyrosine kinase conduit à la phosphorylation des effecteurs cytoplasmiques SMAD1/5/8, lesquels, après translocation dans le noyau, activent le promoteur du gène de l’hepcidine (
Figure 1
).
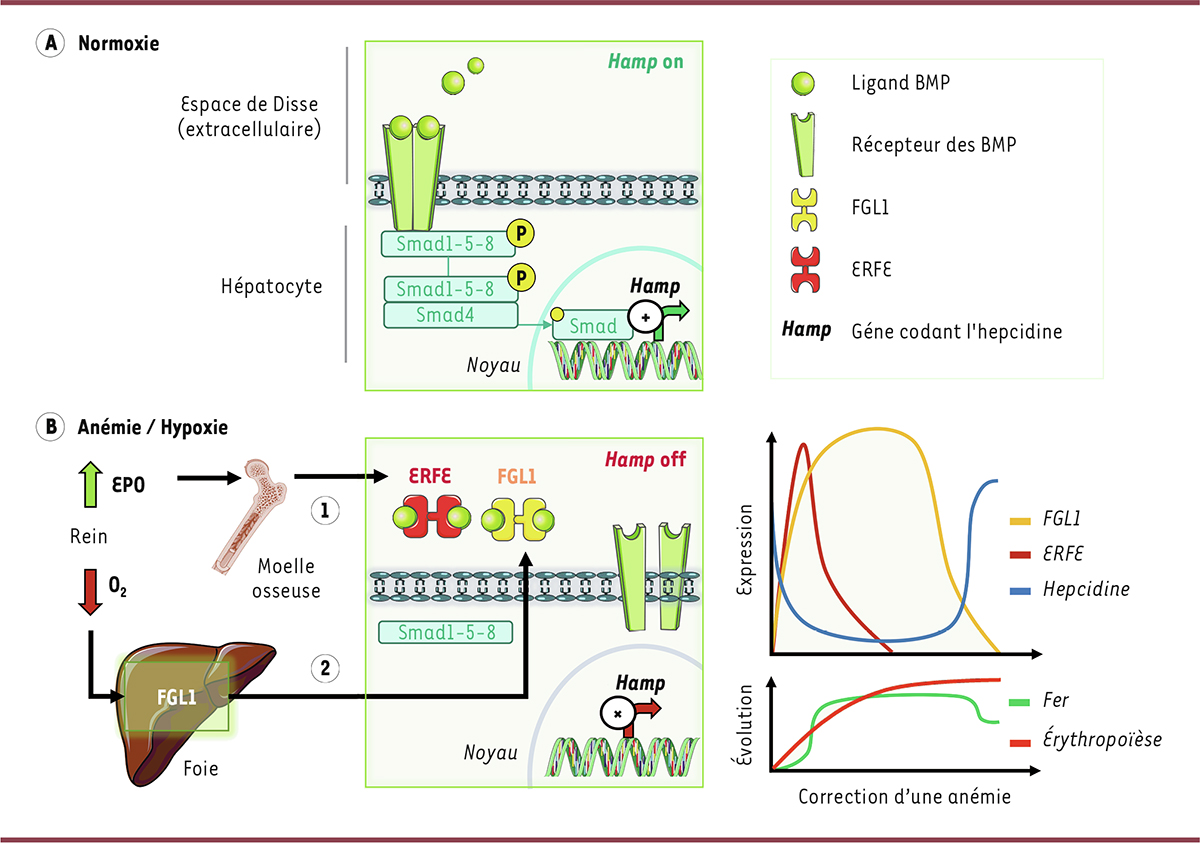
 | Figure 1.
La régulation du métabolisme du fer lors d’une anémie. A
.
En condition physiologique, la liaison des ligands BMP 2 et 6 à un complexe récepteur à la surface des hépatocytes induit la phosphorylation des effecteurs SMAD1/5/8. Ces derniers interagissent alors avec la navette SMAD4 pour être transportés dans le noyau, où ils se lient à des éléments de régulation du promoteur du gène codant l’hepcidine (
Hamp
). La synthèse de l’hepcidine est régulée de manière à maintenir un équilibre entre les besoins et les apports en fer.
B
.
Lorsque la concentration en oxygène du sang devient insuffisante à cause de l’anémie, les besoins en fer pour la synthèse de globules rouges compensatrice sont fortement augmentés. L’expression de l’érythroferrone (ERFE) est rapidement stimulée dans les précurseurs érythroïdes de la moelle osseuse et de la rate en réponse à l’érythropoïétine (EPO). Dans un second temps, la synthèse de FGL1 (
fibrinogen-like 1
) est activée dans les hépatocytes en réponse à l’hypoxie. ERFE et FGL1 séquestrent les ligands BMP pour inhiber l’expression du gène de l’hepcidine, ce qui augmente les apports en fer pour la synthèse de nouveaux globules rouges. Ce mécanisme en deux temps permet de rétablir le nombre des globules rouges ainsi qu’une oxygénation tissulaire physiologique.
|
|
L’érythropoïèse, c’est-à-dire la production d’environ deux millions d’hématies chaque seconde dans la moelle osseuse, requiert l’acheminement de 20 à 25 mg de fer par jour pour la formation d’hémoglobine. Une anémie due à une hémorragie, à une hémolyse, ou à toute autre cause entraîne la réduction de la saturation du sang en oxygène et la mise en place d’une réponse à l’hypoxie, déclenchée par la synthèse d’érythropoïétine dans les fibroblastes interstitiels des reins. La fixation de l’érythropoïétine à son récepteur à la surface des cellules précurseurs érythroïdes de la moelle osseuse stimule la production, la prolifération, la maturation et la survie de ces cellules afin de normaliser rapidement le nombre des globules rouges et leur capacité de transport de l’oxygène. En conséquence, la synthèse de l’hémoglobine et donc la consommation de fer par la moelle osseuse augmentent considérablement. Pour faire face à ce besoin accru en fer, l’hormone érythroferrone est rapidement (9 heures) produite par les précurseurs érythroïdes en réponse à l’érythropoïétine [
5
,
6
] (
→
). L’érythroferrone agit directement dans le foie en séquestrant les ligands BMP dans les sinusoïdes hépatiques pour empêcher l’activation du complexe de leurs récepteurs, avec pour conséquence la répression de la synthèse d’hepcidine et l’augmentation des apports en fer [
7
] (
Figure 1
). Ce mécanisme facilite la correction d’une anémie consécutive à une hémorragie, une hémolyse, ou une inflammation chronique [
8
]. Par ailleurs, une surproduction d’érythroferrone contribue en partie à la suppression pathologique de la synthèse de l’hepcidine à l’origine de l’hyperabsorption du fer alimentaire et de la surcharge en fer multiviscérale dans des anémies héréditaires telles que celle de la β-thalassémie [
9
]. Toutefois, la délétion du gène de l’érythroferrone dans un modèle murin de cette maladie n’a pas empêché complètement la correction de l’anémie et l’installation d’une surcharge en fer [
9
]. Il demeurait donc possible qu’un autre facteur, encore inconnu, contrôle la synthèse d’hepcidine lors de la phase de réparation de l’anémie.
(→) Voir la Nouvelle de L. Kautz
,
m/s
n° 10, octobre 2014, page 834
|
Fibrinogen-like 1
: une hépatokine réparatrice de l’anémie
Nous avons récemment mis en évidence la contribution de l’hépatokine
fibrinogen-like 1
(FGL1), une protéine sécrétée par les hépatocytes sous forme de dimère, à ce processus de contrôle [
10
]. FGL1 présente une homologie de structure avec les chaînes β et γ du fibrinogène, mais elle n’est pas impliquée dans la coagulation car elle est dépourvue des domaines de liaison aux plaquettes et de clivage par la thrombine. FGL1 serait impliquée dans la régénération hépatique, le contrôle du métabolisme glucidique et de la sensibilité à l’insuline, la pathogénèse de la stéatose hépatique et du cancer du foie, et l’échappement immunitaire de certains cancers, mais son rôle précis est mal connu [
11
]. Nous avons constaté que l’expression hépatocytaire de FGL1 était fortement augmentée chez des souris présentant une anémie consécutive à un prélèvement sanguin, ainsi que dans un modèle de souris thalassémiques. L’administration d’érythropoïétine chez la souris n’induit pas l’expression de
Fgl1
: cette induction est sous le contrôle direct des facteurs de réponse à l’hypoxie. Après avoir produit la protéine recombinante FGL1, nous avons évalué sa capacité à réprimer l’expression du gène de l’hepcidine chez la souris et dans des cultures d’hépatocytes. Nous avons constaté que l’expression de ce gène est réprimée en réponse à un traitement par FGL1
in vitro
et
in vivo
, et nous avons montré que ce contrôle est exercé par le domaine globulaire homologue au fibrinogène. Les souris dépourvues de FGL1 présentent une masse corporelle supérieure à celle des souris témoins et une moindre tolérance au glucose, mais leur métabolisme du fer et leurs paramètres hématologiques sont normaux. Cependant, ces souris présentent un taux d’hepcidine supérieur à celui des souris témoins en condition basale et lors d’une anémie induite par une perte de sang. FGL1 réprime la synthèse de l’hepcidine de manière similaire à l’érythroferrone, c’est-à-dire en séquestrant le ligand BMP6 pour inhiber la voie BMP/SMAD [
10
]. Les résultats indiquent que FGL1 prend le relais de l’érythroferrone afin de subvenir aux besoins en fer pour la synthèse de globules rouges lors de l’anémie (
Figure 1
).
|
Les résultats de ces travaux expérimentaux chez la souris montrent le rôle fondamental de FGL1 dans le contrôle de l’expression du gène de l’hepcidine et du métabolisme du fer lors d’une anémie, et suggèrent que le développement d’agonistes ou d’antagonistes de FGL1 pourrait constituer une nouvelle stratégie pour traiter différentes formes d’anémie. Cependant, la confirmation de ces résultats chez l’homme est rendue difficile par l’absence d’une méthode de dosage fiable de FGL1. Ce manque explique en partie les discordances de résultats concernant le rôle de FGL1 dans le métabolisme hépatique et l’évasion tumorale [
11
]. Notre équipe a développé une méthode immuno-enzymatique qui permettra de déterminer les niveaux de FGL1 chez des personnes atteintes de différentes formes d’anémies, et d’élucider la contribution de cette protéine dans la pathogénèse des stéatohépatites.
Des résultats préliminaires indiquent que FGL1 est également capable de réprimer la synthèse de l’hepcidine dans un contexte inflammatoire. Dans l’inflammation, la sortie du fer dans le sang est inhibée par une production excessive d’hepcidine : la quantité de fer disponible pour l’érythropoïèse devient insuffisante, ce qui, à terme, entraîne une anémie. L’administration de FGL1 ou de mimétiques de FGL1 dans ce contexte pourrait donc permettre de restaurer des taux normaux d’hepcidine, et de soulager ainsi les personnes atteintes d’une maladie inflammatoire chronique de l’anémie qui lui est fréquemment associée. Inversement, l’inhibition de FGL1 pourrait empêcher l’aggravation de la surcharge en fer secondaire qui accompagne certaines anémies, telle que celle des thalassémies. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article
.
|
1.
Sankaran
VG
,
Weiss
MJ
.
Anemia: progress in molecular mechanisms and therapies.
.
Nat Med
2015;
;
21
:
:221.
–
30
.
2.
Muckenthaler
MU
,
Rivella
S
,
Hentze
MW
,
Galy
B
.
A red carpet for iron metabolism.
.
Cell
2017;
;
168
:
:344.
–
61
.
3.
Nicolas
G
,
Vaulont
S
.
Le mécanisme d’action de l’hepcidine déchiffré.
.
Med Sci (Paris)
2005;
;
21
:
:7.
–
9
.
4.
Roth
MP
,
Coppin
H
.
BMP6, un acteur clé dans la régulation du métabolisme du fer.
.
Med Sci (Paris)
2009;
;
25
:
:678.
–
80
.
5.
Kautz
L
,
Jung
G
,
Valore
EV
,
et al.
.
Identification of erythroferrone as an erythroid regulator of iron metabolism.
.
Nat Genet
2014;
;
46
:
:678.
–
84
.
6.
Kautz
L
.
L’érythroferrone, un régulateur érythroïde du métabolisme du fer.
.
Med Sci (Paris)
2014;
;
30
:
:834.
–
6
.
7.
Arezes
J
,
Foy
N
,
McHugh
K
,
et al.
.
Erythroferrone inhibits the induction of hepcidin by BMP6.
.
Blood
2018;
;
132
:
:1473.
–
7
.
8.
Kautz
L
,
Jung
G
,
Nemeth
E
,
Ganz
T
.
Erythroferrone contributes to recovery from anemia of inflammation.
.
Blood
2014;
;
124
:
:2569.
–
74
.
9.
Kautz
L
,
Jung
G
,
Du
X
,
et al.
.
Erythroferrone contributes to hepcidin suppression and iron overload in a mouse model of beta-thalassemia.
.
Blood
2015;
;
126
:
:2031.
–
7
.
10.
Sardo
U
,
Perrier
P
,
Cormier
K
,
et al.
The hepatokine FGL1 regulates hepcidin and iron metabolism during anemia in mice by antagonizing BMP signaling.
.
Blood
2024;
;
143
:
:1282.
–
92
.
11.
Personnaz
J
,
Guillou
H
,
Kautz
L
.
Fibrinogen-like 1: A hepatokine linking liver physiology to hematology.
.
Hemasphere
2024;
;
8
:
:e115.
.
|