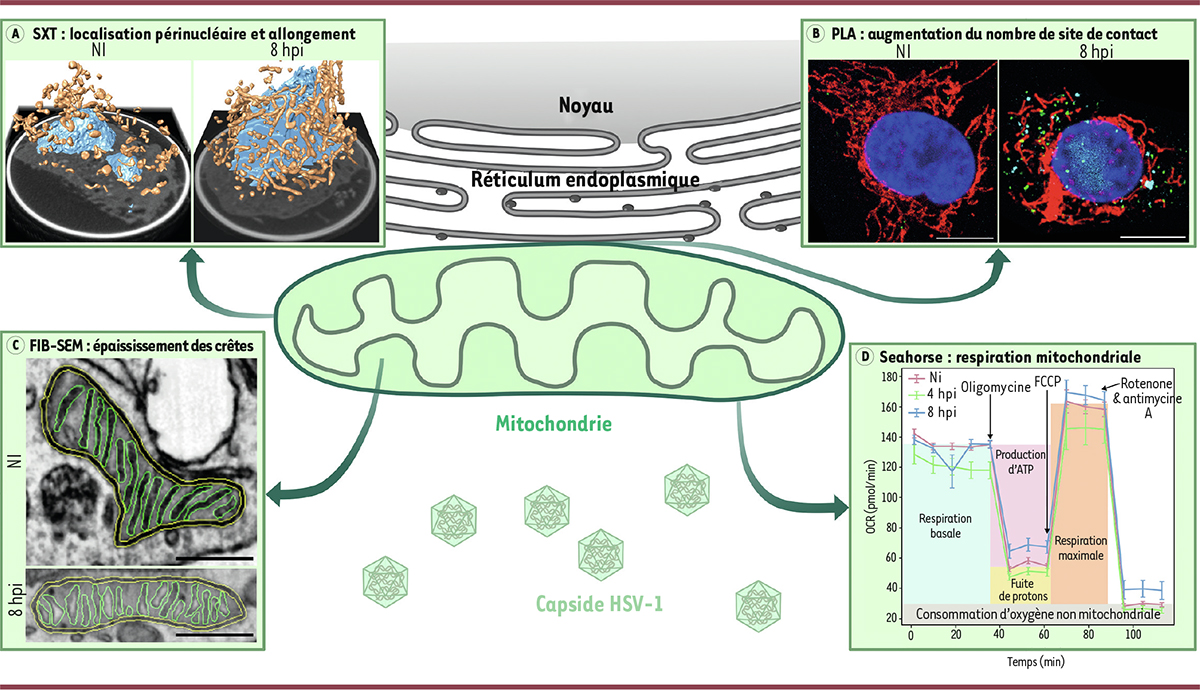
Les mitochondries, qui produisent la majeure partie de l’énergie pour la cellule, jouent un rôle critique dans la réponse immunitaire, notamment dans la défense anti-virale. Certains virus, dont le virus Herpes simplex de type 1 (HSV-1), ont ainsi la capacité de manipuler le fonctionnement mitochondrial dans les cellules infectées, notamment en rapport avec le métabolisme cellulaire et la réponse immunitaire, afin de faciliter leur propre réplication et leur propagation [ 1 ]. Environ 67 % des personnes âgées de moins de 50 ans ont déjà été infectées par HSV-1. Lors de l’infection, HSV-1 réorganise les fonctions métaboliques [ 2 ], la structure et la position des mitochondries dans la cellule en les déplaçant vers le noyau cellulaire et en les allongeant [ 3 , 4 ], ce qui les protège de l’autophagie et a également pour effet d’accroître leur production d’ATP [ 5 ]. Cependant, les conséquences de ces changements morphologiques et d’organisation des mitochondries sur leur fonctionnement restent mal connues. Nous avons caractérisé les changements de forme des mitochondries et de leurs crêtes mitochondriales 1 , ainsi que le métabolisme énergétique au cours de l’infection par HSV-1 [ 6 ].
La SXT ( soft-X ray tomography ) est une technique d’imagerie non-destructrice qui permet la reconstruction, en 3D et à haute résolution, de cellules vitrifiées 2 sans fixation chimique. Cette technique ne nécessite pas de marquage préalable des structures grâce au contraste naturel dû à l’absorption des rayons X par les atomes de carbone et d’azote, permettant ainsi la visualisation des membranes lipidiques et autres organelles [ 7 ]. Une reconstruction de la cellule entière est possible sur des cellules en suspension dans un tube capillaire en verre, ou, sur des cellules adhérentes, une reconstruction partielle de la cellule à une meilleur résolution spatiale au prix d’un champ de vision plus étroit ( Figure 1A ). Les fibroblastes d’embryon de souris ( mouse embryonic fibroblasts , MEF) immortalisés qui ont été utilisés pour cette étude sont des cellules adhérentes dans lesquelles le virus HSV-1 se réplique rapidement. Des centres de réplication virale se forment à partir de 4 heures post-infection (hpi), puis fusionnent à 8 hpi. À 12 hpi, on observe un détachement et un arrondissement de la cellule, et la mort cellulaire intervient généralement entre 16 et 20 hpi. En analysant d’abord les conséquences de l’infection sur des cellules MEF en suspension, nous avons montré que la densité aux rayons X des mitochondries augmente au cours de l’infection, ce qui témoigne de l’augmentation de leur contenu en lipides. Le nombre de mitochondries par cellule augmente jusqu’à 4 hpi, mais diminue après 8 hpi, tandis que le volume total des mitochondries augmente avec la progression de l’infection. Nous avons ainsi montré l’élongation des mitochondries ainsi que leur fusion pendant l’infection des cellules par HSV-1. En analysant ensuite des cellules MEF adhérentes, nous avons également confirmé le déplacement des mitochondries vers la membrane nucléaire et leur affinement, et constaté une augmentation de leur rugosité au cours de l’infection.
| Figure 1.
La structure et le fonctionnement de la mitochondrie sont modifiés en réponse à l’infection par le virus de l’herpès HSV-1. A
.
La microscopie tomographique aux rayons X mous (SXT) sur tube capillaire révèle la relocalisation périnucléaire des mitochondries et leur allongement lors de l’infection des cellules par HSV-1. Le noyau cellulaire est coloré en bleu, les mitochondries en orange, et les données originales en gris.
B
. Le rapprochement entre le réticulum endoplasmique et la mitochondrie est montré par une mesure de leur proximité (
proximity ligation assay
, PLA). Le noyau est coloré en bleu, les mitochondries en rouge, les points de contact entre réticulum endoplasmique et mitochondrie en vert, et le centre de réplication virale en cyan. Barre d’échelle = 10 µm.
C
.
L’épaississement des crêtes mitochondriales est mesuré après segmentation des données obtenues par microscopie électronique à balayage par faisceau d’ions focalisé (FIB-SEM). Le contour de la mitochondrie est coloré en jaune et celui des crêtes mitochondriales en vert. Barre d’échelle = 1 µm.
D
. La technique
Seahorse
permet de mesurer la consommation d’oxygène par la cellule (
oxygen consumption rate
, OCR) sur des cellules non infectées (NI), ou sur des cellules infectées par HSV1 analysées à 4 heures ou à 8 heures post-infection (hpi), à l’état basal ou après ajouts successifs de molécules inhibant la phosphorylation oxydante mitochondriale par différents mécanismes : oligomycine, FCCP, roténone, antimycine A. Le FCCP (
carbonyl cyanide-p-trifluoromethoxyphenylhydrazone
) est un agent découplant de la phosphorylation oxydante.
|
Le déplacement des mitochondries vers le noyau les rapproche du réticulum endoplasmique, ce réseau de membranes où se déroule la synthèse des protéines sécrétées. En observant les conséquences de l’infection sur des cellules MEF adhérentes par SBF-SEM ( serial block-face scanning electron microscopy ), nous avons mis en évidence la forte augmentation du nombre de points de contact entre les mitochondries et le réticulum endoplasmique lors de l’infection. La formation de ces points de contact, qui permettent des échanges de lipides, d’ions calcium et d’autres composants, implique l’interaction directe de protéines présentes dans la membrane de chacune des deux organelles. Nous avons donc analysé l’interaction entre deux protéines participant à l’attachement entre réticulum endoplasmique et mitochondrie, VAPB et RMDN3 respectivement, par la technique de PLA (p roximity ligation assay ), qui permet de mesurer un signal fluorescent si les deux protéines sont plus proches que 40 nm. Nous avons ainsi constaté que la distance et le nombre de points de contacts entre ces organelles augmentent jusqu’à 8 hpi, avant de diminuer légèrement en fin d’infection ( Figure 1B ).
Les images de SXT indiquaient que les crêtes mitochondriales subissent des changements structuraux pendant l’infection de cellules par HSV-1. Par la technique de FIB-SEM ( focused ion beam scanning electron microscopy ) ( Tableau I ), nous avons montré que les crêtes mitochondriales sont plus courtes et plus épaisses dans les cellules infectées par HSV-1 ( Figure 1C ).
Tableau I
Différentes méthodes de microscopie employées dans cette étude et leur limites.
| ||||||||||||||||||||||||||||||||||||||||||||||||
Afin d’analyser les conséquences de cette réorganisation des mitochondries sur le métabolisme énergétique, nous avons mesuré la consommation d’oxygène des cellules par la technique SeaHorse ( Figure 1D ). Nous avons observé une légère diminution temporaire de la production d’ATP à 4 hpi ainsi qu’une diminution de la respiration basale à 8 hpi, et une fuite de protons lorsque l’infection progresse. L’efficacité du couplage respiratoire mitochondrial (i.e., quantité d’ATP produite par molécule d’oxygène consommée) diminue également au fur et à mesure que l’infection progresse, jusqu’à 8 hpi, ce qui indique que l’infection par HSV-1 induit un changement graduel et dynamique du fonctionnement de la mitochondrie. Par ailleurs, la quantification des ions calcium présents dans la mitochondrie en utilisant un indicateur fluorescent (Rhod2-AM) a révélé une forte augmentation à 8 hpi.
Il existe un équilibre précaire entre la reprogrammation de la machinerie cellulaire par le virus et les défenses cellulaires, équilibre dans lequel la mitochondrie joue un rôle essentiel en contrôlant la production d’énergie ainsi que plusieurs systèmes anti-viraux. Cette étude met en évidence l’existence d’une reprogrammation du fonctionnement mitochondrial durant l’infection des cellules par HSV-1. Avec la production d’ADN, d’ARN et de protéines virales afin de contrôler la cellule et d’assembler de nouveaux virions, la dépense énergétique de la cellule est intense [ 8 ]. La forme de la mitochondrie est le résultat d’un équilibre entre les processus physiologiques de fusion et de fission, et elle change pendant l’apoptose cellulaire, caractérisée, entre autres, par une fragmentation et la libération de cytochrome c. Dans le cas de l’infection par HSV-1, la forme allongée et affinée des mitochondries entre 8 et 12 hpi indique que les évènements de fission sont inactivés ou inhibés, et que cet aspect de l’apoptose est ainsi sous contrôle viral. Le repositionnement des mitochondries à proximité du réticulum endoplasmique pourrait expliquer l’augmentation mesurée de la quantité d’ions calcium dans les mitochondries, mais également le nombre élevé de points de contact avec le réticulum endoplasmique. Ces contacts sont indispensables à la progression de l’infection pour de nombreux virus, dont HSV-1, mais également le virus Influenza A , le cytomégalovirus ou les β-coronavirus [ 9 ]. L’augmentation de la concentration intramitochondriale des ions calcium pourrait également être à l’origine de la restructuration des crêtes mitochondriales, par laquelle une plus grande courbure des crêtes est associée à une plus grande efficacité de la synthèse d’ATP. Cette efficacité accrue compenserait la fuite de protons de la mitochondrie afin de maintenir le niveau de production d’ATP, au moins jusqu’à 8 hpi.
Les résultats de cette étude ont donc contribué à éclaircir les interactions complexes entre HSV-1 et les mitochondries de la cellule hôte, et ouvrent de nouvelles pistes de recherche pour le développement de traitements antiviraux ciblant les mitochondries des cellules infectées.