| |
| Med Sci (Paris). 40(8-9): 688–691. doi: 10.1051/medsci/2024118.
Dictyostelium discoideum
Un modèle novateur pour l’étude de la phagocytose Bastien Charrat,1a* Martin Durrmeyer,1b* Wajdi Jaouad,1c* Solène Lejolivet,1d* Ugo Rodriguez,1e* and Amel Latifi2f 1Master 2 Microbiologie Intégrative et Fondamentale, Aix Marseille Université
,
Marseille
,
France 2Aix Marseille Université, CNRS, LCB UMR7283, IMM
,
Marseille
,
France MeSH keywords: Phagocytose, physiologie, Dictyostelium, physiologie, Humains, Animaux, Modèles biologiques |
Le sol est un environnement pauvre en nutriments où de nombreux micro-organismes sont en permanente compétition pour l’acquisition de nutriments.
Dictyostelium discoideum
est un organisme unicellulaire eucaryote de la famille des amibes capable d’adapter son mode de vie en fonction de la niche écologique qu’il colonise et de la disponibilité en nutriments. En cas de carence nutritionnelle,
D. discoideum
adopte un mode de vie communautaire et se nourrit par prédation de bactéries par phagocytose [
1
].
La phagocytose est un mécanisme hautement conservé chez les organismes eucaryotes. Chez les vertébrés, elle est utilisée par des cellules immunitaires, les macrophages essentiellement, afin d’éliminer des organismes pathogènes [
2
]. L’étude de la phagocytose chez les macrophages peut se révéler complexe et l’utilisation de modèles unicellulaires comme
D. discoideum
permet de s’affranchir de certaines de ces difficultés. C’est notamment le cas des contraintes liées à l’utilisation de modèles animaux. Cette nouvelle met en lumière, chez l’organisme modèle
D. discoideum
, un mécanisme de reconnaissance de la bactérie proie, la succession des étapes de la phagocytose ainsi que la spécificité de la réponse phagocytaire employée selon la proie internalisée.
|
La reconnaissance constitue la première étape de la phagocytose
Afin d’initier la phagocytose,
D. discoideum
doit reconnaître la bactérie proie dans le milieu extérieur [
3
]. Pour cela, l’amibe utilise des protéines réceptrices capables de détecter des signaux issus d’une proie. Ce signal peut être perçu indirectement, sous la forme de molécules sécrétées dans le milieu extérieur, comme c’est le cas pour la bactérie
Klebsiella pneumoniae
, dont la sécrétion de folate est reconnue par le récepteur Far1 de l’amibe (
Figure 1a
) [
5
]. La reconnaissance de la bactérie proie peut également être directe, notamment
via
des composants membranaires bactériens, tels que la capsule de
Staphylococcus aureus
(
Figure 1a
). La réception de ces signaux déclenche une cascade de signalisation intracellulaire stimulant la phagocytose, qui aboutit à l’internalisation de la bactérie proie au sein d’une vacuole de phagocytose, suivi par sa mort cellulaire puis la métabolisation de ses composants.
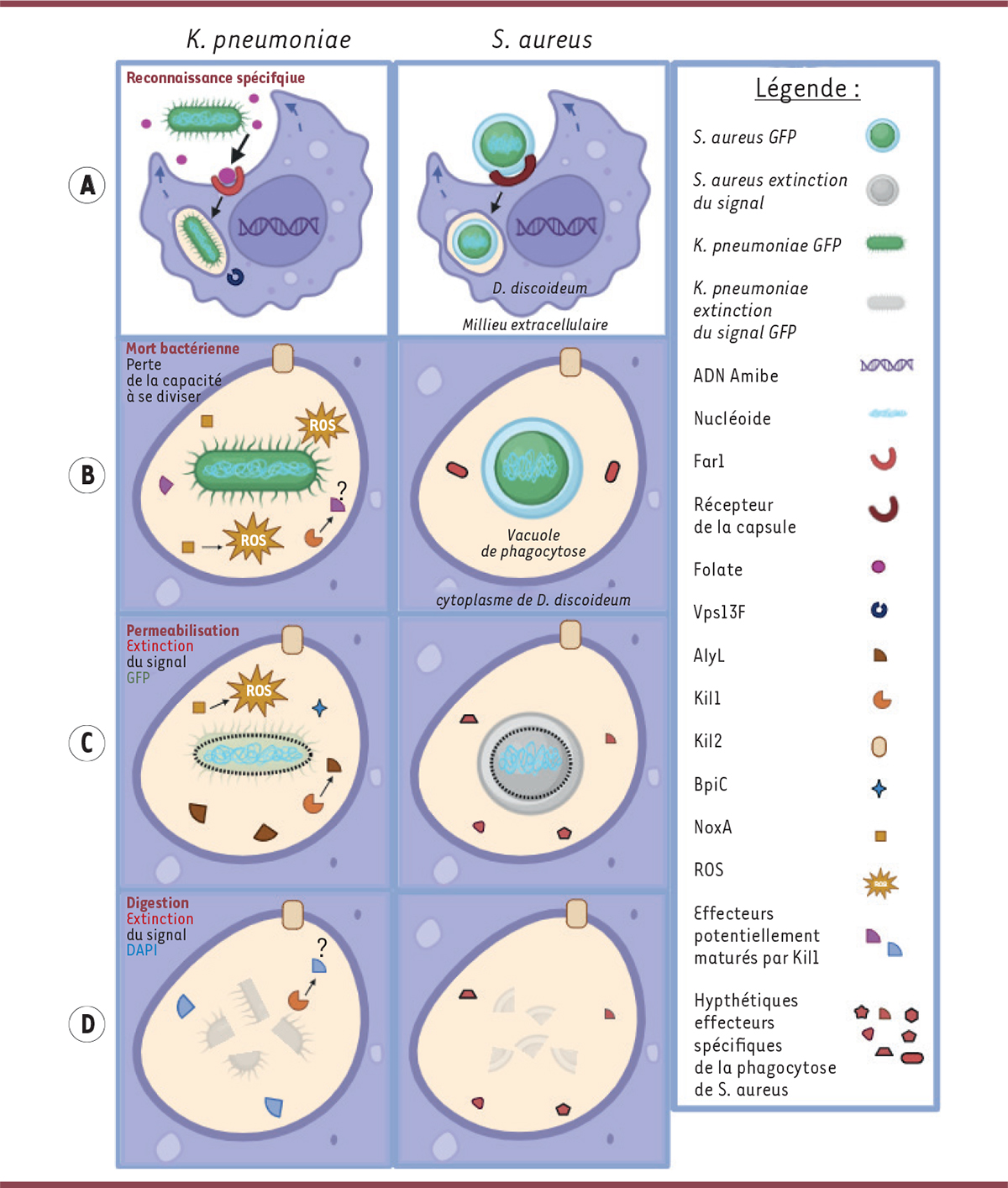
 | Figure 1.
Schéma représentant la réponse spécifique lors des étapes de la phagocytose de deux espèces bactériennes distinctes par
D. discoideum.
(
A
) Reconnaissance spécifique par
D. discoideum
des bactéries
K. pneumoniae
par le folate (détection indirecte) à l’aide du récepteur Far1 et des bactéries
S. aureus
par la capsule (détection directe), puis internalisation de la bactérie au sein d’une vacuole de phagocytose. Une fois la bactérie
K. pneumoniae
internalisée, la protéine Vps13F joue un rôle dans la mise en place des processus phagocytaires menant à sa mort cellulaire. Zoom sur la vacuole de phagocytose : (
B
) Mort bactérienne caractérisée par la perte de la capacité à se diviser lorsque l’amibe est lysée et les bactéries remises en culture. Le processus de mort cellulaire de
K. pneumoniae
implique NoxA, Kil1 et Kil2. Pour S. aureus, parmi ces protéines, seule Kil2 est impliquée. (
C
) Perméabilisation membranaire des bactéries caractérisée par la perte du signal GFP. Chez
K. pneumoniae
, ce processus implique les protéines Kil1, Kil2, NoxA et AlyL. Pour S. aureus, parmi ces protéines, seule Kil2 est impliquée. (
D
) Digestion des composants bactériens caractérisée par la perte du signal DAPI. Chez
K. pneumoniae
, ce processus implique les protéines Kil1et Kil2. Chez
S. aureus
, parmi ces protéines, seule Kil2 est impliqué. (
S. aureus
b, c, d) Des protéines ne participant pas au processus de phagocytose de
K. pneumoniae
, pourraient l’être lors du processus de phagocytose de
S. aureus
par
D. discoideum
.
|
Dans le but d’étudier les mécanismes impliqués dans la phagocytose, des chercheurs ont utilisé un modèle d’étude composé de
D. discoideum
et de la bactérie proie
K. pneumoniae
, l’agent bactérien responsable de la pneumonie. Dans ce modèle,
K. pneumoniae
a été génétiquement modifiée pour exprimer un transgène codant la GFP (
green fluorescent protein
), une protéine fluorescente. L’émission de fluorescence peut être suivie par microscopie, et sa disparition indique la mort de la bactérie phagocytée par
D. discoideum
[
4
]. Parmi les différents mutants de
D. discoideum
obtenus par mutagénèse aléatoire, la souche mutante pour le gène v
ps13F
présentait un ralentissement de croissance. Lors de la prédation de
K. pneumoniae
par cette souche mutante de
D. discoideum
, le nombre de bactéries phagocytées n’était pas affecté, mais le signal GFP était maintenu et la croissance de
D. discoideum
ralentie [
4
]. Ces changements ne semblent donc pas être dus à un défaut d’initiation de la phagocytose, mais plutôt à un défaut de lyse des bactéries internalisées. Par conséquent, la protéine Vps13F ne participe probablement pas aux étapes les plus précoces de la phagocytose, mais intervient dans la reconnaissance spécifique de
K
.
pneumoniae
une fois cette dernière internalisée, initiant des mécanismes phagocytaires menant à la mort bactérienne.
Cette expérience illustre un exemple d’étude à l’origine de l’identification des étapes qui suivent la reconnaissance des bactéries proies par
D. discoideum
. D’autres approches, résumées ci-dessous, ont été développées afin de connaître la cinétique de ces événements.
|
La microscopie en temps réel révèle la dynamique complexe de la phagocytose
Pour déterminer la chronologie des étapes de la phagocytose, les chercheurs ont opté pour un suivi par microscopie en temps réel. Cette méthode permet de suivre l’émission de deux signaux émis par les bactéries au cours de la phagocytose par
D. discoideum
: la GFP produite dans la bactérie proie et le signal émis par le DAPI (4’,6-diamidino2-phenylindole), un marqueur fluorescent de l’ADN utilisé pour marquer le génome bactérien. La perte du signal GFP est donc associée à la perméabilisation des membranes bactériennes, tandis que la perte du signal DAPI indique la digestion bactérienne par l’amibe. Après une période de mise en contact avec l’amibe, les bactéries qui ont été phagocytées sont récoltées à différents temps par lyse de l’amibe. Les chercheurs ont suivi la capacité de division de ces bactéries, la perte de cette capacité étant associée à la mort cellulaire [
3
]. Parmi les bactéries
K. pneumoniae
émettant toujours le signal GFP, 82 % n’étaient déjà plus capables de se diviser et celles n’émettant plus de signal GFP étaient également incapables de division. Ces résultats montrent que la mort cellulaire des bactéries
K. pneumoniae
précède leur perméabilisation membranaire lors de leur phagocytose par
D. discoideum
(
Figure 1b
). De façon intéressante, la disparition du signal GFP précède systématiquement la perte du signal DAPI (
Figures 1c, 1d
). Ce résultat démontre que la perméabilisation de la membrane précède la lyse de la bactérie et la digestion de son contenu cellulaire par l’amibe [
6
].
Une méthodologie similaire a été utilisée pour évaluer la contribution de différentes protéines antibactériennes produites par l’amibe lors de chaque étape de phagocytose. Ces protéines peuvent être regroupées selon leur mode d’action en quatre catégories. La première rassemble des enzymes phagosomales, comme NoxA, responsable de la production de radicaux libres. La seconde catégorie réunit des protéines impliquées dans la modification ionique du phagosome pour favoriser son acidification, telle Kil2, une ATPase impliquée dans le transport des ions magnésium. Une troisième catégorie regroupe des protéines à activité lysosomale, dont AlyL, et le dernier groupe rassemble des protéines et des peptides à l’instar de BpiC, capables de perméabiliser la membrane bactérienne. Toutes ces enzymes sont maturées par des protéines connues sous le nom Golgi sulfotransférase, comme la protéine Kil2 à titre d’exemple.
En comparant la dynamique de disparition des signaux fluorescents bactériens de
K. pneumoniae
(GFP et DAPI) internalisées par la souche parentale de
D. discoideum
ou différents mutants d’inactivation des gènes codant les protéines présentées ci-dessus, il est possible de les associer à des étapes de la phagocytose. De cette manière, il a été mis en évidence que lors de la phagocytose de
K. pneumoniae
, la protéine NoxA intervient à la fois dans l’étape de mort cellulaire et dans de la perméabilisation membranaire de la bactérie (
Figures 1b, 1c
), alors qu’AlyL et BpiC n’interviennent que lors de l’étape de perméabilisation membranaire (
Figure 1c
). Les protéines Kil1 et Kil2 participent à chacune des étapes de la phagocytose, y compris celle de digestion des composants bactériens (
Figure 1
), et apparaissent centrales dans le processus de phagocytose de
K. pneumoniae
par
D. discoideum
[
6
].
|
Dictyostelium discoideum
adapte sa phagocytose à la proie internalisée
La reconnaissance par
D. discoideum
étant spécifique de l’espèce bactérienne rencontrée, il était intéressant d’évaluer si des spécificités existent pour les autres étapes du processus de prédation. Pour répondre à cette question, les chercheurs ont suivi l’impact de différentes mutations de
D. discoideum
sur la phagocytose de différentes espèces bactériennes. Cette approche a permis de démontrer que certaines protéines, telles que Kil1 ou Kil2, sont impliquées dans la phagocytose de plusieurs espèces bactériennes. En effet, l’inactivation des gènes
kil1
ou
kil2
améliorait de manière significative la survie de nombreuses bactéries proies. Si ces deux protéines participent à la phagocytose chez
K. Pneumoniae
, seul Kil2 semble impliquée chez
Staphylococcus aureus
(
Figure 1b, 1d
). À l’inverse, certaines protéines semblent hautement spécifiques et sont essentielles uniquement lors du processus de phagocytose d’une seule espèce bactérienne testée dans cette étude. Par exemple, l’inactivation du gène
alyL
(codant une enzyme lysosomale) n’impacte négativement la phagocytose que de
K. pneumoniae
[7]. Il semblerait donc bien exister une spécificité de réponse de l’amibe face à sa proie grâce à l’implication de plusieurs facteurs agissant lors acteurs de la phagocytose (
Figure 1
).
Par ailleurs, ces résultats sont corroborés par une étude transcriptomique dans laquelle les niveaux d’expression de l’ensemble des gènes de
D. discoideum
ont été comparés selon l’espèce bactérienne phagocytée. Chez
D. discoideum
, 245 gènes avaient un niveau d’expression modulé lors de la phagocytose de
K. pneumoniae
, tandis que, ce sont 787 gènes dont le niveau de transcription variait lors de la phagocytose de
Bacillus subtilis
. La comparaison de ces deux profils transcriptomiques montre que seuls 132 gènes sont communs aux deux conditions [8]. De manière intéressante, ces résultats supportent l’hypothèse d’une modulation de l’expression génique chez
D. discoideum
dépendante de l’espèce bactérienne phagocytée.
|
L’ensemble des expériences décrites mettent en lumière la remarquable capacité de
D. discoideum
à reconnaître sa proie et à moduler de manière spécifique les différentes étapes de sa phagocytose. Bien que certaines protéines apparaissent centrales, telles que Kil2, d’autres, comme AlyL, possèdent à l’inverse une spécificité d’action au regard de l’espèce bactérienne phagocytée. Ainsi,
D. discoideum
représente un modèle particulièrement intéressant pour l’étude de la phagocytose notamment grâce aux similitudes entre les mécanismes phagocytaires partagés par les macrophages et par cette amibe.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article
.
|
|
Entretien avec Otmane Lamrabet
Otmane Lamrabet
est maître-assistant à l’université de Genève (Suisse). Ses activités de recherche, qu’il mène au sein du département de physiologie cellulaire et métabolisme, portent sur l’étude des interactions entre les cellules phagocytaires et les bactéries afin de fournir de nouvelles stratégies pour le traitement des maladies infectieuses et auto-immunes.
Quel est votre parcours académique?
J’ai effectué le Master Microbiologie Biologie végétale et Biotechnologies à l’université d’Aix-Marseille. Par la suite, je me suis dirigé vers une thèse à la faculté de Médecine de Marseille où je me suis intéressé aux interactions hôte/pathogène. Durant ma thèse, nous utilisions l’amibe pour étudier la tuberculose en la modifiant génétiquement pour atténuer sa pathogénicité. J’ai ensuite effectué un post doctorat de trois ans à Grenoble où j’ai travaillé sur la plus longue lignée évolutive d’
Escherichia coli
. En 2016, j’ai rejoint l’université de Genève pour un second post doctorat où je suis revenu à la thématique des interactions hôte/pathogène en étudiant cette foisciles mécanismes de phagocytose chez l’amibe. J’occupe un poste de maître-assistant depuis 3 ans.
Pourriez-vous nous expliquer la genèse de ce projet?
Avant d’intégrer l’équipe, les recherches sur l’amibe étaient assez éparses. En 2016, le laboratoire étudiait surtout
K. pneumoniae
et après mon arrivée, nous avons essayé d’ouvrir la thématique à d’autres bactéries pour étudier plus en profondeur les mécanismes de phagocytose. Aujourd’hui, nous travaillons avec cinq bactéries et nous envisageons d’ajouter des bactéries pathogènes modèles au sein de notre répertoire.
Dans le processus que vous étudiez, la reconnaissance est une étape cruciale, quel est le degré de sa spécificité?
La reconnaissance est un très bon sujet de recherche. Nous ne savons pas vraiment si l’amibe est capable de reconnaître différentiellement une
Klebsiella
d’un
Bacillus
par exemple. Nous savons simplement qu’il y a beaucoup de protéines impliquées. Je pense que si l’on met une
Dictyostellium
en présence d’une bactérie pathogène et d’une autre qui ne l’est pas, l’amibe va préférentiellement détecter les lipopolysaccharides présents dans la capsule de la bactérie non pathogène plutôt que la membrane d’une bactérie pathogène, car elle porte différents marqueurs que l’amibe est moins capable d’identifier. Cependant, il a été proposé que le processus de mort cellulaire est totalement différent d’une bactérie à l’autre.
Estce que l’amibe est capable de tuer des bactéries autrement que par phagocytose?
Oui, c’est possible. Dans le cas des
Pseudomonas
, l’amibe est capable de tuer la bactérie depuis l’extérieur. Lorsque nous suivons les bactéries par microscopie à temps réel, l’amibe s’approche des
Pseudomonas,
en digère quelquesunes et s’éloigne. De façon intrigante, les bactéries restantes meurent sans avoir subi de phagocytose.
L’utilisation de D. discoideum permetelle de s’affranchir de l’utilisation du modèle animal?
C’est le but. On utilise l’amibe et particulièrement
D. discoideum
, car c’est un modèle assez simple. Elles sont très faciles à cultiver, à manipuler et on peut aisément les modifier génétiquement. De plus, cet organisme suscite moins de préoccupations éthiques. Les mécanismes de phagocytose de l’amibe se rapprochent énormément de ceux employés par les macrophages humains. Il existe aussi une grande similarité entre les protéines des deux espèces.
Cependant, les amibes ne reproduisent pas de manière réaliste les interactions entre les pathogènes et les cellules humaines. Par exemple, pour l’étude de certains pathogènes spécifiques aux cellules humaines telles que le virus du sida ou le parasite
Plasmodium spp
, l’amibe n’est pas un modèle approprié.
|
|
1.
Raper
KB
.
Dictyostelium Minutum, a Second New Species of Slime Mold from Decaying Forest Leaves.
.
Mycologia
.
1941;
;
33
:
:633.
–
49
.
2.
Gordon
S.
Phagocytosis: An Immunobiologic Process.
.
Immunity
.
2016;
;
44
:
:463.
–
75
.
3.
Gordon
S.
The macrophage: past, present and future.
.
Eur J Immunol
.
2007;
;
37
:
:S9.
–
17
.
4.
Crespo-Yanez
X
,
Oddy
J
,
Lamrabet
O
,
et al.
Sequential action of antibacterial effectors in Dictyostelium discoideum phagosomes.
.
Mol Microbiol
.
2023;
;
119
:
:74.
–
85
.
5.
Jauslin
T
,
Lamrabet
O
, Crespo-
Yañez
X
,
et al.
How Phagocytic Cells Kill Different Bacteria: a Quantitative Analysis Using Dictyostelium discoideum.
.
mBio
.
2021;
;
12
:
:e03169.
–
20
.
6.
Lamrabet
O
,
Melotti
A
,
Burdet
F
,
et al.
Transcriptional Responses of Dictyostelium discoideum Exposed to Different Classes of Bacteria.
.
Front Microbiol
.
2020;
;
11
:
:410.
.
|