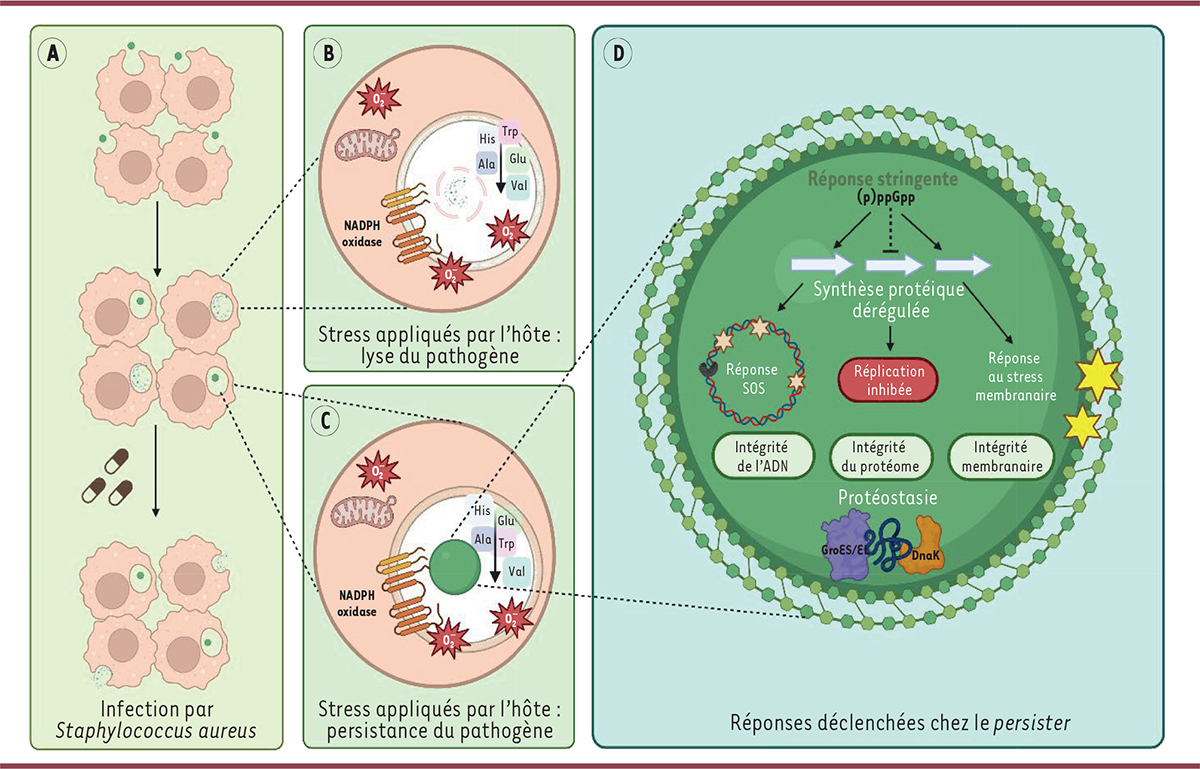
|
Entretien avec Sophie Helaine
Sophie Helaine est professeure associée de microbiologie au sein de l’université de Harvard à Boston (USA). Après l’obtention d’un doctorat de microbiologie médicale à l’université René Descartes de Paris, elle s’est consacrée à l’étude de la formation des
persisters
chez
Salmonella
. Elle a progressivement constitué sa propre équipe de recherche, d’abord au sein de l’Imperial College de Londres, puis à l’université de Harvard où elle occupe son poste actuel.
Qu’estce qui vous a conduit à étudier les persisters?
Lors de mon post-doctorat à l’Imperial College de Londres, j’ai étudié l’interaction de
Salmonella
en tant que pathogène intracellulaire avec la cellule hôte. Je me destinais initialement à étudier le système de sécrétion de type 3 et comment ses effecteurs interfèrent avec les voies de signalisation de l’hôte. Pour suivre plus facilement la division des bactéries au sein des macrophages, j’ai construit un rapporteur fluorescent. J’ai alors observé que de nombreuses bactéries ne se divisaient pas et c’est ce qui m’a conduit à explorer ce phénomène. Par la suite, nous avons découvert qu’il s’agissait de
persisters
.
Les méthodes employées pour étudier les persisters sont de plus en plus sophistiquées. Sontelles transposables en santé humaine?
Oui, je pense qu’on peut utiliser des techniques vraiment élaborées sur des échantillons cliniques. Ce n’est évidemment pas le cas des rapporteurs fluorescents puisqu’on ne contrôle pas ce qui infecte les patients. En revanche, c’est possible pour des techniques transcriptomiques comme du RNA-seq ou en faisant du FISH dans les échantillons cliniques. Par exemple, les outils qu’on utilise pour étudier les
persisters
peuvent nous amener à trouver des biomarqueurs qui pourraient ensuite être recherchés dans les échantillons de patients. Donc, ce n’est qu’une partie de ces outils qui peut être transposée aux échantillons cliniques mais en tous cas, toutes les découvertes sont transposables en santé humaine.
Certaines études montrent que la formation de persisters est corrélée avec une exposition aux antibiotiques. Selon vous, estce réellement une cause ou bien un crible permettant de les discriminer?
Je pense que c’est les deux. Il y a certainement des antibiotiques qui n’induisent pas l’état de persistance mais permettent de le révéler. Les bactéries qui ne sont pas des
persisters
vont mourir et celles qui survivront à ces antibiotiques peuvent être des
persisters
. Par contre, certains antibiotiques, notamment les fluoroquinolones qui induisent des dommages à l’ADN, peuvent probablement être à la fois des révélateurs et des inducteurs contribuant à ce phénomène en ajoutant du stress supplémentaire pour les bactéries. Cependant, il n’y a pas besoin d’antibiotiques pour que les
persisters
soient formés pendant l’infection, le stress induit par ces conditions est suffisant.
Suite aux avancées récentes, quels sont les principaux questionnements en suspens dans ce domaine?
Certes, nous avons compris que les stress sont générateurs de
persisters
et que les voies de réponse aux stress sont importantes, mais il nous manque encore de nombreux relais. Il manque des déterminants moléculaires pour leur formation, leur survie ou la sortie de la persistance. Selon moi, il faut également approfondir les études sur les mécanismes moléculaires qui expliquent comment on passe de la persistance à la résistance. Par exemple, je ne pense pas qu’empêcher la formation de
persisters
soit vraiment thérapeutiquement réaliste puisque lors d’infections, les
persisters
sont formés très rapidement. Par contre, si on comprend comment les
persisters
deviennent ensuite résistants, on peut potentiellement intervenir thérapeutiquement.
Quelles techniques, encore non appliquées pour étudier ce phénomène, pourraient apporter des réponses complémentaires ou de nouvelles perspectives?
De nombreux groupes ont proposé par exemple de faire du single-cell RNA-Seq, ce qui est déjà mis en place pour l’étude de cellules eucaryotes. En revanche, au niveau bactérien, cette approche est plus difficile techniquement de par la faible quantité de matériel biologique disponible pour obtenir des lectures précises. Actuellement, ces techniques sont encore limitées pour la quantité d’ARN messager que l’on peut détecter au niveau de la bactérie et donc pour apporter des résultats concluants. L’autre piste à développer - et que nous sommes encore incapables de mettre en œuvre - concerne la protéomique sur une sous-population bactérienne, puisqu’il faut des quantités de matériel biologique encore plus importantes que pour la transcriptomique. Enfin, le développement de techniques hybrides entre la microscopie et la spectrométrie de masse permettrait de quantifier ce que les bactéries produisent, et pas uniquement ce qu’elles expriment, tout en analysant leur comportement. Cela permettrait donc de comparer les
persisters
avec les non-
persisters
.
Quelle est la place du hasard dans la carrière d’un chercheur et dans ses recherches?
Selon moi, il y a beaucoup de décisions, de rencontres ou d’observations qui sont dues à la sérendipité. En fait, je pense que le talent des gens, c’est peutêtre de forcer la chance et de reconnaître ce qui « sent bon ». Comme un chercheur d’or, dans un laboratoire, plus vous cherchez, plus vous avez de chances de trouver, mais il faut aussi être capable de reconnaître la pépite quand elle scintille en face de vous. Donc je dirais que la chance est un facteur important, mais il faut aussi savoir la provoquer et la reconnaître quand elle se présente.
Au cours de votre carrière, avezvous écarté avec regrets certaines thématiques que vous auriez aimé approfondir?
Oui. Pendant mon post-doc, j’étudiais initialement les effecteurs du système de sécrétion de type 3 et finalement, je ne l’ai jamais vraiment fait ! Comme mon travail porte toujours sur
Salmonella
, on retombe parfois sur ces effecteurs, mais je ne les étudie jamais véritablement et d’autres équipes le font très bien ! C’est quelque chose qui revient régulièrement et je ne sais pas si je vais un jour finir par le faire ou pas. En revanche, je n’éprouve pas de regrets. Certes, je les ai mis de côté mais au profit d’autres thématiques telles que les
persisters
que je trouvais plus excitantes.
Durant votre parcours, quelles sont les principales découvertes ou avancées dont vous êtes particulièrement fière?
Je pense que ce que nous avons montré sur la formation de
persisters
pendant l’infection causée par le stress de la cellule hôte est important parce que cela a permis de faire avancer ce champ de recherche et j’en suis fière. En tous cas, je suis contente de voir que ça a été montré par d’autres groupes et chez d’autres pathogènes parce que cela augmente son importance. Les découvertes qui me satisfont le plus, c’est lorsque nous arrivons à élucider un mécanisme moléculaire comme par exemple, la fonction enzymatique d’une toxine, autrement dit ce qu’elle fait et comment elle le fait, puisque cela représente pour moi un côté absolu. Comme l’a dit George Box « Tous les modèles sont faux, mais certains sont utiles. » À chaque moment, nous proposons des modèles dont nous savons qu’ils sont imparfaits mais c’est simplement le meilleur modèle que nous pouvons proposer avec les résultats que nous avons. Par contre, c’est vrai qu’en trouvant une modification enzymatique ou un mécanisme moléculaire, c’est assez difficile de s’imaginer que ce n’est pas vrai. Cela se rapproche un peu plus d’un modèle plus fin et je trouve cela assez satisfaisant.
|