| |
| Med Sci (Paris). 40(8-9): 620–622. doi: 10.1051/medsci/2024102.La méthylation de l’ARN au cœur de la dormance embryonnaire Évelyne Collignon1* and Giacomo Furlan2 1
Faculté de médecine,
ULB-Cancer research centre
et Institut Jules Bordet, Université libre de Bruxelles
,
Bruxelles
,
Belgique 2Lunenfeld–Tanenbaum research institute and department of molecular genetics, Université de Toronto
,
Toronto
,
Canada MeSH keywords: Animaux, Méthylation, Humains, ARN, génétique, Souris, Régulation de l'expression des gènes au cours du développement, Développement embryonnaire, génétique |
Mécanismes de la dormance embryonnaire
La diapause est un phénomène embryologique fascinant observé chez de nombreux animaux. Lorsque les conditions environnementales sont défavorables pour une grossesse, par exemple pendant les mois d’hiver, certains mammifères peuvent temporairement bloquer le développement de leurs embryons au stade précoce du blastocyste, juste avant l’implantation dans l’utérus [
1
]. Cette pause, d’une durée allant de quelques jours à quelques mois, permet aux embryons de survivre sous une forme « dormante » et peu énergivore pour la mère. Lorsque les conditions s’améliorent, le blastocyste s’implante alors dans l’utérus, et la grossesse peut reprendre son cours. Cette adaptation évolutive améliore la gestion des ressources disponibles et favorise la survie de la progéniture par un contrôle du calendrier des grossesses et des naissances.
Ce programme de dormance embryonnaire met en jeu de nombreux mécanismes cellulaires, notamment la réduction de la transcription des ARN dans les cellules de l’embryon (hypotranscription). La diapause nécessite également une suspension temporaire des divisions cellulaires et un ralentissement du métabolisme énergétique. Ces changements sont en grande partie dus à l’inhibition de l’activité des voies de signalisation cellulaire impliquant mTOR (
mammalian target of rapamycin
) et Myc. Cependant, les mécanismes moléculaires sont encore mal compris.
Dans ce contexte, notre équipe de recherche s’est intéressée à un domaine émergent du contrôle de l’expression des gènes : les modifications post-transcriptionnelles de l’ARN [
2
]. Ces modifications consistent en l’addition de petits groupes chimiques, telle que la méthylation ou l’acétylation, sur les molécules d’ARN. Elles jouent un rôle crucial dans l’expression génique en influant sur les propriétés des ARN, par exemple sur leur stabilité ou sur l’efficacité de leur traduction en protéine.
|
Méthylation de l’ARN et régulation transcriptionnelle
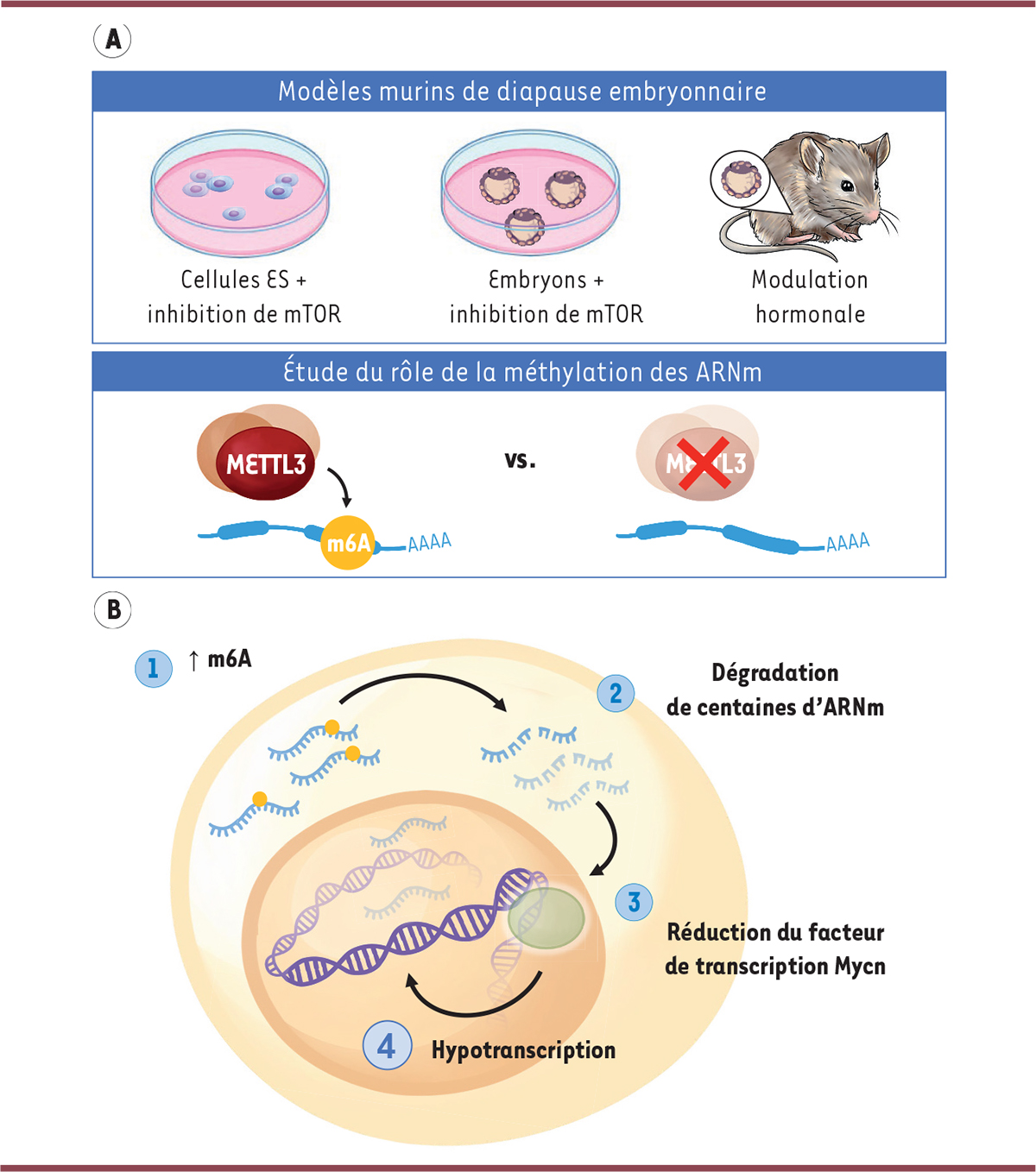
Pour étudier la diapause embryonnaire, nous avons utilisé des cellules souches embryonnaires (ES) de souris, un modèle bien établi pour simuler ce processus
in vitro
[
3
]. Les cellules ES peuvent en effet être « mises en pause » en inhibant la voie de signalisation impliquant mTOR, mimant ainsi les conditions observées pendant la diapause embryonnaire (
Figure 1A
). Nous avons quantifié les modifications de l’ARN dans les cellules ES en pause, et nous avons constaté l’augmentation d’une forme spécifique de méthylation de l’ARN : la N6-méthyladénosine (m6A). Or, cette modification post-transcriptionnelle de l’ARN, la plus abondante concernant les ARN messagers (ARNm), joue un rôle important pour le contrôle de l’expression génique dans les cellules embryonnaires. La méthylation de l’ARN est orchestrée par un complexe protéique, dont la sous-unité méthyltransférase METTL3 est l’enzyme active. Nous avons donc exploré le rôle de m6A et de METTL3 dans la diapause embryonnaire. Pour ce faire, outre les cellules ES en pause, nous avons exploité deux modèles murins de diapause : des blastocystes de souris cultivés
ex vivo
en conditions de pause (c’est-à-dire dans un incubateur et en inhibant la voie de signalisation mTOR), et des souris chez lesquelles la diapause est induite par manipulation hormonale de la mère (injection de tamoxifène et d’un dérivé de progestérone pour empêcher l’implantation de l’embryon dans l’utérus). Chaque modèle comportait une forme dépourvue de METTL3 par mutation du gène
Mettl3
, permettant l’étude de l’impact de la déplétion de m6A (
Figure 1A
). Nous avons constaté que l’absence de METTL3 réduisait la survie des embryons en pause, ce qui témoigne de l’importance cruciale de m6A dans ce processus.
 | Figure 1.
Étude du rôle de la N6-méthyladénosine (m6A) dans la diapause embryonnaire. A.
Les trois modèles murins de la diapause embryonnaire : cellules souches embryonnaires (ES) ou blastocystes mis en pause par inhibition de la voie mTOR, et manipulation hormonale de souris enceintes. L’invalidation du gène
Mettl3
permet d’étudier l’effet de la suppression de la méthylation des ARNm (m6A).
B
.
Modèle du rôle de m6A pendant la diapause. La méthylation des ARNm augmente pendant la dormance embryonnaire, ce qui favorise leur déstabilisation et affecte donc la traduction de ces ARNm en protéines. De plus, la méthylation de l’ARNm codant le facteur de transcription Mycn a pour effet de réprimer la transcription des gènes. Figure adaptée de [
2
].
|
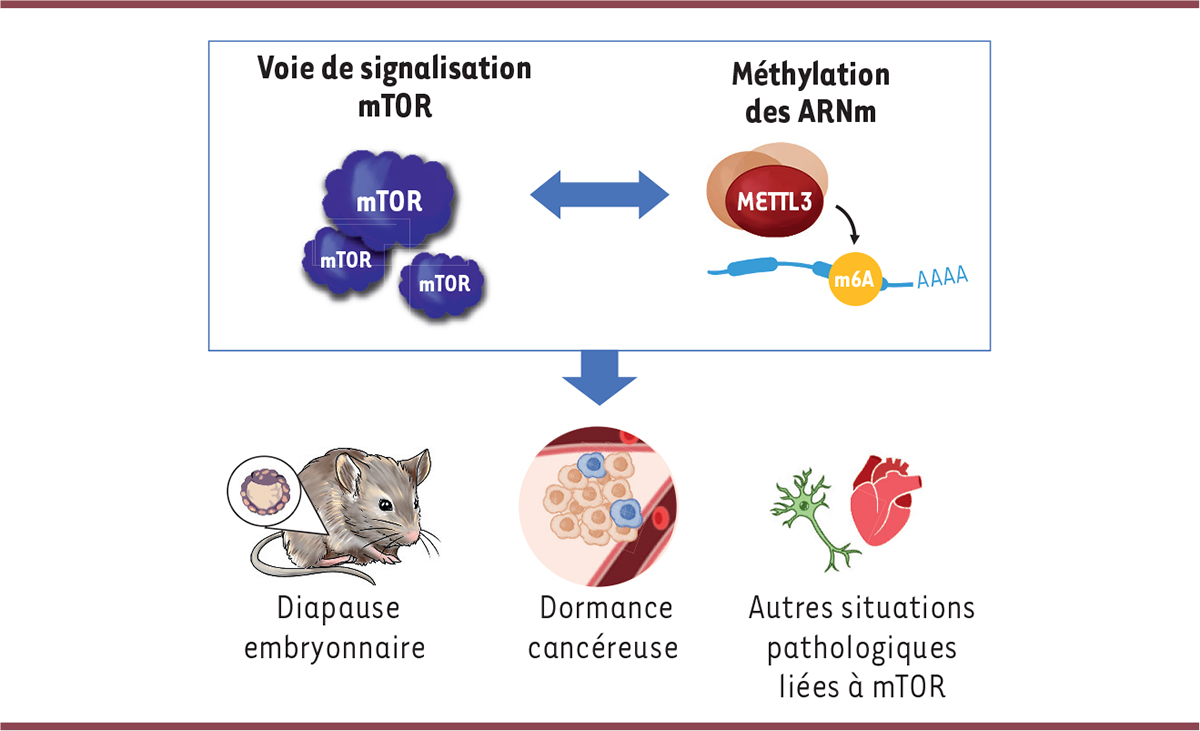
En disséquant les mécanismes moléculaires, nous avons observé que les cellules ES et les blastocystes en pause présentent des niveaux d’ARN anormalement élevés en l’absence de METTL3. Ce changement était particulièrement marqué pour les voies de signalisation dont la suppression est requise pour la pause développementale, telles que la signalisation mTOR, Myc et le métabolisme énergétique. Ainsi, nous en avons déduit que METTL3 est indispensable pour l’instauration de l’hypotranscription, processus clé de la diapause. Mais quel est le rôle exact de m6A dans ce phénotype ? Cette méthylation est une modification bien connue pour favoriser la dégradation des ARNm. Nous avons donc exploré son rôle potentiel dans l’hypotranscription observée lors de la diapause. Le profilage de m6A dans les cellules ES a révélé une augmentation de la méthylation sur des centaines d’ARNm pendant la diapause embryonnaire. De plus, en absence de METTL3, de nombreux ARNm ont montré une stabilité accrue. Ces résultats indiquent que l’augmentation de m6A dans la diapause contribue à la déstabilisation de nombreux ARNm, contribuant ainsi à l’hypotranscription.
Parmi les cibles réprimées par m6A, nous avons identifié Mycn, un facteur de transcription de la famille Myc. La voie de signalisation Myc agit généralement comme un activateur de la transcription, et sa répression est donc indispensable à la diapause embryonnaire. En conclusion, m6A remplit une double fonction dans le maintien de l’hypotranscription durant la dormance embryonnaire. D’une part, elle induit la déstabilisation globale de nombreux ARNm, et d’autre part, elle réprime la transcription en ciblant l’ARNm du facteur de transcription Mycn (
Figure 1B
).
|
La méthylation de l’ARN dans la dormance cellulaire
Nous avons donc identifié METTL3 comme un acteur essentiel dans la diapause des embryons, et mis en évidence l’existence d’un dialogue entre les mécanismes transcriptionnels et post-transcriptionnels impliqués. La relation entre la méthylation de l’ARN (m6A) et la dormance cellulaire pourrait avoir des implications bien au-delà de la diapause embryonnaire. La voie de signalisation mTOR, au cœur de l’instauration de la diapause embryonnaire, joue un rôle crucial dans la croissance et la prolifération des cellules, et son dysfonctionnement est impliqué dans diverses situations pathologiques : maladies cardiovasculaires telles que l’infarctus du my ocarde et l’athérosclérose, ou encore maladies neurologiques telles que l’épilepsie [
4
,
5
].
Une diminution de l’activité de signalisation impliquant mTOR est aussi associée au contrôle de la dormance des cellules souches dans différents tissus matures. Par ailleurs, les cellules cancéreuses peuvent adopter un état dormant similaire à la diapause embryonnaire, caractérisé par un ralentissement de leur métabolisme et une diminution de leur activité mitotique [
6
]. Dans une tumeur primaire, seule une petite fraction des cellules (moins de 5 %) est dans cet état dormant, qui est associé à une forte diminution de l’activité de la voie mTOR. Cependant, divers traitements anticancéreux peuvent induire les cellules tumorales à entrer dans l’état de dormance, ce qui permet à ces cellules de survivre à la chimiothérapie, et peut être à l’origine d’une rechute de la maladie [
7
].
En considérant la relation entre la méthylation de l’ARN (m6A) et la dormance cellulaire que nous avons découverte, il serait intéressant de rechercher le rôle de m6A dans des situations pathologiques où la voie mTOR est dérégulée (
Figure 2
). En effet, le développement récent d’inhibiteurs ciblant la machinerie m6A pourrait offrir de nouvelles opportunités thérapeutiques dans des domaines aussi divers que la santé reproductive, la médecine régénérative, ou le cancer.
 | Figure 2.
La connexion entre la voie de signalisation mTOR et la méthylation de l’ARN (m6A) ne se limite pas à la diapause embryonnaire.
La mise en évidence de son implication dans les cancers, où la régulation de mTOR est associée à une forme de dormance, ainsi que dans diverses situations pathologiques liées à mTOR, ouvre de nouvelles perspectives thérapeutiques.
|
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article
.
|
1.
Garcia-Ojalvo
J
,
Bulut-Karslioglu
A
.
On time: developmental timing within and across species.
.
Development
.
2023;
;
150
:
:dev201045.
.
2.
Collignon
E
,
Cho
B
,
Furlan
G
,
et al.
m6A RNA methylation orchestrates transcriptional dormancy during paused pluripotency.
.
Nat Cell Biol
.
2023;
;
25
:
:1279.
–
89
.
3.
Bulut-Karslioglu
A
,
Biechele
S
,
Jin
H
,
et al.
Inhibition of mTOR induces a paused pluripotent state.
.
Nature
.
2016;
;
540
:
:119.
–
23
.
4.
Kaldirim
M
,
Lang
A
,
Pfeiler
S
,
et al.
Modulation of mTOR signaling in cardiovascular disease to target acute and chronic inflammation.
.
Front Cardiovasc Med
.
2022;
;
9
:
:907348.
.
5.
Ravizza
T
,
Scheper
M
,
Sapia
R Di
,
et al.
mTOR and neuroinflammation in epilepsy: implications for disease progression and treatment.
.
Nat Rev Neurosci
.
2024;
;
25
:
:334.
–
50
.
6.
Collignon
E.
Unveiling the role of cellular dormancy in cancer progression and recurrence.
.
Curr Opin Oncol
.
2024;
;
36
:
:74.
–
81
.
7.
Rehman
SK
,
Haynes
J
,
Collignon
E
,
et al.
Colorectal cancer cells enter a diapause-like DTP state to survive chemotherapy.
.
Cell
.
2021;
;
184
:
:226.
–
42.e21
.
|