| |
| Med Sci (Paris). 40(8-9): 613–615. doi: 10.1051/medsci/2024088.Immunothérapie des cancers par anticorps anti-PD-1 Le rôle inattendu de l’interleukine 4 dans le ganglion lymphatique drainant la tumeur Marion V. Guérin,1* Mathilde Ruggiu,1 and Philippe Bousso1 1Institut Pasteur, Université Paris Cité, Inserm U1223
,
Paris
,
France MeSH keywords: Humains, Récepteur-1 de mort cellulaire programmée, antagonistes et inhibiteurs, Noeuds lymphatiques, immunologie, Interleukine-4, Animaux, Inhibiteurs de points de contrôle immunitaires, usage thérapeutique, Souris |
Les immunothérapies ciblant l’axe PD-1/PD-L1 (
programmed cell death protein 1 / programmed death-ligand 1
) ont montré une bonne efficacité dans le traitement de multiples maladies cancéreuses, notamment le mélanome, le cancer du poumon non à petites cellules, ou certaines hémopathies malignes comme le lymphome de Hodgkin [
1
–
3
]. Cependant, certains patients n’y répondent pas favorablement, ou rechutent après un traitement par anticorps monoclonal (Acm, ou mAb en anglais) anti-PD-1 (anti-PD-1 mAb) [
4
], d’où l’importance de comprendre les modes d’action de ces immunothérapies
in vivo
.
Il est généralement admis que l’anti-PD-1 mAb a une action ciblée et restreinte au micro-environnement tumoral [
4
], où il se lie aux lymphocytes T CD8
+
infiltrant la tumeur [
5
], perturbe l’interaction entre PD-1 et ses ligands [
6
], et induit l’activation et la prolifération de lymphocytes T CD8
+
ayant des propriétés de cellules souches [
7
,
8
]. Néanmoins, des résultats récents indiquent qu’il pourrait également agir plus à distance de la tumeur [
9
,
10
]. Nous avons donc cherché à comprendre l’implication des ganglions lymphatiques drainant la tumeur dans l’activité antitumorale de l’anti-PD-1 mAb.
|
L’anti-PD-1 mAb favorise l’expansion et l’activation des lymphocytes T CD8
+
spécifiques des tumeurs au sein des ganglions drainants
Afin d’évaluer l’impact de l’action périphérique de l’anti-PD-1 mAb sur la réponse tumorale dans ce modèle, nous avons utilisé le fingolimod, un modulateur du récepteur de la sphingosine-1-phosphate, qui bloque la sortie des lymphocytes T des organes lymphoïdes secondaires
1,
. Dans un modèle de souris porteuses d’un adénocarcinome du côlon (MC38-OVA), nous avons constaté que l’ajout de fingolimod diminue l’activité thérapeutique de l’anti-PD-1 mAb, en réduisant à la fois le contrôle de la tumeur et en diminuant la survie des souris. Par ailleurs, l’injection de l’anti-PD-1 mAb entraîne une augmentation significative de la prolifération des lymphocytes T CD8
+
spécifiques des tumeurs
2
dans les ganglions drainants [
11
].
Nous avons ensuite cherché à visualiser les effets précoces du traitement sur les interactions entre les lymphocytes T CD8
+
spécifiques de la tumeur et les cellules dendritiques dans les ganglions drainants par imagerie biphotonique. De nombreux contacts entre ces deux types de cellules ont été observés, ce qui suggère l’existence d’une présentation efficace de l’antigène par les cellules dendritiques. Bien que la fréquence de contact ne semble pas modifiée par le blocage de PD-1, la qualité de l’activation des lymphocytes T CD8
+
semble, quant à elle, améliorée, puisque ces lymphocytes présentent un phénotype blastique et expriment davantage de marqueurs d’activation dans les premières 48 heures après l’administration de l’anti-PD-1 mAb
3
.
Enfin, l’évaluation de la production d’interféron-J et du facteur de nécrose tumorale TNF-α par les lymphocytes T CD8
+
spécifiques de la tumeur dans les ganglions drainants a révélé une augmentation de la fraction de lymphocytes T qui produisent à la fois ces deux cytokines après traitement par anti-PD-1 mAb.
Ainsi, ces résultats indiquent que l’anti-PD-1 mAb augmente la prolifération et la qualité de l’activation des lymphocytes T CD8
+
spécifiques de la tumeur dans le ganglion drainant. Par ailleurs, cette action locale de l’anti-PD-1 mAb semble contribuer au bénéfice thérapeutique de cette immunothérapie.
|
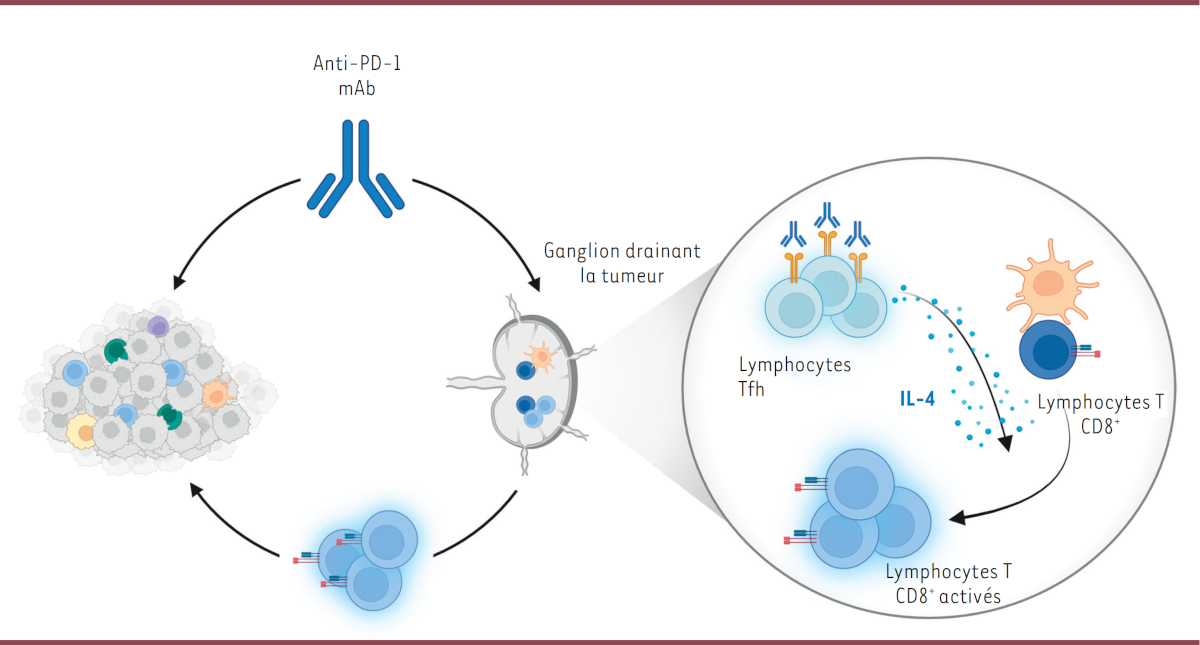
L’anti-PD-1 mAb se lie rapidement aux lymphocytes T folliculaires auxiliaires dans le ganglion drainant la tumeur
Afin de déterminer si l’anti-PD-1 mAb agit directement sur les lymphocytes T CD8
+
spécifiques de la tumeur dans le ganglion drainant, nous l’avons couplé à un fluorophore avant de l’injecter par voie intraveineuse
4,
. Alors que l’anti-PD1 mAb se fixe à une grande fraction des lymphocytes T CD8
+
et CD4
+
dans le microenvironnement tumoral, il n’est capté que par une faible fraction de cellules dans le ganglion drainant. Étonnamment, ces cellules sont presque exclusivement des lymphocytes T CD4
+
, que nous avons identifiés comme étant des lymphocytes T folliculaires auxiliaires (Tfh)
5,
, des cellules impliquées dans l‘induction d’une réponse immunitaire humorale [
11
]. Bien que nos résultats n’excluent pas que l’anti-PD-1 mAb puisse agir secondairement sur les lymphocytes T CD8
+
spécifiques de la tumeur dans le ganglion lymphatique, ils suggèrent que d’autres cellules pourraient être les premières cibles de cette immunothérapie.
|
L’anti-PD-1 mAb agit sur les lymphocytes Tfh murins et humains
in vivo
Nous avons ensuite cherché à évaluer les conséquences de la fixation de l’anti-PD-1 mAb sur les lymphocytes Tfh. Nous avons constaté que le traitement par anti-PD-1 mAb induit une augmentation du nombre de ces lymphocytes et de leur capacité de prolifération en réponse à l’anti-PD-1 mAb. Nous avons également constaté que les réponses des lymphocytes B des centres germinatifs du ganglion drainant la tumeur étaient amplifiées en présence d’anti-PD-1 mAb, ce qui suggère que ce traitement augmente l’activité des lymphocytes Tfh.
Afin de transposer nos résultats dans un modèle humanisé, nous avons utilisé des souris initialement déficientes en lymphocytes T, B et NK (
natural killer
), et dont le contenu en lymphocytes a été reconstitué avec des cellules progénitrices CD34
+
humaines. Ces souris ont des ganglions lymphatiques contenant des lymphocytes B et T humains fonctionnels, y compris des lymphocytes Tfh, ce qui offre la possibilité d’évaluer
in vivo
l’effet d’un anti-PD-1 mAb utilisé en médecine, le nivolumab, sur les lymphocytes T humains dans un ganglion lymphatique murin. L’augmentation substantielle de la proportion des lymphocytes Tfh humains et de leur prolifération dans les ganglions de ces souris après l’injection de nivolumab suggère l’existence d’un mécanisme d’action similaire chez l’homme.
|
Les lymphocytes Tfh jouent un rôle clé dans la réponse au traitement par anti-PD-1 mAb grâce à leur sécrétion d’interleukine 4
Pour évaluer le rôle fonctionnel des lymphocytes Tfh dans la réponse au traitement par anti-PD-1 mAb, nous avons utilisé un inhibiteur du facteur de transcription BCL6 essentiel pour le fonctionnement de ces cellules. Lorsque les souris sont traitées avec cet inhibiteur, le traitement par anti-PD-1 mAb ne permet plus d’augmenter l’activation et la prolifération des lymphocytes T CD8
+
spécifiques de l’antigène, ce qui, en outre, est associé à une diminution du contrôle tumoral et de la survie des souris [
11
].
Pour tenter de clarifier les mécanismes d’interaction entre les lymphocytes Tfh et les lymphocytes T CD8
+
, nous avons ensuite analysé le « paysage cytokinique » dans le ganglion drainant la tumeur. Parmi les douze cytokines testées, seule l’IL (interleukine)-4 est fortement augmentée chez les animaux traités par anti-PD-1 mAb. Grâce à différentes expériences, comme la déplétion des lymphocytes T CD4
+
, l’utilisation de l’inhibiteur de BCL6, le marquage intracellulaire de l’IL-4 et notamment le tri des lymphocytes Tfh, nous avons pu mettre en évidence la contribution majeure de ces lymphocytes dans la production de cette cytokine induite par le traitement avec l’anti-PD-1 mAb.
Enfin, nous avons utilisé un anticorps bloquant l’IL-4 pour tester l’importance de cette cytokine dans la réponse au traitement par anti-PD-1 mAb dans le ganglion drainant la tumeur. Le blocage de l’IL-4 entrave fortement la capacité de l’anti-PD-1 mAb à augmenter la prolifération des lymphocytes T CD8
+
spécifiques de la tumeur [
11
].
A contrario
, le traitement des souris porteuses de tumeurs avec de l’IL-4, complexée à un anticorps spécifique afin d’améliorer sa demi-vie
in vivo
, reproduit l’effet de l’anti-PD-1 mAb sur la prolifération et l’activation des lymphocytes T CD8
+
spécifiques de la tumeur dans le ganglion drainant. De plus, des marquages de la phosphorylation de la protéine STAT6 (
signal transducer and activator of transcription 6
) et des expériences de prolifération de lymphocytes
in vitro
en présence d’IL-4 ont permis de montrer que cette cytokine agit, au moins partiellement, directement sur les lymphocytes T CD8
+
lors du traitement par l’anti-PD-1 mAb.
Les résultats de nos travaux ont donc mis en évidence un nouveau mécanisme par lequel l’anti-PD-1 mAb stimule la réponse immunitaire antitumorale dans les ganglions drainant la tumeur, en ciblant les lymphocytes Tfh et en induisant la production d’IL-4 par ces lymphocytes (
Figure 1
). Ces découvertes pourraient ouvrir de nouvelles perspectives pour améliorer l’efficacité des traitements par anti-PD-1 mAb dans de multiples maladies, notamment cancéreuses.
 | Figure 1.
Mécanisme d’action de l’anticorps monoclonal anti-PD-1 dans le ganglion lymphatique drainant la tumeur.
L’anticorps monoclonal anti-PD-1 (anti-PD-1 mAb), en se fixant sur les lymphocytes T folliculaires auxiliaires (Tfh), entraîne la production d’interleukine 4 (IL-4) par ces lymphocytes, ce qui stimule la réponse antitumorale des lymphocytes T CD8
+
dans le ganglion drainant la tumeur.
|
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article
.
|
Footnotes |
1.
Robert
C
,
Long
GV
,
Brady
B
,
et al.
Nivolumab in previously untreated melanoma without BRAF mutation.
.
N Engl J Med
.
2015;
;
372
:
:320.
–
30
.
2.
Herbst
RS
,
Baas
P
,
Kim
D-W
,
et al.
Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): A randomised controlled trial.
.
Lancet Lond Engl
.
2016;
;
387
:
:1540.
–
50
.
3.
Armand
P
,
Shipp
MA
,
Ribrag
V
,
et al.
Programmed death-1 blockade with Pembrolizumab in patients with classical Hodgkin lymphoma after Brentuximab Vedotin failure.
.
J Clin Oncol
.
2016;
;
34
:
:3733.
–
9
.
4.
Ribas
A
,
Wolchok
JD
.
Cancer immunotherapy using checkpoint blockade.
.
Science
.
2018;
;
359
:
:1350.
–
5
.
5.
Arlauckas
SP
,
Garris
CS
,
Kohler
RH
,
et al.
In vivo
imaging reveals a tumor-associated macrophage-mediated resistance pathway in anti-PD-1 therapy
.
.
Sci Transl Med
.
2017;
;
9
:
:eaal3604.
.
6.
Oh
SA
, Wu D-C,
Cheung
J
,
et al.
PD-L1 expression by dendritic cells is a key regulator of T-cell immunity in cancer.
.
Nat Cancer
.
2020;
;
1
:
:681.
–
91
.
7.
Sade-Feldman
M
,
Yizhak
K
,
Bjorgaard
SL
,
et al.
Defining T cell states associated with response to checkpoint immunotherapy in melanoma.
.
Cell
.
2018;
;
175
:
:998.
–
1013.e20
.
8.
Siddiqui
I
,
Schaeuble
K
,
Chennupati
V
,
et al.
Intratumoral Tcf1
+
PD-1
+
CD8
+
T cells with stem-like properties promote tumor control in response to vaccination and checkpoint blockade immunotherapy
.
.
Immunity
.
2019;
;
50
:
:195.
–
211.e10
.
9.
Spitzer
MH
,
Carmi
Y
,
Reticker-Flynn
NE
,
et al.
Systemic immunity is required for effective cancer immunotherapy.
.
Cell
.
2017;
;
168
:
:487.
–
502.e15
.
10.
Wu
TD
,
Madireddi
S
,
de Almeida
PE
,
et al.
Peripheral T cell expansion predicts tumour infiltration and clinical response.
.
Nature
.
2020;
;
579
:
:274.
–
8
.
11.
Ruggiu
M
,
Guérin
MV
,
Corre
B
,
et al.
Anti-PD-1 therapy triggers Tfh cell-dependent IL-4 release to boosT CD8 T cell responses in tumor-draining lymph nodes.
.
J Exp Med
.
2024;
;
221
:
:e20232104.
.
|