| |
| Med Sci (Paris). 40(6-7): 581–583. doi: 10.1051/medsci/2024076.Inhibiteurs de point de contrôle immunitaire Du coup de foudre au cœur brisé Romain Batton,1a Paul Matte,1b Michael Aoun,1c Auréline Lefèvre,2d and Pierre-Emmanuel Joubert3e 1M2 Immunologie translationnelle et biothérapies, Parcours Immunologie, Master Biologie Moléculaire et cellulaire, Sorbonne Université
,
Paris
,
France 2M2 Immunologie intégrative et systématique, Parcours Immunologie, Master Biologie Moléculaire et cellulaire, Sorbonne Université
,
Paris
,
France 3Inserm UMRS 1138, Sorbonne Université
,
Paris
,
France MeSH keywords: Humains, Inhibiteurs de points de contrôle immunitaires, usage thérapeutique, Tumeurs, immunologie, Immunothérapie, méthodes |
Les ICI : le coup de foudre des immunothérapies Les inhibiteurs du point de contrôle immunitaire (ICI) sont des immunothérapies anti-cancéreuses qui ont fait basculer le pronostic de la maladie. Ces découvertes ont été honorées du prix Nobel de physiologie ou médecine en 2018, et ont permis d’obtenir des rémissions prolongées jusque-là inattendues.
Les principales cibles des ICI sont les voies du PD-1 (
program death-1
) / PD-L1 (
program death ligand-1
) et du CTLA-4 (
cytotoxic T lymphocyte–associated protein 4
), qui, physiologiquement, sont indispensables au maintien d’un équilibre entre l’activation de la réponse immunitaire et le contrôle de son emballement [
1
]. Lors de l’activation du système immunitaire, la reconnaissance du non-soi (
i.e.
infections, cancers) repose en partie sur les cellules présentatrices d’antigène (CPA) et les lymphocytes T (LT). Pour que le lymphocyte soit activé, il nécessite la succession de deux signaux inter-cellulaires : 1) la présentation de l’antigène par la CPA ; et 2) un signal de costimulation (interaction entre le CD28 du LT et le CD80/86 de la CPA) comme signal de confirmation. À la suite de la phase effectrice du LT, le récepteur membranaire CTLA-4 entre en jeu. CTLA-4 permet d’éviter l’emballement immunitaire en induisant un signal négatif au LT activé, favorisant son retour à l’état physiologique. Chez la souris, l’absence de signal inhibiteur par l’intermédiaire du CTLA-4 (par une déplétion bi-allélique du gène, CTLA-4
-/-
) provoque une lymphoprolifération létale [
2
]. Parmi les ICI, les anticorps anti-CTLA-4 (
i.e.
ipilimumab et tremelimumab) ciblent les LT activés en bloquant cet effet antiprolifératif, et permettent le maintien forcé de la réponse immunitaire. Cet effet est recherché pour le maintien d’une réponse anti-cancéreuse. La voie PD-1/PD-L1 est responsable d’un échappement des cellules tumorales au système immunitaire : l’expression de PD-L1 par la tumeur induit en effet un signal d’anergie des LT. D’autres ICI, comme les anticorps anti-PD-1/PDL-1 (i.e. pembrolizumab, nivolumab) bloquent donc cette anergie induite par la tumeur. Ces immunothérapies visent donc à restaurer une immunité antitumorale, soit par le blocage du signal d’inhibition d’une réponse immunitaire (voie CTLA-4), soit en levant l’inhibition des LT engendrée par la tumeur (voie PD-1/PD-L1). Certaines thérapies ciblant ces voies de signalisation servent également à réduire une réponse immunitaire incontrôlée ou disproportionnée. Par exemple, la voie CTLA-4 peut être ciblée avec l’abatacept, qui est une protéine de fusion composée du domaine extracellulaire de la protéine CTLA-4 lié à un fragment Fc modifié d’immunoglobuline humaine G1 (IgG1). L’effet agoniste de l’abatacept induit une immunosuppression.
|
Les ICI, une histoire de cœur !
Les ICI peuvent provoquer des effets indésirables attribuables à un emballement de la réaction immunitaire ; on parle alors d’effets indésirables liés à l’immunité (EIAI). Les EIAI sont des manifestations auto-immunes déclenchées par ces immunothérapies pouvant toucher tous les organes. Les EIAI sont relevés chez 60 % des patients ayant reçu une combinaison d’anticorps anti-PD-1/PD-L1 et anti-CTLA-4, bien que cette combinaison soit plus efficace pour induire une rémission oncologique [
3
]. Les EIAI sont dans la plupart des cas de faible gravité, touchant les organes endocriniens ou la peau [
3
,
4
]. Bien que rares, des EIAI, comme la myosite aux ICI (ICI-M), nécessitent d’être étudiés car ce sont les plus sévères, particulièrement en cas d’atteinte du muscle cardiaque (ou myocardite). Ces ICI-M sont particulièrement morbides, avec un taux de décès atteignant 56,7 %, tel que rapporté par Allenbach
et al.
[
5
]. Une étude de pharmacovigilance de grande ampleur, menée par Salem
et al.
en 2018 (base de donnée VigiBase de l’Organisation mondiale de la Santé), a évalué l’association entre les immunothérapies et les événements cardiovasculaires immunologiques [
6
]. L’exposition aux ICI est significativement associée aux EIAI cardiologiques chez les patients recevant une immunothérapie comme les ICI-M qui sont sévères dans 84 % des cas [
6
].
Dans cette étude, 26 % des patients atteints d’ICI-M avaient reçu une combinaison anti-PD-1/anti-CTLA-4 avec un délai médian de 30 jours (18-60 jours) après la première ligne de traitement [
6
]. Ces EIAI sont habituellement traités par corticothérapie ou immunosuppresseurs. De façon intéressante, il a été montré dans un modèle murin caractérisé par un défaut d’expression de CTLA-4 et de PD-L1 (CTLA-4
+/−
/PDCD1
−/−
), une propension surprenante et inattendue des animaux à développer une myocardite sévère [
7
]. Les caractéristiques anatomopathologiques cardiaques de ce modèle relevaient un infiltrat lymphocytaire CD3
+
CD8
+
, similaire à ce qui est décrit chez l’homme. L’utilisation d’abatacept dans ce modèle a permis de prévenir l’apparition de myocardite, soutenant l’intérêt de ce traitement pour arrêter la réaction immunitaire liée au double blocage PD-1/CTLA-4.
La prolifération des LT et l’inflammation dépendent également de la voie de signalisation JAK/STAT (
janus kinase / signal transducers and activators of transcription
). Les thérapies ciblées anti-JAK (
i.e.
ruxolitinib) représentent donc une autre approche intéressante pour induire une immunosuppression. Ces traitements sont déjà utilisés dans les réactions de greffon contre l’hôte lors d’allogreffes de moelle osseuse où il existe un emballement des LT [
8
]. Le séquençage de l’ARN en masse (
bulk RNA sequencing
) réalisé sur 200 biopsies musculaires périphériques de patients atteints d’ICI-M, a identifié une surexpression de la voie JAK/STAT chez les patients atteints d’ICI-M avec myocardite et suggère l’utilité de cibler cette voie chez ces patients [
9
].
|
Une nouvelle stratégie thérapeutique pour réparer un cœur brisé ?
Il est donc intéressant d’envisager l’utilisation conjointe de ruxolitinib (anti-JAK) et d’abatacept (agoniste de CTLA-4) pour traiter les ICI-M (
Figure 1
). Pour évaluer cette stratégie thérapeutique, Salem
et al.
ont étudié une cohorte de 40 patients (âge médian : 72 ans, hommes : 58 %) avec un diagnostic histologique d’ICI-M et atteints d’un cancer, métastatique dans 83 % des cas [
10
]. Ces patients avaient été traités par monothérapie anti-PD-1 ou par combinaison anti-PD-1/anti-CTLA-4 dans respectivement 75 % et 25 % des cas. Les principaux signes cliniques d’ICI-M sont en lien avec l’atteinte cardiaque (dyspnée, douleur thoracique, syncope) avec des anomalies électrocardiographiques dans 85 % des cas et associés à un déficit musculaire périphérique dans deux-tiers des cas environ. Cette dysfonction musculaire atteignait le diaphragme dans 10 % des cas, entraînant une insuffisance respiratoire sévère. La plupart des EIAI musculaires ou cardiaques de cette cohorte était de gravité modérée. Les biopsies musculaires endomyocardiques ou musculaires permettaient de faire le diagnostic. Le schéma de l’étude distinguait deux groupes de patients avec une stratégie thérapeutique adaptée au fil des inclusions. Les dix premiers patients (inclus de 2018 à mars 2020) ont tous été traités par corticothérapie intraveineuse à haute dose. En cas de résistance aux corticoïdes, ces patients ont reçu un traitement de sauvetage dans 80 % des cas (combinaisons d’échanges plasmatiques [80 %], d’abatacept [70 %], de mycophénolate mofétil [40 %], de tacrolimus [10 %], d’immunoglobulines intra-veineuses [20 %] ou de tacrolimus [10 %]. Les 30 patients suivants (inclus de mars 2020 à août 2021) ont bénéficié d’une stratégie thérapeutique dite « mécanistique » qui inclut un dépistage systématique de la défaillance musculaire respiratoire. Cette approche consistait en l’introduction rapide d’abatacept à haute dose associé au ruxolitinib, guidée par l’apparition d’atteinte musculaire diaphragmatique et surveillée biologiquement par la saturation du CD86RO. Le CD86RO est déjà utilisé comme biomarqueur pour surveiller l’effet immunosuppresseur du belatacept (qui a un mode d’action similaire à celui de l’abatacept), qui se lie au CD86 [
11
]. Cela a permis d’ajuster la dose d’abatacept pour obtenir une saturation du CD86RO satisfaisante chez tous les patients jusqu’à la résolution de l’atteinte musculaire cardiaque. L’approche mécanistique a permis de diminuer la mortalité liée à la myotoxicité, celle-ci passant de 60 % à 3 %. Ce schéma thérapeutique n’a pas modifié la survie sans progression liée au cancer chez les survivants, ce qui aurait pu être craint lors de la réversion des ICI. Cette observation clinique a guidé l’étude de l’expression génétique (transcriptomique) sur les biopsies endomyocardiques de neuf patients atteints d’ICI-M par
bulk RNA sequencing
. En comparaison avec quatre patients contrôles recevant des ICI qui ne présentaient pas de myocardite, la voie JAK2 était significativement plus exprimée (p = 0,013) chez les patients présentant une ICI-M, observation déjà décrite chez les modèles animaux. Cet article a donc permis de montrer qu’une combinaison de ruxolitinib et d’abatacept, guidée par l’identification précoce des patients à haut risque (myocardite, défaillance musculaire diaphragmatique), avec une surveillance de l’efficacité de l’abatacept par la saturation de son récepteur (CD86RO) semble bénéfique pour le traitement des EIAI cardiaques.
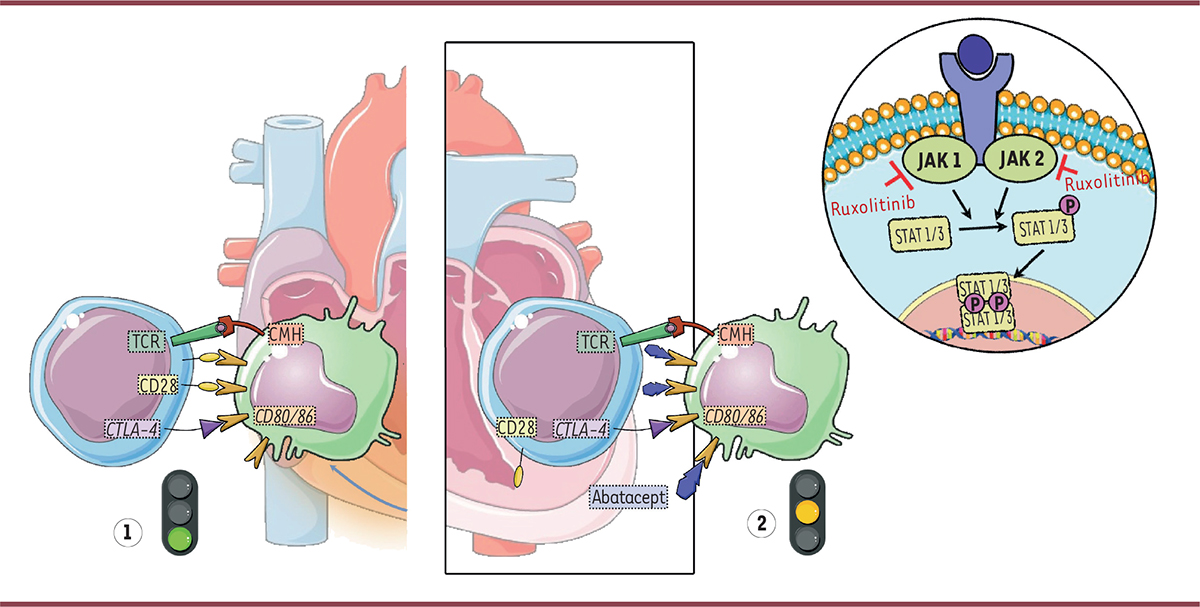
 | Figure 1.
Effet de l’abatacept et du ruxolitinib dans la lutte contre la myocardite induite par l’immunothérapie.
La physiopathologie de ces myotoxicités se caractérise par une nécrose des myocytes induite par des infiltrats lymphohistiocytaires secondaires à l’activation de lymphocytes T autoréactifs clonaux contre des antigènes musculaires (1). La voie de signalisation du CTLA-4 semble jouer un rôle critique dans le développement de la myocardite. L’abatacept, protéine de fusion CTLA-4–immunoglobuline (Ig), atténue l’inflammation myocardique. Le ruxolitinib (inhibiteur de JAK1/JAK2) exerce un effet synergique rapide avec l’abatacept en inactivant les lymphocytes T (2). CMH : complexe majeur d’histocompatibilité ; CD : cluster de différenciation ; JAK :
janus kinase
; STAT :
signal transducers and activators of transcription
; TCR : récepteur des cellules T ; CTLA-4 :
cytotoxic T lymphocyte–associated protein 4.
|
|
La myocardite induite par les ICI s’inscrit dans une maladie systémique de myosite induite aux ICI, qui a un pronostic péjoratif singulier. La surveillance d’autres signes d’atteinte musculaire permettrait de guider l’utilisation d’une combinaison par abatacept/ruxolitinib pour reverser l’effet des ICI chez ces patients. En effet, l’étude de Salem
et al.
montre une diminution significative de la mortalité spécifique lorsque cet EIAI est pris en charge de façon précoce. Les cibles thérapeutiques de l’inflammation et des LT sont soutenues par des données de transcriptomiques et pharmacodynamiques immunologiques. L’étude de phase II en cours, ACHLYS (NCT05195645), aura pour but de vérifier et confirmer cette stratégie thérapeutique chez ces patients.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Ribas
A
,
Wolchok
JD
.
Cancer immunotherapy using checkpoint blockade.
.
Science
.
2018;
;
359
:
:1350.
–
1355
.
2.
Chambers
CA
,
Kuhns
MS
,
Egen
JG
,
et al.
CTLA-4-Mediated Inhibition in Regulation of T Cell Responses: Mechanisms and Manipulation in Tumor Immunotherapy.
.
Annu Rev Immunol
.
2001;
;
19
:
:565.
–
594
.
3.
Morad
G
,
Helmink
BA
,
Sharma
P
,
et al.
Hallmarks of response, resistance, and toxicity to immune checkpoint blockade.
.
Cell
.
2021;
;
184
:
:5309.
–
37
.
4.
Wei
SC
,
Duffy
CR
,
Allison
JP
.
Fundamental Mechanisms of Immune Checkpoint Blockade Therapy.
.
Cancer Discov
.
2018;
;
8
:
:1069.
–
1086
.
5.
Allenbach
Y
,
Anquetil
C
,
Manouchehri
A
,
et al.
Immune checkpoint inhibitor-induced myositis, the earliest and most lethal complication among rheumatic and musculoskeletal toxicities.
.
Autoimmun Rev
.
2020;
;
19
:
:102586.
.
6.
Salem
J-E
,
Manouchehri
A
,
Moey
M
,
et al.
Cardiovascular toxicities associated with immune checkpoint inhibitors: an observational, retrospective, pharmacovigilance study.
.
Lancet Oncol
.
2018;
;
19
:
:1579.
–
1589
.
7.
Wei
SC
,
Meijers
WC
,
Axelrod
ML
,
et al.
A Genetic Mouse Model Recapitulates Immune Checkpoint Inhibitor-Associated Myocarditis and Supports a Mechanism-Based Therapeutic Intervention.
.
Cancer Discov
.
2021;
;
11
:
:614.
–
25
.
8.
Zeiser
R
,
Polverelli
N
,
Ram
R
,
et al.
Ruxolitinib for Glucocorticoid-Refractory Chronic Graft-versus-Host Disease.
.
N Engl J Med
.
2021;
;
385
:
:228.
–
38
.
9.
Pinal-Fernandez
I
,
Quintana
A
,
Milisenda
JC
,
et al.
Transcriptomic profiling reveals distinct subsets of immune checkpoint inhibitor induced myositis.
.
Ann Rheum Dis
.
2023;
;
82
:
:829.
–
36
.
10.
Salem
JE
,
Bretagne
M
,
Abbar
B
,
et al.
Abatacept/Ruxolitinib and Screening for Concomitant Respiratory Muscle Failure to Mitigate Fatality of Immune-Checkpoint Inhibitor Myocarditis.
.
Cancer Discov
.
2023;
;
13
:
:1100.
–
15
.
11.
Latek
R
,
Fleener
C
,
Lamian
V
,
et al.
Assessment of belatacept-mediated costimulation blockade through evaluation of CD80/86-receptor saturation.
.
Transplantation
.
2009;
;
87
:
:926.
–
933
.
|