| |
| Med Sci (Paris). 40(6-7): 578–580. doi: 10.1051/medsci/2024075.La voie c-GAS-STING au sein des tumeurs avec instabilité chromosomique Des rôles contradictoires ? Baudouin Courtier,1a Matthieu Delaye,2b and François-Xavier Danlos3c 1Master Biologie Moléculaire et Cellulaire (BMC), Parcours Immunologie, M2 Immunologie Translationnelle et Biothérapies (ITB), Sorbonne Université
,
Paris
,
France 2Master Biologie Moléculaire et Cellulaire (BMC), Parcours Immunologie, M2 Immunologie Intégrative et Systémique (I2S), Sorbonne UNiversité
,
Paris
,
France 3Inserm U1015, Gustave Roussy, Université Paris Saclay
,
France MeSH keywords: Humains, Instabilité des chromosomes, Tumeurs, génétique, Transduction du signal, génétique, Protéines membranaires, génétique, Animaux |
L’instabilité chromosomique comme déterminant du processus tumoral
La cancérogénèse est la conséquence de l’acquisition d‘altérations génomiques. Ces dernières associent des mutations ponctuelles à de plus importantes aberrations chromosomiques, induisant
in fine
la survie de cellules anormales par l’acquisition d’avantages sélectifs, menant au développement de maladies tumorales. La première description d’un lien entre anomalies chromosomiques et cancer a été réalisée par Theodor Boveri en 1914 [
1
]. Parmi les phénomènes étudiés, l’instabilité chromosomique, en anglais
chromosomal instability
(CIN), est un processus dynamique acquis lors de divisions cellulaires consécutives, associé à des pertes ou des gains aberrants à l’échelle de tout ou d’une partie du chromosome [
2
]. La CIN concernerait 60 à 80 % des tumeurs humaines [
3
]. Elle est associée au processus métastatique, à la résistance aux thérapeutiques oncologiques usuelles, et plus généralement, à un pronostic défavorable [
4
]. À l’échelle cellulaire, la CIN peut conduire à des anomalies chromosomiques numériques mais aussi structurelles, découlant notamment d’erreurs durant la mitose. Ces dernières entraînent une hétérogénéité caryotypique ainsi que la formation de
micronuclei
[
5
]. Les chromosomes renfermés dans les
micronuclei
sont potentiellement exposés dans le cytosol en cas de rupture membranaire, mettant à nu l’ADN double brin. Il est dorénavant connu que cette exposition promeut l’inflammation
via
l’activation de la voie cGAS-STING (
cyclic GMP-AMP synthase-stimulator of interferon genes
), faisant le lien entre CIN et activation du système immunitaire [
6
].
|
cGAS STING : une voie aux effets contradictoires
L’ADN cytosolique, sous sa forme double brin, est reconnu par cGAS dont il est le ligand. L’activation de cGAS génère la production de cGAMP (GMP-AMP cyclique) qui active à son tour STING, complexe situé à la surface du réticulum endoplasmique. S’ensuit alors la production d’IFN-I (interféron de type 1, dont l’IFN-α) ainsi que d’autres cytokines inflammatoires parmi lesquelles l’IL-6 (interleukine-6) et le TNF-α (
tumor necrosis factor alpha
). Il est donc logique de penser que l’activation de cette voie pourrait potentialiser l’activité immunitaire anti-tumorale et que son inactivation pourrait être un mécanisme possible d’échappement des cellules tumorales au système immunitaire. De récentes découvertes [
6
] ont montré que, non seulement la voie cGAS-STING n’est pas forcément inactivée en situation tumorale, mais qu’elle peut, au contraire, participer au processus métastatique et à la résistance aux thérapies. Sur la base de cette ambiguïté, le travail de Hong
et al.
, présenté dans cette nouvelle et récemment publié dans la revue
Nature
[
7
], s’est intéressé aux effets induits par la CIN, et plus précisément à la mécanistique de la voie cGAS-STING et aux effets qui en découlent afin d’identifier des voies thérapeutiques potentielles.
|
cGAS STING comme déterminant de la survie des cellules tumorales avec CIN
Cette étude a été réalisée
in vitro
sur des lignées cellulaires de cancer du sein triple négatif et
in vivo
à l’aide d’un modèle murin (allogreffe de cellules de cancer du sein triple négatif avec différents
knock-out
[KO] dans des souris Balb/c). Une CIN a été induite en utilisant des inhibiteurs de deux protéines de contrôle de la mitose (MPS1 et WEE1), dans l’objectif d’engendrer la création de
micronuclei
et d’activer la voie cGAS-STING. Dans ces modèles
in vitro
et
in vivo,
une délétion de la voie cGAS-STING entraîne une moins bonne survie cellulaire, suggérant que cette voie est importante aux cellules tumorales pour faire face à la CIN. Ensuite, les auteurs se sont penchés sur les protéines en aval de cGAS et de STING dans la cascade de signalisation. Une analyse transcriptomique a permis d’orienter la recherche sur la voie IFN/STAT1/STAT3
(signal transducer and activator of transcription
1 et 3
)
et la voie TNF-α/NF-κB (
nuclear factor-kappa B
). Après induction d’une instabilité chromosomique, la survie cellulaire est diminuée dans les lignées où STAT3 est inactivé et, au contraire, augmentée lorsque STAT1 est inactivé. Dans les lignées cGAS KO et STAT3 KO, l’expression de STAT1 est associée à une moins bonne survie cellulaire.
L’inactivation de RELB (voie non-canonique de la signalisation NF-κB) est également responsable d’une moins bonne viabilité cellulaire après induction d’une CIN, ce qui n’est pas le cas pour RELA (voie canonique de la signalisation NF-κB). L’ensemble de ces résultats suggère que les cellules de cancer du sein du modèle, après induction d’une instabilité chromosomique, s’appuient sur la voie cGAS-STING-STAT3 et NF-κB non canonique pour prévenir la mort cellulaire médiée notamment par STAT1 (
Figure 1
).
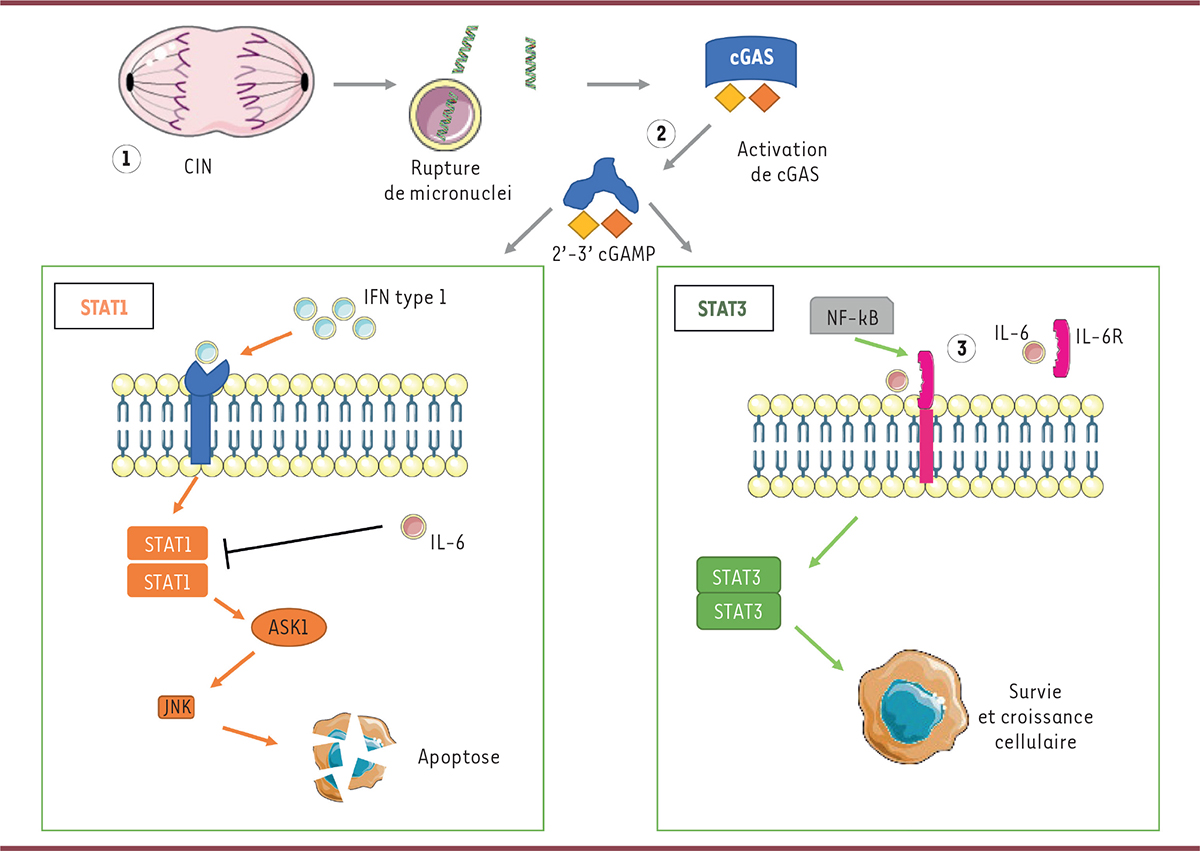
 | Figure 1.
Activation de la voie cGAS-STING en réponse à une instabilité chromosomique et cibles des potentielles stratégies thérapeutiques. 1.
: action des inhibiteurs de WEE-1 : WEE-1 est une protéine de contrôle de la mitose. Son inactivation augmente l’instabilité chromosomique ce qui entraine la génération de micronuclei. L’ADN tumoral contenu dans ces micronuclei est exposé dans le cytosol lors de la rupture de ces derniers et active alors la voie cGAS-STING.
2
: action des agonistes de STING : les agonistes de STING activent deux voies en aval, l’une dépendante de STAT 1 et des IFN de type I aboutissant à une action antitumorale, l’autre dépendante de STAT3, NF-kB et de l’IL-6 aboutissant à une survie cellulaire.
3
: action des anti-IL-6R comme le Tocilizumab : blocage de la seconde voie de signalisation en aval de STING et dépendante de STAT3, favorable à la survie cellulaire. L’activation de cGAS-STING n’aboutit alors plus qu’à l’activation de la voie dépendante de STAT1 et donc à une diminution de la survie cellulaire tumorale. CIN : instabilité chromosomique ; IFN : interféron ; IL-6 : interleukine 6 ; IL-6R : récepteur de l’interleukine 6.
|
|
L’IL-6, induit par la voie cGAS-STING-RELB délivre un signal de survie dépendant de STAT3
Afin de mieux caractériser les facteurs réellement impliqués dans la moins bonne survie des cellules cGAS KO, et partant du principe que cGAS induit un signal inflammatoire important, les auteurs se sont ensuite intéressés à l’expression des cytokines et notamment de l’IL-6, activateur connu de STAT3 [
8
]. Des analyses par PCR (
polymerase chain reaction
) quantitative montrent que l’expression de l’IL-6 est augmentée en cas d’activation de cGAS mais, de façon intéressante, considérablement diminuée en cas de délétion des gènes codant cGAS, STING ou RELB. De ce fait, il a été montré une augmentation de la survie cellulaire dans des lignées cGAS KO, STING KO et RELB KO, par simple administration d’IL-6. Cet effet n’est pas reproduit dans les cellules STAT3 KO, démontrant que l’IL-6 opère en aval de cGAS STING et en amont de STAT3. L’IFN-α a également été étudié. Celui-ci augmente la survie cellulaire dans le cas de cGAS KO, mais pas STAT3 KO. Des doses importantes sont par ailleurs délétères. Cela pourrait s’expliquer par une activation par l’IFN-α de STAT 3 mais aussi de STAT 1 qui, hyperstimulé par des doses importantes d’IFN-α, pourrait contrecarrer l’effet pro-survie induit par STAT3 [
9
]. Pour aller plus loin, l’équipe a étudié l’effet d’un inhibiteur de l’IL-6R (récepteur de l’IL-6) utilisé en pratique clinique, le tocilizumab. L’administration de tocilizumab est associée à une baisse significative de la viabilité cellulaire dans le modèle étudié après induction d’une CIN. On ne note en revanche pas d’impact significatif d’une exposition au Tocilizumab des cellules cGAS KO, évoquant une inefficacité sur la survie cellulaire de l’IL6 en l’absence d’activation en amont de cGAS.
Enfin, une analyse de corrélation fondée sur le
The Cancer Genome Atlas
(TCGA) montre que les tumeurs exprimant fortement cGAS présentent un taux élevé d’aneuploïdie et de CIN et une forte expression d’IL-6 et d’IL-6R. De plus, les patients dont la tumeur présente une aneuploïdie élevée, une CIN et dont la signalisation IL-6 est activée ont une survie globale diminuée.
|
Perspectives en oncologie
Ce travail démontre que l’activation des voies cGAS-STING-STAT3 et NF-κB, avec implication de l’IL6, permet aux cellules tumorales de survivre à l’instabilité chromosomique, mais que ce phénomène est réversible dans des modèles
in vitro
et
in vivo
par l’administration d’un inhibiteur de l’IL-6R. Il n’existe pas à l’heure actuelle de pratique standardisée de mesure de l’instabilité chromosomique, même si l’on connaît la prévalence importante de la CIN en situation métastatique. Ce travail souligne l’intérêt mais aussi la complexité d’agir sur la voie cGAS-STING en thérapeutique (
Figure 1
). Il existe d’ores et déjà des médicaments inducteurs de CIN autres que la chimiothérapie, comme les inhibiteurs de Wee1, ayant obtenu des résultats encourageants notamment dans les tumeurs gynécologiques [
10
]. Par ailleurs, des agonistes de STING, développés dans l’objectif d’induire la transcription des IFN de type I et d’autres cytokines pro-inflammatoires (par exemple, le TNF-α, l’IL-6) afin de promouvoir les réponses antitumorales innées et adaptatives, sont actuellement à l’étude dans le cadre d’essais de phase I. Au vu des données pré-cliniques et des résultats présentés dans cet article, il apparaît important de délimiter les effets pro-tumoraux de l’activation de la voie cGAS-STING, parallèlement à la compréhension des effets immunitaires anti-tumoraux de ces agents. Une possibilité pourrait être d’inhiber la voie STAT3 et donc le signal de survie par l’adjonction d’inhibiteurs de l’IL-6R, afin d’obtenir une activité anti-tumorale chez ces patients au pronostic défavorable (
Figure 1
).
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Boveri
T
.
Zur Frage der Entstehung maligner Tumoren
.
.
Fischer;
;
1914
.
:70.
p.
2.
Lengauer
C
,
Kinzler
KW
,
Vogelstein
B
.
Genetic instabilities in human cancers.
.
Nature
.
1998;
;
396
:
:643.
–
649
.
3.
Cimini
D.
Merotelic kinetochore orientation, aneuploidy, and cancer.
.
Biochimica et Biophysica Acta
.
2008;
;
1786
:
:32.
–
40
.
4.
Sansregret
L
,
Vanhaesebroeck
B
,
Swanton
C
.
Determinants and clinical implications of chromosomal instability in cancer.
.
Nat Rev Clin Oncol
.
2018;
;
15
:
:139.
–
150
.
5.
Mackenzie
KJ
,
Carroll
P
,
Martin
CA
,
et al.
cGAS surveillance of micronuclei links genome instability to innate immunity.
.
Nature
.
2017;
;
548
:
:461.
–
465
.
6.
Bakhoum
SF
,
Ngo
B
,
Laughney
AM
,
et al.
Chromosomal instability drives metastasis through a cytosolic DNA response.
.
Nature
.
2018;
;
553
:
:467.
–
472
.
7.
Hong
C
,
Schubert
M
,
Tijhuis
AE
,
et al.
cGAS–STING drives the IL-6-dependent survival of chromosomally instable cancers.
.
Nature
.
2022;
;
607
:
:366.
–
73
.
8.
Hui
KPY
,
Li
HS
,
Cheung
MC
,
et al.
Highly pathogenic avian influenza H5N1 virus delays apoptotic responses via activation of STAT3.
.
Sci Rep
.
2016;
;
6
:
:28593.
.
9.
Bromberg
JF
,
Horvath
CM
,
Wen
Z
,
et al.
Transcriptionally active Stat1 is required for the antiproliferative effects of both interferon alpha and interferon gamma.
.
Proc Natl Acad Sci U S A
.
1996;
;
93
:
:7673.
–
7678
.
10.
Liu
JF
,
Xiong
N
,
Campos
SM
,
et al.
Phase II Study of the WEE1 Inhibitor Adavosertib in Recurrent Uterine Serous Carcinoma.
.
JCO
.
2021;
;
39
:
:1531.
–
9
.
|