Nous avons étudié deux modèles génétiques murins reproduisant fidèlement les deux sous-types principaux d’hétérotopie de la matière grise. Des reconstructions tridimensionnelles de cerveaux entiers nous ont permis de confirmer que, comme chez l’homme, le modèle murin d’HNPV présente une hétérotopie qui borde le ventricule cérébral et fait saillie dans sa lumière ; le modèle d’HSB, quant à lui, présente une hétérotopie incluse dans la matière blanche, qui la sépare du ventricule et du cortex [
5
].
Grâce à des immunomarquages des différentes populations de neurones corticaux et à une analyse d’image par apprentissage automatique, nous avons d’abord caractérisé la composition neuronale des deux types d’hétérotopie. Nous avons ensuite affiné cette caractérisation par une analyse morphologique des neurones de l’hétérotopie après reconstruction tridimensionnelle de leurs axones et de leurs dendrites. Une analyse multivariée
1,
incluant plusieurs dizaines de paramètres morphologiques tirés de ces reconstructions a permis d’identifier trois sous-types morphologiques, ou « morphotypes », par une méthode de regroupement hiérarchique : deux sont retrouvés principalement chez le modèle d’HSB, et le troisième, principalement chez le modèle d’HNPV. Ainsi, des morphologies neuronales aberrantes communes, mais également distinctes, sont retrouvées au sein des hétérotopies des deux modèles murins [
5
].
Nous avons prolongé l’analyse en caractérisant les propriétés électrophysiologiques des neurones de l’hétérotopie, grâce à des enregistrements par la méthode du
patch-clamp
2
en configuration « cellule entière » [
10
] (
→
).
(→) Voir l’article de J. Teulon,
m/s
n° 5, mai 2004, page 550
Afin de déterminer si des « électrotypes » pouvaient être identifiés sur la base des paramètres électrophysiologiques mesurés, et si ces électrotypes pouvaient être associés à des morphotypes distincts, nous avons eu recours à des analyses multivariées. Par regroupement hiérarchique, nous avons identifié deux électrotypes : l’un est principalement retrouvé chez le modèle murin d’HSB, et l’autre, chez le modèle murin d’HNPV. Les propriétés de ces électrotypes sont distinctes entre elles, mais elles sont également différentes des propriétés de neurones corticaux « normaux », ce qui confirme le profil anormal de ces neurones. Dans leur ensemble, ces résultats indiquent l’existence de signatures morpho-électriques spécifiques de chaque sous-type d’hétérotopie, étroitement associées à leurs étiologies respectives [
5
] (
Figure 1
).
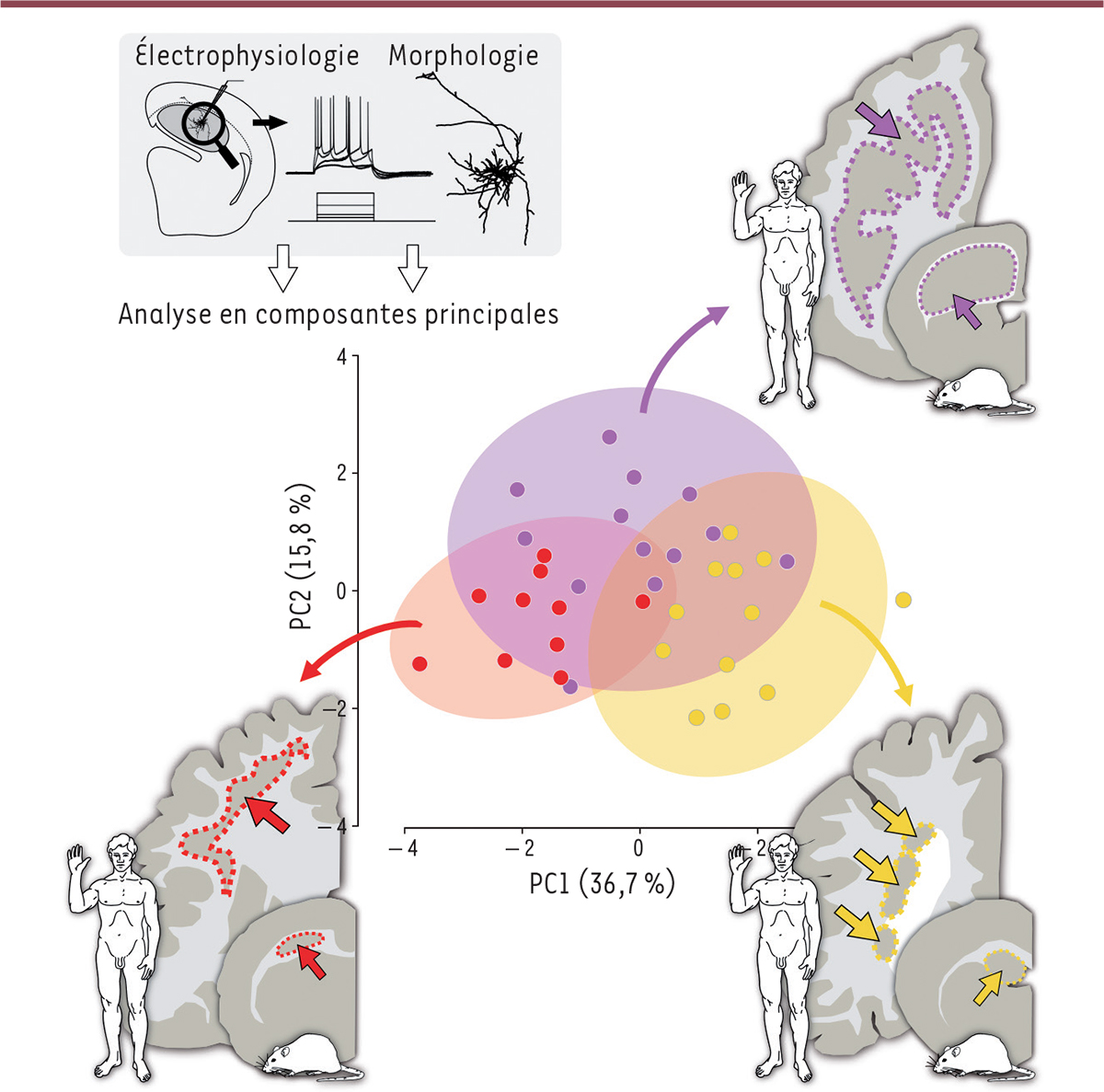
 | Figure 1.
Signatures morpho-fonctionnelles des hétérotopies de la matière grise.
Différents sous-types d’hétérotopie de la matière grise chez l’homme, et leurs modèles précliniques murins sont schématisés : des hétérotopies sous-corticales en bande sont représentées en rouge et en mauve, et une hétérotopie nodulaire périventriculaire est représentée en jaune. L’analyse en composantes principales (
principal components
, PC) des propriétés électrophysiologiques et morphologiques des neurones composant les hétérotopies chez les modèles murins permet de révéler l’existence de signatures pathologiques distinctes selon le sous-type d’hétérotopie. L’analyse des données en composantes principales consiste à transformer des variables liées entre elles en nouvelles variables décorrélées les unes des autres (graphe modifié d’après [
5
], et données non publiées).
|
Si les hétérotopies de la matière grise sont associées à un risque accru d’épilepsie, les crises épileptiques sont variables selon les patients et selon les sous-types d’hétérotopie [
6
]. En outre, les contributions respectives de l’hétérotopie et du cortex environnant lors des crises sont mal comprises. Grâce à l’imagerie calcique à large champ menée
ex vivo
à l’interface entre hétérotopie et cortex, nous avons étudié la dynamique d’évènements épileptiformes induits pharmacologiquement chez les modèles murins d’HSB et d’HNPV. Nous avons constaté que ces évènements épileptiformes engagent l’activité synchronisée de populations de neurones localisés à la fois dans l’hétérotopie et dans le cortex. Cependant, la dynamique de recrutement de ces neurones varie selon le sous-type d’hétérotopie. Ainsi, chez le modèle d’HSB, les neurones de l’hétérotopie sont préférentiellement recrutés lors de l’initiation des évènements épileptiformes, alors qu’il n’existe pas de recrutement préférentiel des neurones de l’hétérotopie ou du cortex chez le modèle d’HNPV [
6
]. Ces résultats suggèrent l’existence d’une implication différentielle de l’hétérotopie dans les circuits neuronaux responsables des crises épileptiques, selon le sous-type d’hétérotopie considéré.
Pour approfondir la description de ces circuits neuronaux pro-épileptogènes, nous avons utilisé une méthode de cartographie fonctionnelle des entrées excitatrices. Cette méthode combine des enregistrements électrophysiologiques par la méthode du
patch-clamp
et la libération photo-induite de glutamate, permettant de cartographier les entrées synaptiques reçues par un neurone identifié. Chez les deux modèles murins d’hétérotopie, la majorité des entrées reçues par les neurones de l’hétérotopie provient de l’hétérotopie elle-même, et les entrées en provenance du cortex sont minoritaires. La reconstruction des neurones enregistrés l’a confirmé, en révélant une arborisation dendritique et axonale principalement contenue dans les limites de l’hétérotopie, bien que certains axones atteignent le cortex sus-jacent [
6
]. Ces résultats indiquent une prédominance de connexions récurrentes entre les neurones de l’hétérotopie, accompagnées de quelques connexions réciproques avec le cortex sus-jacent.
Grâce à une approche comparative multimodale, notre travail de recherche a mis en lumière l’existence d’altérations développementales complexes qui retentissent sur les propriétés morphologiques et électrophysiologiques des neurones des hétérotopies. Associées à une connectivité altérée, ces propriétés morpho-électriques anormales contribuent aux dynamiques distinctes et aux origines spatiales différentes des activités épileptiformes associées à ces hétérotopies. Certaines de ces propriétés sont altérées dans les deux sous-types d’hétérotopie étudiés, alors que d’autres sont spécifiques d’un sous-type, permettant ainsi de définir des signatures pathologiques spécifiques.