Un à deux enfants sur 1 000 naissent avec une surdité profonde, et un enfant sur 700 développera une surdité avant l’âge adulte [ 1 ]. Près de 80 % des surdités congénitales sont d’origine génétique. La plupart de ces surdités résultent de la perte irréversible de différents types de cellules de la cochlée : les cellules ciliées internes, qui sont les véritables cellules sensorielles transformant l’onde sonore en message nerveux ; les cellules ciliées externes, qui ont un rôle mécanique amplificateur ; les neurones auditifs primaires, qui véhiculent le message nerveux jusqu’au noyau cochléaire du tronc cérébral, premier relai des voies sensorielles de l’audition ; et les cellules de la strie vasculaire, une structure épithéliale cochléaire produisant l’endolymphe, le fluide dans lequel baigne la partie apicale des cellules de l’épithélium sensoriel ( Figure 1 ). L’analyse des formes de surdité héréditaire offre une opportunité unique d’identifier des gènes essentiels pour l’audition. À ce jour, 105 locus de surdité récessive (DFNB) et 79 locus de surdité dominante (DFNA) ont été décrits dans le génome humain (sans compter ceux, encore plus nombreux, des surdités syndromiques 1 ), et la plupart des gènes responsables ont été identifiés. Les protéines correspondantes sont classifiées selon leur fonction 1) dans la structure ou le fonctionnement de la touffe ciliaire coiffant les cellules ciliées, 2) dans l’homéostasie ionique de la cochlée, 3) dans la composition de la matrice extracellulaire, ou 4) dans le contrôle de l’expression génique.
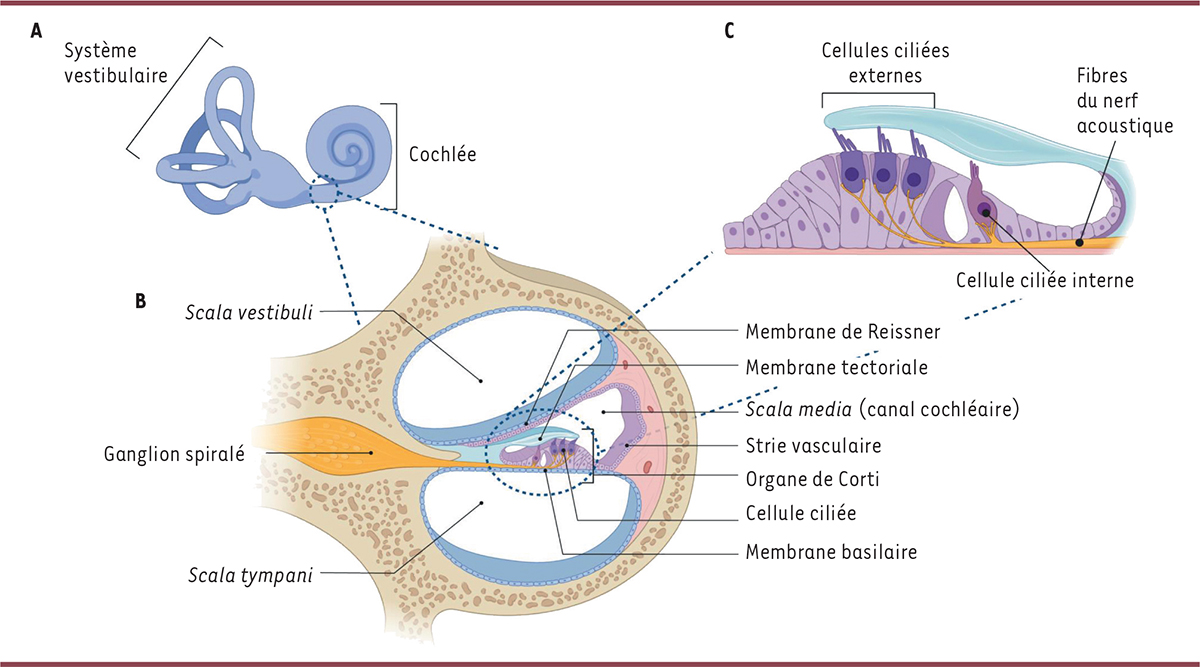
| Figure 1.
La cochlée, organe de l’audition. A.
L’oreille interne des mammifères comprend la cochlée, organe sensoriel de l’audition, et cinq organes sensoriels vestibulaires pour l’équilibration.
B.
Une coupe transversale de la cochlée montre ses trois canaux membraneux juxtaposés: les scala
vestibuli
et
tympani
, remplies de la périlymphe, et la
scala media
ou canal cochléaire, remplie de l’endolymphe. Le canal cochléaire est séparé de la
scala vestibuli
par la membrane de Reissner et de la
scala tympani
par la membrane basilaire. L’épithélium sensoriel auditif, ou organe de Corti, fait saillie dans le canal cochléaire. Il est surmonté d’un gel acellulaire, la membrane tectoriale. Il est composé des cellules ciliées et de leurs cellules de soutien, dont la partie apicale (au-dessus des jonctions intercellulaires serrées) baigne dans l’endolymphe, et le reste dans la périlymphe. La composition ionique de l’endolymphe, très différente de celle des autres fluides extracellulaires de l’organisme (incluant la périlymphe), est proche de celle du milieu intracellulaire: riche en ions K
+
(environ 150mM) et pauvre en ions Na
+
(1mM). Par ailleurs, il existe une différence transépithéliale de potentiel électrique (environ +100mV) entre les compartiments endolymphatique et périlymphatique de la cochlée, qui contribue majoritairement à la force motrice du courant ionique de la transduction mécano-électrique. Les cellules ciliées sont innervées par les neurones du ganglion spiralé.
C.
Un agrandissement de l’organe de Corti montre les deux types de cellules ciliées: les cellules ciliées internes, qui sont les véritables cellules sensorielles auditives, et les cellules ciliées externes, qui ont un rôle mécanique d’amplification locale de l’oscillation de l’organe de Corti au passage de l’onde sonore grâce à leur propriété d’électromotilité.
|
TMPRSS3 est une protéase à sérine transmembranaire de type II du réticulum endoplasmique, qui comprend un domaine transmembranaire, un domaine LDLRA ( low density lipoprotein receptor A ), un domaine SRCR ( scavenger receptor cysteine-rich ) et un domaine SP ( serine protease ). Le gène TMPRSS3 est exprimé dans différents types cellulaires de la cochlée (cellules de la strie vasculaire, cellules ciliées, neurones auditifs primaires), et la protéine active in vitro le canal sodique épithélial ENaC [ 2 ]. Des variants de TMPRSS3 sont responsables des surdités récessives DFNB8 et DFNB10 [ 3 ]. DFNB8 est une surdité postlinguale 2 progressive, alors que DFNB10 est une surdité sévère d’apparition précoce, prélinguale. Plusieurs dizaines de mutations différentes de TMPRSS3 ont été décrites dans plus de vingt groupes ethniques [ 4 ]. À ce jour, la seule option de réhabilitation auditive pour ces surdités est la pose chirurgicale d’un implant cochléaire 3 . Toutefois, les résultats varient en fonction notamment de l’âge d’implantation, mais également de l’atteinte initiale [ 5 ]. De plus, cette technique ne résout pas les difficultés de perception des sons dans un environnement bruyant.
L’utilisation de vecteurs viraux à des fins de thérapie génique a connu un essor spectaculaire ces deux dernières décennies. Dans la perspective d’une application de cette thérapie à certaines formes génétiques de surdité, les virus adéno-associés (AAV) ont rapidement été privilégiés du fait de leur capacité à transduire efficacement et durablement les cellules cibles dans l’oreille interne, assurant une expression du transgène tout en induisant une réaction immunitaire limitée. Les cellules ciblées par les AAV dépendent de leur sérotype, c’est pourquoi le choix de celui-ci est primordial pour l’élaboration de la stratégie thérapeutique. Enfin, la voie d’administration doit permettre une bonne distribution des particules virales tout en préservant l’intégrité de l’oreille interne [ 6 , 7 ] ( → ).
(→) Voir la Synthèse de A. Meyer et al ., m/s n° 10, octobre 2013, page 883
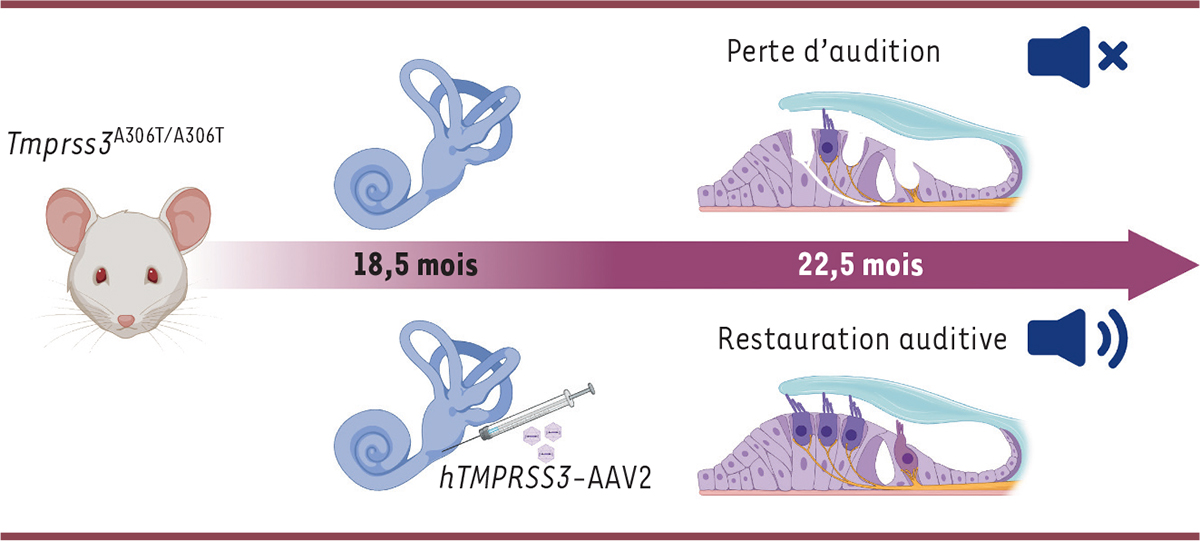
La majorité des études publiées concernant la thérapie génique des surdités ont utilisé des modèles murins à des âges post-natals précoces (allant du stade nouveau-né à juvénile), auxquels la cochlée n’était pas encore mature. Cependant, chez l’homme, le développement cochléaire se déroule avant la naissance. Quant à la surdité DFNB8, elle est d’apparition tardive : il était donc important d’apporter une preuve de concept quant à l’efficacité de la transduction lors d’une injection de particules virales dans un modèle animal à un âge où la cochlée est mature. À cet effet, une équipe de chercheurs a généré une souris portant la mutation faux-sens c.916G>A (p.Ala306Thr) responsable de la surdité tardive progressive DFNB8 chez l’homme [ 8 ]. Contrairement au modèle murin Tmprss3 Y260X/Y260X de la surdité humaine DFNB10, qui présente une surdité congénitale profonde [ 9 ], la souris mutante Tmprss3 A306T/A306T a une audition comparable à celle de souris témoins jusqu’à l’âge de 10,5 mois. Cependant, à partir de 16,5 mois, on constate une augmentation des seuils de perception à l’enregistrement des potentiels évoqués auditifs du tronc cérébral (accompagnée d’une diminution de l’amplitude de l’onde 1 reflétant l’activité électrique du nerf auditif) et des seuils de recueil des otoémissions acoustiques. Cette surdité progressive est associée à des pertes de cellules ciliées internes et externes, ainsi qu’à une dégénérescence des neurones auditifs primaires [ 8 ].
Le transfert, à des souris témoins de génotype « sauvage » âgées de 2 mois, du gène Tmprss3 murin au moyen de vecteurs AAV2, par la fenêtre ronde de la cochlée après perforation du canal cochléaire, s’est révélée fortement ototoxique, entraînant une surdité sévère et une perte des cellules ciliées externes. Étonnamment, l’injection du gène TMPRSS3 humain, malgré une homologie de séquence nucléotidique de 89 % avec le gène murin, n’a, quant à elle, induit aucune perte auditive chez les souris témoins, validant ainsi une utilisation des particules virales hTMPRSS3 -AAV2 dans un but thérapeutique. Chez les souris mutantes Tmprss3 A306T/A306T , les auteurs ont alors fait le choix de réaliser une injection unique, unilatérale (l’autre oreille étant utilisée comme témoin interne), des particules hTMPRSS3 -AAV2 à l’âge de 18,5 mois, soit deux mois après la première atteinte auditive constatée chez ces souris. Cette injection a permis une transduction efficace des cellules ciliées et des neurones du ganglion spiralé, ainsi que la préservation de ces cellules chez les souris mutantes. Sur le plan fonctionnel, la présence de la protéine TMPRSS3 humaine dans ces cellules a restauré les seuils des potentiels évoqués auditifs (avec augmentation de l’amplitude de l’onde 1) et des otoémissions acoustiques pour l’oreille injectée. L’effet thérapeutique de la transduction des cellules par le vecteur viral a été évalué régulièrement jusqu’à quatre mois après l’injection de ce vecteur ( i.e. , jusqu’à l’âge de 22,5 mois), date à laquelle l’effet bénéfique de l’expression de hTMPRSS3 sur l’audition des souris mutantes était toujours présent [ 8 ] ( Figure 2 ). Toutefois, il convient de souligner la limite de ce modèle murin sur fonds génétique CBA/CaJ, car ces souris développent spontanément une surdité liée au vieillissement, qui empêche de prolonger l’analyse longitudinale des effets de cette thérapie génique tardive.
| Figure 2.
Schéma du protocole de thérapie génique de la surdité murine par mutation faux-sens de Tmprss3.
En haut: les souris mutantes Tmprss
3A306T/A306T
(modèle murin de la surdité humaine DFNB8) ont une perte auditive progressive à partir de l’âge de 16,5 mois, associée à une dégénérescence des cellules ciliées de l’épithélium sensoriel de la cochlée. En bas: l’administration locale d’un vecteur viral AAV2 codant la protéine TMPRRS3 humaine à ces souris à l’âge de 18,5 mois a corrigé cette perte auditive et préservé les cellules ciliées plus de quatre mois après l’injection thérapeutique.
|
Cette étude a montré l’efficacité d’une thérapie génique tardive sur une cochlée mature, et ouvre ainsi de nouvelles perspectives d’un traitement curatif pour les personnes atteintes de la surdité DFNB8 due à des mutations faux-sens de TMPRSS3 . Les résultats prometteurs obtenus avec un modèle murin de cette forme de surdité devraient en effet encourager la réalisation d’un essai thérapeutique chez l’homme. Un tel essai s’inscrira dans le cadre de programmes internationaux, dont l’un a récemment fait état du succès thérapeutique de l’injection locale du gène OTOF à des personnes atteintes de la surdité DFNB9, due à un défaut de l’exocytose des vésicules synaptiques des cellules ciliées internes 4 . Dans le cas de la surdité progressive DFNB8, si le diagnostic est posé suffisamment tôt, la thérapie génique pourrait préserver les cellules ciliées et les neurones du ganglion spiralé de la dégénérescence induite par l’absence de protéine TMPRSS3 fonctionnelle. Si la surdité est plus avancée, la thérapie génique pourra être envisagée en combinaison d’un implant cochléaire, afin de protéger les neurones du ganglion spiralé encore fonctionnels.