| |
| Med Sci (Paris). 40(5): 399–401. doi: 10.1051/medsci/2024043.L’infection des hépatocytes par le virus de l’hépatite C altère la structure et la fonction des peroxysomes Esther Martin de Fourchambault1 and Yves Rouillé1* 1Université de Lille, CNRS UMR9017, Inserm U1019, Centre hospitalo-universitaire de Lille, Institut Pasteur de Lille, Centre d’infection et d’immunité de Lille
,
Lille
,
France MeSH keywords: Animaux, Hepacivirus, physiologie, Hépatite C, virologie, Péroxysomes, métabolisme |
Le virus de l’hépatite C est un virus à ARN simple brin positif infectant les hépatocytes humains. Il est responsable d’une maladie chronique du foie induisant une fibrose hépatique, parfois accompagnée de stéatose, et pouvant conduire, après 20 à 30 ans d’évolution, au développement d’une cirrhose hépatique ou d’un hépatocarcinome. D’après les dernières estimations de l’Organisation mondiale de la Santé, environ 58 millions de personnes dans le monde seraient actuellement chroniquement infectées par le virus de l’hépatite C, et 80 % de ces infections n’auraient pas été dépistées. Depuis les années 2010, l’utilisation de médicaments antiviraux à action directe, un traitement curatif efficace à plus de 95 %, a permis de guérir un grand nombre de patients souffrant d’hépatite C chronique. Cependant, certaines altérations cellulaires causées par l’infection chronique se sont avérées irréversibles, et les patients guéris conservent un risque accru de développer un hépatocarcinome, même plusieurs années après la fin de leur traitement [
1
].
Comme pour de nombreux virus à ARN simple brin positif, l’ARN génomique du virus de l’hépatite C se réplique dans des structures membranaires cytoplasmiques induites par l’infection virale : les complexes de réplication. Dans le cas de l’infection par le virus de l’hépatite C, ces complexes de réplication sont constitués de vésicules à double membrane dérivées du réticulum endoplasmique [
2
]. Afin de mettre en évidence de nouveaux partenaires cellulaires de la réplication virale, un crible de biotinylation de proximité [
3
] a été réalisé pour identifier des protéines présentes à proximité de la protéine virale NS5A, qui est majoritairement localisée aux complexes de réplication du virus [
4
]. Nous avons ainsi identifié la protéine ACBD5 (
acyl-coenzyme A-binding domain-containing protein 5
), une protéine de la membrane des peroxysomes impliquée dans la formation de zones de contact membranaire et le transfert de lipides entre les peroxysomes et le réticulum endoplasmique. Les peroxysomes sont des organites polyvalents très dynamiques : leur nombre, leur taille et leurs fonctions varient selon le contexte cellulaire. Ils sont impliqués dans de nombreuses voies métaboliques, comme la β-oxydation des acides gras à très longue chaîne (ceux comportant 22 atomes de carbone ou plus) ou la synthèse du cholestérol et des plasmalogènes
1
, et contribuent à l’équilibre redox de la cellule. Ils jouent également un rôle dans l’immunité innée antivirale. À ce titre, de nombreux virus perturbent le fonctionnement des peroxysomes dans les cellules qu’ils infectent et les détournent à leur avantage [
5
].
|
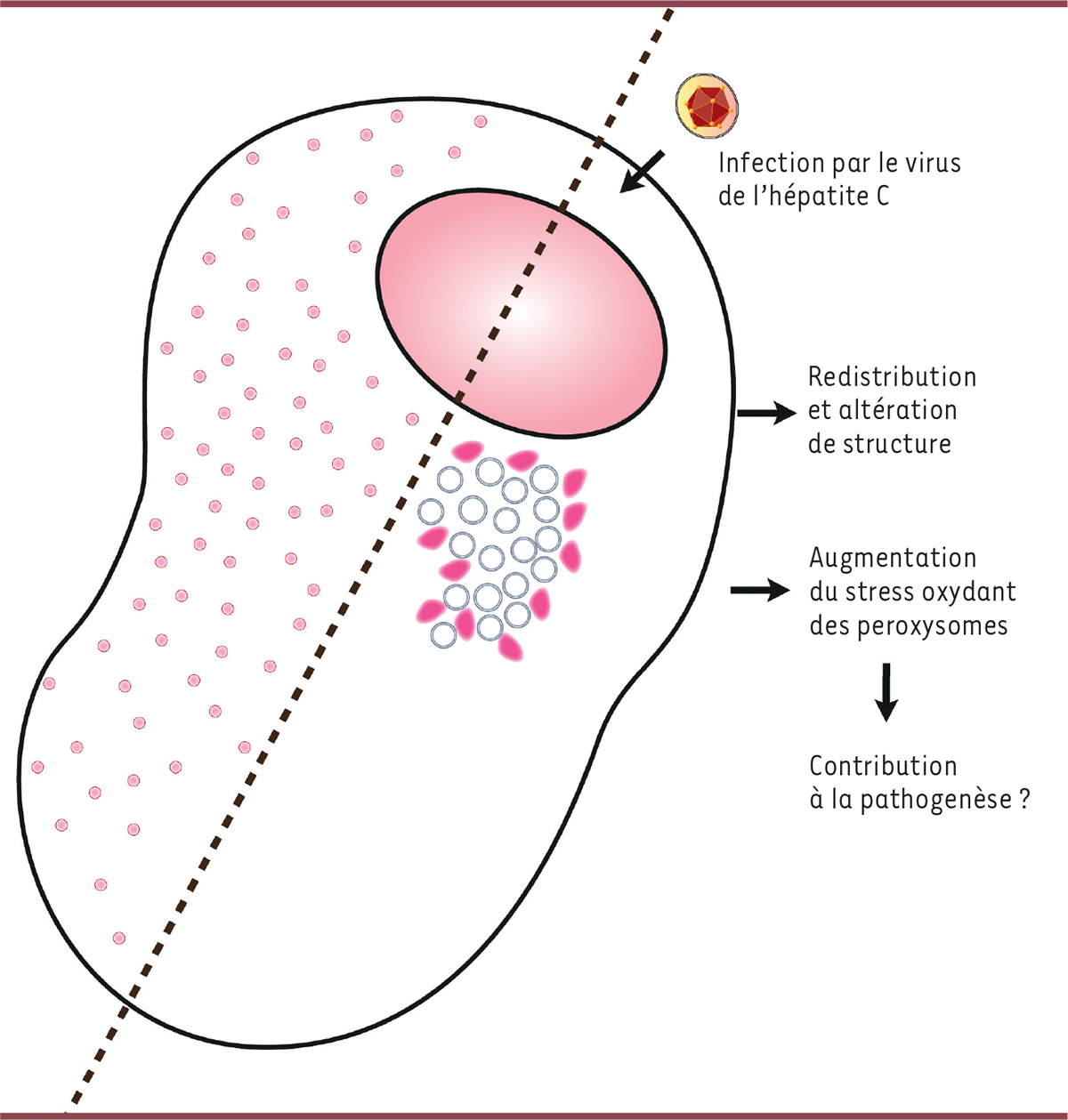
Le virus de l’hépatite C altère la structure et la localisation subcellulaire des peroxysomes
Nous avons mis en évidence une altération de la structure des peroxysomes dans des cellules Huh-7 exprimant un réplicon (
i.e.
, une version tronquée de l’ARN viral ne conservant que les séquences nécessaires et suffisantes à la réplication et ne conduisant pas à la formation de particules infectieuses) du virus de l’hépatite C, ainsi que dans des cellules Huh-7 infectées par le virus à partir de 7 jours post-infection. Dans environ un tiers de ces cellules infectées, le volume moyen des peroxysomes est multiplié par 2,4 après 16 jours d’infection (passant de 0,15 µm
3
à 0,35 µm
3
), tandis que le nombre moyen de peroxysomes par cellule est divisé par 2,8 (passant de 550 à 200-250). Une réduction du nombre de peroxysomes associée à une augmentation de leur taille a également été constatée dans des cellules contenant un réplicon, ce qui indique que ces changements sont directement liés à l’activité de réplication de l’ARN viral dans les cellules infectées. Par ailleurs, nous avons mis en évidence un recrutement partiel des peroxysomes à proximité des complexes de réplication du virus, sans que le mécanisme de cette relocalisation ait pu être identifié.
|
La suppression des peroxysomes ne modifie pas la production de particules virales
Nous avons ensuite cherché à déterminer le rôle des peroxysomes dans le cycle cellulaire du virus de l’hépatite C. Des lignées de cellules Huh-7 sans peroxysomes fonctionnels ou complètement dépourvues de ces organites ont été obtenues en inactivant respectivement, par la technique CRISPR-Cas9, le gène
PEX5
, impliqué dans l’import des protéines peroxysomiques matricielles, ou le gène
PEX3
, impliqué dans l’import des protéines de la membrane des peroxysomes et nécessaire à leur biogenèse. Ces lignées ont été infectées par le virus de l’hépatite C, et le titre infectieux du surnageant de culture des cellules infectées a été mesuré à différents temps post-infection. Étonnamment, l’absence de peroxysomes fonctionnels n’a eu aucun impact sur la production de particules infectieuses. Des mesures de la cinétique de réplication de l’ARN viral ont confirmé l’absence de rôle des peroxysomes dans la réplication virale.
|
Le virus de l’hépatite C altère le fonctionnement des peroxysomes
Nous avons tenté de déterminer si l’infection par le virus de l’hépatite C entraîne un dysfonctionnement de la β-oxydation dans les peroxysomes en analysant le profil en acides gras totaux de cellules Huh-7 exprimant un réplicon du virus, mais aucune accumulation d’acides gras à très longue chaîne, signant un dysfonctionnement, n’a pu être mise en évidence dans ce modèle, contrairement à ce qui avait été décrit auparavant dans un modèle infectieux [
6
]. En revanche, nous avons montré que la présence d’un réplicon perturbait le contrôle des espèces réactives de l’oxygène dans les peroxysomes. Nous avons mesuré le stress oxydant des mitochondries, du cytosol et des peroxysomes grâce à une sonde fluorescente « redox-sensible » adressée spécifiquement à chacun des trois compartiments cellulaires analysés. Cette sonde est constituée de la protéine roGFP2, qui se présente sous deux formes : une forme réduite, dont le spectre d’excitation par la lumière présente un unique pic d’excitation pour une longueur d’onde de 488 nm, et une forme oxydée, dont le spectre d’excitation présente deux pics d’excitation à 405 et 488 nm [
7
]. Ainsi, en excitant séquentiellement les cellules à 405 nm puis à 488 nm, il est possible de calculer le rapport des intensités de la fluorescence émise, ce qui permet une mesure relative du stress oxydant. Nous avons ainsi montré que la présence d’un réplicon dans les cellules Huh-7 induit une augmentation du stress oxydant dans les peroxysomes, mais pas dans les mitochondries, ni dans le cytosol. L’activité de la catalase, la principale enzyme responsable de la détoxification des espèces réactives de l’oxygène dans les peroxysomes, a été mesurée dans des cellules Huh-7 exprimant un réplicon de deux souches différentes, JFH1 (de génotype 2) et DBN3a (de génotype 3). Nous avons constaté une diminution de l’activité de la catalase dans les cellules exprimant le réplicon de souche DBN3a, sans diminution de l’expression de l’enzyme. Ainsi, la souche DBN3a du virus de l’hépatite C semble inhiber l’activité de la catalase, ce qui pourrait expliquer l’augmentation du stress oxydant des peroxysomes. Ces résultats sont d’autant plus intéressants si on considère le fait que l’infection par les souches de virus de l’hépatite C de génotype 3 induit plus de cancers du foie que les autres génotypes [
8
], et qu’une diminution de l’activité de la catalase a précédemment été mise en évidence dans les cellules constituantes d’un hépatocarcinome [
9
].
|
Nous avons montré que l’infection par le virus de l’hépatite C altère la structure et la localisation subcellulaire des peroxysomes, tout en perturbant le contrôle des espèces réactives de l’oxygène dans ces organites (
Figure 1
). Il conviendra de poursuivre ces recherches en utilisant un modèle d’infection chronique par le virus afin d’étudier les effets à long terme du stress oxydant des peroxysomes produit par l’infection. L’étude comparative de biopsies du foie de personnes chroniquement infectées par le virus de l’hépatite C et de personnes guéries de cette infection permettrait de déterminer si les atteintes des peroxysomes dues à l’infection sont réversibles, et pourrait contribuer, dans le futur, à améliorer le suivi des patients guéris d’une hépatite C chronique.
 | Figure 1.
Impact de l’infection par le virus de l’hépatite C sur les peroxysomes.
Les peroxysomes (repreìsenteìs par des points rouges) sont reìpartis dans le cytoplasme des cellules non infecteìes (partie gauche de la cellule). Après une infection par le virus de l’heìpatite C (partie droite de la cellule), leur nombre diminue, leur taille augmente, et ils sont souvent localiseìs à proximiteì des complexes de reìplication du virus. Ces changements s’accompagnent d’une augmentation du stress oxydant des peroxysomes, qui pourrait contribuer à la pathogenèse de l’infection chronique.
|
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ces travaux de recherche ont bénéficié d’un soutien financier de l’ANRS-MIE.
|
Footnotes |
1.
Aoyagi
H
,
Iijima
H
,
Gaber
ES
,
et al.
Hepatocellular organellar abnormalities following elimination of hepatitis C virus.
.
Liver Int
.
2023;
;
43
:
:1 677.
–
90
.
2.
Romero-Brey
I
,
Merz
A
,
Chiramel
A
,
et al.
Three-dimensional architecture and biogenesis of membrane structures associated with hepatitis C virus replication.
.
PLoS Pathog
.
2012;
;
8
:
:e1003056.
.
3.
Rhee
HW
,
Zou
P
,
Udeshi
ND
,
et al.
Proteomic mapping of mitochondria in living cells via spatially restricted enzymatic tagging.
.
Science
.
2013;
;
339
:
:1328.
–
1331
.
4.
Martin de Fourchambault
E
,
Callens
N
,
Saliou
JM
,
et al.
Hepatitis C virus alters the morphology and function of peroxisomes.
.
Front Microbiol
.
2023;
;
14
:
:1254728.
.
5.
Wanders
RJA
,
Baes
M
,
Ribeiro
D
,
et al.
The physiological functions of human peroxisomes.
.
Physiol Rev
.
2023;
;
103
:
:957.
–
1024
.
6.
Lupberger
J
,
Croonenborghs
T
,
Roca Suarez
AA
,
et al.
Combined analysis of metabolome, proteomes, and transcriptomes of HCV-infected cells and liver to identify pathways associated with disease development.
.
Gastroenterology
.
2019;
;
157
:
:537.
–
551
.
7.
Dooley
CT
,
Dore
TM
,
Hanson
GT
,
et al.
Imaging dynamic redox changes in mammalian cells with green fluorescent protein indicators.
.
J Biol Chem
.
2004;
;
279
:
:22284.
–
22293
.
8.
Leandro
G
,
Mangia
A
,
Hui
J
,
et al.
Relationship between steatosis, inflammation, and fibrosis in chronic hepatitis C: A meta-analysis of individual patient data.
.
Gastroenterology
.
2006;
;
130
:
:1636.
–
1642
.
9.
Litwin
JA
,
Beier
K
,
Völkl
A
,
et al.
Immunocytochemical investigation of catalase and peroxisomal lipid α-oxidation enzymes in human hepatocellular tumors and liver cirrhosis.
.
Virchows Arch
.
1999;
;
435
:
:486.
–
495
.
|