| |
| Med Sci (Paris). 40(3): 295–298. doi: 10.1051/medsci/2024017.La paléoneurologie Une science en évolution ? Emma Estrems Velazquez,1a Evaëlle Ferton,1b and Antony Colombo2,3c 1Master 2 Sciences du vivant, Parcours IMaGHE, Université Paris, Sciences et Lettres (PSL), École Pratique des Hautes Etudes (EPHE)
,
75014Paris
,
France 2UMR 6034 Archéosciences Bordeaux, Université Bordeaux Montaigne
,
33607Pessac
,
France 3EPHE-PSL Université
,
4-14 rue Ferrus
,
75014Paris
,
France |
L’actualité scientifique vue par les étudiants du Master 2 Sciences du Vivant de l’Université EPHE-PSL
Série coordonnée par Sophie Sibéril. |
La paléoneurologie : discipline, concepts et objectifs
La paléoneurologie est la science qui étudie l’évolution du cerveau des différentes espèces. Elle s’appuie sur l’analyse de moulages internes de la boîte crânienne, les endocastes. Bien que n’étant pas une réplique exacte du cerveau, ils sont la seule preuve directe de son évolution et aident à la compréhension des modifications anatomo-morphologiques sur le long terme. L’étude du cerveau humain tient une place de choix dans cette discipline à l’interface des neurosciences et des sciences de l’évolution. Son étude permet une meilleure compréhension de l’évolution des Hominidés, de la transformation de comportements individualistes aux comportements coopératifs, jusqu’au développement de la pensée symbolique [
1
].
Parmi les mammifères, les représentants de la lignée humaine, lignée évolutive conduisant à l’apparition du genre Homo et de l’espèce
Homo sapiens
, présentent les cerveaux les plus volumineux proportionnellement au volume du corps. Certains fossiles indiquent qu’une accélération de l’augmentation du volume cérébral se serait produite au cours des deux derniers millions d’années, de manière concomitante au développement ou à l’amélioration d’autres traits spécifiques à l’espèce humaine, tels que la bipédie, le mode alimentaire, le langage articulé élaboré ainsi que l’altricialité secondaire
1
[
2
].
Ainsi, différents paliers évolutifs du cerveau des Hominidés ont pu être définis en suivant son augmentation :
Sahelanthropus tchadensis
, premier représentant de notre lignée (7 Ma, ~ 370 cm
3
) ; les Australopithèques (4,2-2 Ma, 400-550 cm
3
) ;
Homo erectus
(
sensu lato
, 1,9-0,2 Ma, 550-1 250 cm
3
) ; les Néanderthaliens (430-30 ka, ~ 1 600 cm
3
) et
Homo sapiens
(300 ka - aujourd’hui, ~ 1 350 cm
3
). De plus, de nombreux changements autres que morphologiques ont été proposés. Des australopithèques à
Homo erectus
, une augmentation du nombre de neurones au cours du neurodéveloppement se serait accompagnée d’un accroissement de l’irrigation des tissus cérébraux et des fonctions métaboliques [
1
]. Ce changement dans le modèle d’histoire de vie serait lié aux besoins énergétiques grandissant d’un cerveau toujours plus gros.
Homo erectus
a connu une réorganisation de son lobe frontal, entrainant une réduction du cortex visuel et le développement des aires de Brodmann (aire motrice primaire) et de Broca (traitement du langage) [
3
]. Ces changements auraient alors mené à une modification des moyens de communication et à des premières formes ancestrales de langage. Enfin, les Néanderthaliens et
Homo sapiens
ont acquis une phase supplémentaire de développement postnatale. Elle se caractérise par un élagage synaptique et permet une myélinisation des neurones qui améliore la connectivité neuronale [
4
,
5
].
L’ensemble montre que les Hominidés présentent une certaine plasticité cérébrale, probablement en relation avec la sélection naturelle. Elle a conduit à l’élaboration de tâches cognitives et à l’émergence de comportements plus complexes, comme le développement de la pensée symbolique [
1
].
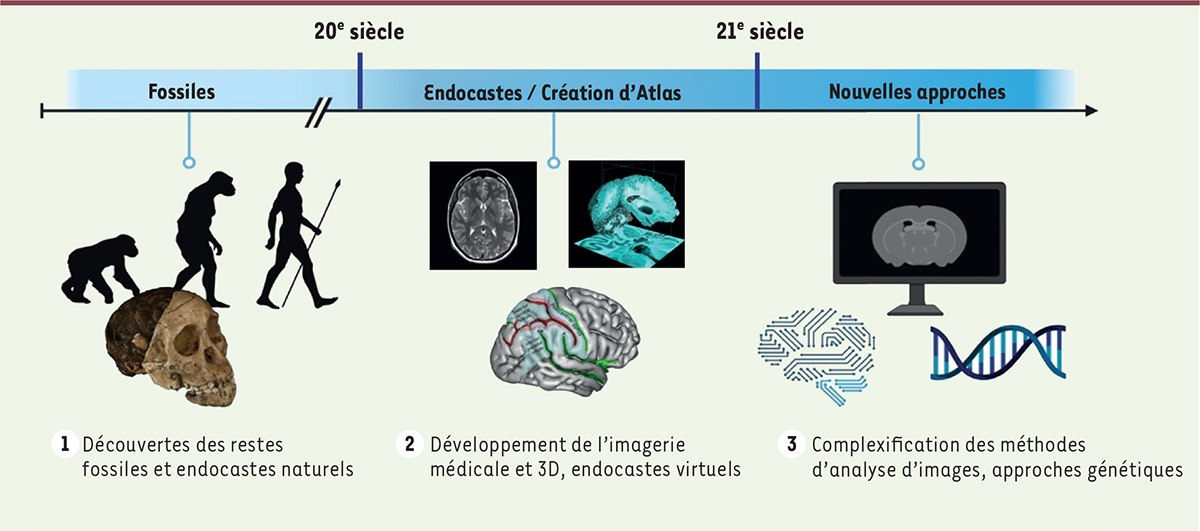
 | Figure 1.
Schéma représentatif des progrès techniques en paléoneurologie pour étudier l’évolution du cerveau humain. (1)
Découverte et observations des restes fossilisés et des endocastes naturels ;
(2)
Perfectionnement des techniques de moulage, développement de l’imagerie médicale (tomodensitométrie et imagerie par résonnance magnétique – IRM) et de la 3D, études d’endocastes virtuels et création d’atlas permettant la cartographie des aires cérébrales
(3)
Complexification des méthodes d’analyse d’imagerie et élaboration de nouvelles approches génomiques et génération de « mini-cerveaux » (organoïdes) pour comprendre le développement du cerveau au cours de l’évolution.
|
|
Méthodes d’étude des cerveaux fossiles
Les premières études portant sur l’évolution du cerveau se sont limitées à la mesure de l’accroissement de la taille de celui-ci (
e.g.
la mesure du volume d’eau déplacé après immersion de l’endocaste) et au calcul du quotient d’encéphalisation (rapport entre le volume cérébral mesuré et le volume attendu pour un animal d’une taille donnée [
3
]). Au cours du
xx
e
siècle, les études anatomiques se sont intéressées aux endocastes naturels (
i.e.
accumulation de sédiments et fossilisation) ou artificiels (
e.g.
moulage au plâtre, caoutchouc - [
3
]) afin d’analyser la morphologie endocrânienne des Hominidés [
6
].
Depuis la fin du
xx
e
siècle, le développement de la tomographie médicale et les innovations informatiques et statistiques pour l’analyse morphométrique en 3 dimensions (3D) d’endocastes virtuels, ont permis de faire progresser la compréhension de l’évolution cérébrale. Ces approches non invasives et non destructives permettent de corriger de manière virtuelle les déformations et de reconstruire les fossiles incomplets tout en favorisant l’échange de données et la fiabilité des analyses [
6
]. L’essor de ces techniques a permis une nouvelle évaluation de certains fossiles [
7
], la création d’atlas 3D du cerveau humain [
8
] qui est devenu une référence pour l’étude d’endocastes fossiles [
9
] et l’approfondissement des connaissances sur les modifications des aires cérébrales [
10
].
Aujourd’hui, en paléoanthropologie, les endocastes virtuels obtenus par imagerie médicale (généralement par tomographie à rayon X –
computed tomography
) sont reconstruits en 3D et majoritairement analysés par morphométrie géométrique (MG). Cette méthode, grâce à des repères morphologiques homologues entre les endocastes comparés, permet l’analyse des modifications de forme en élimant le biais lié à taille qui pourrait être le facteur explicatif principal en cas d’augmentation de volume par exemple [
11
]. Les sillons (dépressions linéaires, aussi appelées
sulci
) à la surface du cortex cérébral sont des bons repères pour caractériser les différences de structure cérébrales comme la modification de la répartition des aires entre espèces fossiles (puisqu’elles se marquent sur l’endocaste) mais également entre les spécimens d’une même espèce [
5
,
12
].
En neurosciences, la comparaison entre deux spécimens se fait généralement par l’utilisation d’un atlas, représentation moyenne (« cerveau probabiliste ») population-dépendante du cerveau, qui sert de référence. Ils sont obtenus selon trois méthodes principales : la «
label-based approach
» consiste à segmenter des sous-volumes, après cartographie des ensembles individuels dans un repère stéréotaxique (positionnement précis grâce à des coordonnées 3D), pour construire une carte de probabilité ; la «
density-based approach
» s’appuie sur un large jeu d’examens médicaux (IRM ou CT) en moyennant les niveaux de gris de chaque voxel (équivalent 3D du pixel pour une image 2D) homologue ; la «
deformation-based approach
» permet à partir d’une image de référence, de déformer une image observée pour un meilleur ajustement lors de l’analyse morphométrique des endocastes [
13
].
Que ce soit en neuroanatomie ou en paléoanthropologie, aucune méthode ne fait encore consensus [
6
]. Jager
et al
[
14
], en reprenant la «
density-based approach
», ont réalisé, pour la première fois, à partir de vingt endocastes virtuels de crânes humains modernes (collection ostéologique de Pretoria, individus adultes), une carte de densité propre à chaque sillon et non plus pour le cerveau dans sa globalité. Ce changement d’échelle permet de proposer une meilleure prise en compte de la variabilité intraspécifique et vise à améliorer l’interprétation des fossiles en limitant les confusions dans l’identification des sillons.
|
Comprendre l’évolution du cerveau, au-delà de l’imagerie…
Le caractère incomplet ou déformé de certains fossiles est un facteur limitant qui a été réduit grâce à l’imagerie médicale 3D. L’accès aux modèles virtuels couplés à des méthodes computationnelles complexes a permis de proposer des solutions pour améliorer l’étude des endocastes. Pourtant, ces nouvelles techniques peuvent être accompagnées d’approximations voire produire des résultats contradictoires [
6
]. À ce jour, même avec les endocastes virtuels les plus précis possibles, seule une approximation de la surface du cerveau est possible. Néanmoins, ces endocastes représentent un instant T dans l’histoire évolutive ayant pu mener au cerveau d’
Homo sapiens
et restent l’approche la plus directe pour identifier et interpréter les modifications du cerveau au cours de l’évolution [
3
].
Aborder l’évolution par l’anatomie comparée peut être limitée, chaque espèce actuelle représentant le produit final de sa propre lignée évolutive. Or, pour comprendre les bases neurologiques de traits comportementaux ou fonctions métaboliques de l’Homme, il est nécessaire de comparer l’entièreté des structures de son volume cérébral avec celles des autres primates avec qui il a des différences morphologiques et comportementales prononcées, malgré la proximité génétique [
15
].
La génétique pourrait être la prochaine étape méthodologique dans la compréhension de l’évolution du cerveau humain. Elle permettrait d’analyser d’un point de vue évolutif l’expression de certains gènes, comme les gènes FOXP2 (
Forkhead box P2
) impliqué dans la parole [
16
] et UBR4 (
ubiquitin protein ligase E3 component n-Recognin 4
) impliqué dans la neurogénèse [
17
]. De nouvelles approches comme l’analyse d’association pangénomique, s’appuyant sur les corrélations aux traits phénotypiques de nombreuses variations génétiques pour un échantillon important d’individus, permettrait de comprendre s’il existe des variants génétiques spécifiques au développement du cortex cerébral [
18
]. De même, la création d’organoïdes cérébraux permettrait d’analyser les différences neurodéveloppementales entre l’Homme et les primates non humains [
19
]. À ce jour, l’évolution du cerveau reste une question d’anatomie et le lien entre l’évolution des capacités cognitives et l’émergence d’un « cerveau culturel » reste toujours inconnu.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Hublin
JJ
,
Changeux
JP
.
Paleoanthropology of cognition: an overview on Hominins brain evolution.
.
C R Biol
.
2022;
;
345
:
:57.
–
75
.
2.
Holloway
RL
.
The Human Brain Evolving: A Personal Retrospective.
.
Annu Rev Anthropol
.
2008;
;
37
:
:1.
–
19
.
3.
Holloway
RL
,
Sherwood
CC
,
Hof
PR
,
et al.
Binder
MD
,
Hirokawa
N
,
Windhorst
U
.
Evolution of the Brain in Humans – Paleoneurology.
.
Encyclopedia of Neuroscience
.
.
Berlin, Heidelberg;
:
Springer, Berlin Heidelberg:
,
2009
:pp.
:1326.
–
1334
.
4.
Bruner
E
,
Holloway
RL
.
A bivariate approach to the widening of the frontal lobes in the genus Homo.
.
J Hum Evol
.
2010;
;
58
:
:138.
–
146
.
5.
Zollikofer
CPE
,
Bienvenu
T
,
Beyene
Y
,
et al
.
Endocranial ontogeny and evolution in early Homo sapiens : The evidence from Herto, Ethiopia.
.
Proc Natl Acad Sci USA
.
2022;
;
119
:
:e2123553119.
.
6.
Bruner
E.
Human paleoneurology: Shaping cortical evolution in fossil hominids.
.
J Comp Neurol
.
2019;
;
527
:
:1753.
–
1765
.
7.
Neubauer
S
,
Gunz
P
,
Leakey
L
,
et al.
Reconstruction, endocranial form and taxonomic affinity of the early Homo calvaria KNM-ER 42700.
.
J Hum Evol
.
2018;
;
121
:
:25.
–
39
.
8.
Peña-Melián
A
,
Rosas
A
,
García-Tabernero
A
,
et al.
Paleoneurology of Two New Neandertal Occipitals from El Sidrón (Asturias, Spain) in the Context of Homo Endocranial Evolution.
.
Anat Rec Adv Integr Anat Evol Biol
.
2011;
;
294
:
:1370.
–
1381
.
9.
Dumoncel
J
,
Subsol
G
,
Durrleman
S
,
et al
.
Are endocasts reliable proxies for brains? A 3D quantitative comparison of the extant human brain and endocast.
.
J Anat
.
2021;
;
238
:
:480.
–
8
.
10.
Coqueugniot
H
,
Dutour
O
,
Arensburg
B
,
et al.
Earliest Cranio-Encephalic Trauma from the Levantine Middle Palaeolithic: 3D Reappraisal of the Qafzeh 11 Skull, Consequences of Pediatric Brain Damage on Individual Life Condition and Social Care.
.
PLoS ONE
.
2014;
;
9
:
:e102822.
.
11.
Bookstein
FL
.
A statistical method for biological shape comparisons.
.
J Theor Biol
.
1984;
;
107
:
:475.
–
520
.
12.
Liuti
T
,
Dixon
PM
.
The use of the geometric morphometric method to illustrate shape difference in the skulls of different-aged horses.
.
Vet Res Commun
.
2020;
;
44
:
:137.
–
45
.
13.
Toga
AW
,
Thompson
PM
.
Maps of the Brain.
.
Anat Rec
.
2001;
;
265
:
:37.
–
53
.
14.
de Jager
EJ
,
Risser
L
,
Mescam
M
,
et al
.
Sulci 3D mapping from human cranial endocasts: A powerful tool to study hominin brain evolution.
.
Hum Brain Mapp
.
2022;
;
43
:
:4433.
–
43
.
15.
Sherwood
CC
,
Broadfield
DC
,
Holloway
RL
,
et al
.
Variability of Broca’s area homologue in African great apes: Implications for language evolution.
.
Anat Rec
.
2003;
;
271A
:
:276.
–
85
.
16.
Nudel
R
,
Newbury
DF
.
FOXP2.
.
Wires Cogn Sci
.
2013;
;
4
:
:547.
–
560
.
17.
Gunz
P
,
Tilot
AK
,
Wittfeld
K
,
et al.
Neandertal Introgression Sheds Light on Modern Human Endocranial Globularity.
.
Curr Biol
.
2019;
;
29
:
:120.
–
7.e5
.
18.
Grasby
KL
,
Jahanshad
N
,
Painter
JN
,
et al
.
The genetic architecture of the human cerebral cortex.
.
Science
.
2020;
;
367
:
:eaay6690.
.
19.
Pollen
AA
,
Bhaduri
A
,
Andrews
MG
,
et al.
Establishing Cerebral Organoids as Models of Human-Specific Brain Evolution.
.
Cell
.
2019;
;
176
:
:743.
–
56.e17
.
|