| |
| Med Sci (Paris). 40(3): 245–247. doi: 10.1051/medsci/2024006.Défaut d’architecture cellulaire et auto-immunité Le déficit en DOCK11 Frédéric Rieux-Laucat,1* Laure Delage,1 and Charlotte Boussard1 1Université Paris Cité, Institut Imagine, Laboratoire d’immunogénétique des maladies auto-immunes pédiatriques, Inserm UMR 1163
,
Paris
,
France MeSH keywords: Humains, Auto-immunité, Lymphocytes B, Déficits immunitaires |
Les maladies génétiques du cytosquelette d’actine (ou actinopathies) sont à l’origine de déficits immunitaires héréditaires [
1
]. Le remodelage du cytosquelette joue un rôle crucial dans l’adhérence et la motilité cellulaire. Les Rho-GTPases, comme RAC, CDC42 et RHO, sont des acteurs clés de la réorganisation de l’actine (
Figure 1
) [
2
]. Elles sont activées par des facteurs d’échange de nucléotides guanyliques, tels que les membres de la famille des DOCK (
dedicator of cytokinesis
). Des mutations bi-alléliques de
DOCK2
entraînent une lymphopénie T et des infections bactériennes invasives et virales graves, qui débutent tôt dans la vie [
3
]. Les mutations de
DOCK8
conduisent à un défaut de migration des lymphocytes dans les tissus, associé à des infections muco-cutanées bactériennes, virales et fongiques, ainsi qu’à l’eczéma et à des allergies sévères [
4
]. L’implication de
DOCK11
dans des déficits immunitaires, quant à elle, est soupçonnée depuis longtemps, mais elle n’a pu être prouvée que récemment [
5
].
 | Figure 1.
Illustration du rôle de DOCK11 dans la polymérisation de l’actine et de la régulation de FOXP3 par les lymphocytes T régulateurs.
En l’absence de la protéine DOCK11 fonctionnelle (matérialisée par les croix rouges), on constate une activité altérée de CDC42 avec un potentiel impact sur l’activité de RhoA, une réorganisation anormale de l’actine, la formation de protrusions aberrantes, mais également une dérégulation de la voie interleukine 2 (IL-2)-STAT5B dans les lymphocytes T régulateurs, avec une expression anormalement réduite de
FOXP3
. (Figure réalisée avec le logiciel Biorender).
|
|
Identification de mutations de
DOCK11
associées à l’auto-immunité
En analysant la séquence nucléotidique de tous les exons du génome (exome) chez des enfants atteints de maladies auto-immunes variées, telles que les cytopénies (destruction accélérée des plaquettes sanguines ou des globules rouges induite par la présence d’auto-anticorps), le lupus érythémateux systémique, ou les maladies spécifiques d’organe (endocrinopathies, entéropathies, hépatites auto-immunes), nous avons identifié sept mutations de
DOCK11
, chez huit garçons atteints de cytopénie auto-immune, de lupus, ou d’entéropathie auto-immune à début précoce [
5
].
DOCK11
est localisé sur le chromosome X, et ces garçons sont donc hémizygotes pour la mutation identifiée. Nous avons montré une réduction de l’expression de
DOCK11
dans leurs lymphocytes, en faveur du rôle pathogénique de ces mutations. Celles-ci affectent des acides aminés qui peuvent être impliqués dans le repliement de la protéine ou avoir un impact direct sur les interactions avec ses partenaires de liaison. Contrairement aux déficits en DOCK2 ou DOCK8, aucun de ces enfants n’avait présenté d’infections récurrentes ou sévères, d’allergies, ou de saignements anormaux.
|
Les mutations de
DOCK11
affectent les thrombocytes
Les thrombocytes (ou plaquettes sanguines) proviennent de la fragmentation du cytoplasme des mégacaryocytes par un processus impliquant le remodelage du cytosquelette. Nous avons étudié les plaquettes des patients, dans lesquelles l’expression de
DOCK11
était également diminuée. Leur nombre et leur taille étaient normaux, mais un défaut d’activation de l’intégrine αIIbβ3 indiquait l’existence d’une thrombopathie fonctionnelle. Après leur adhérence sur différents supports matriciels, l’analyse morphologique a montré une proportion anormalement élevée de plaquettes avec lamellipodes ou étalement complet. Ces modifications morphologiques constatées
in vitro
n’ont apparemment pas de conséquence sur l’hémostase
in vivo
.
DOCK11 étant un facteur d’échange de nucléotides guanyliques qui active CDC42, nous avons analysé l’activité de cette protéine dans les plaquettes des patients, après leur activation par la thrombine, en utilisant la technique « G-LISA » (qui mesure la concentration de GTP et donc de CDC42 activée). Cette activité était anormalement faible pour tous les patients testés, ce qui explique la fréquence moindre des filopodes lors de l’adhérence de leurs plaquettes à un support matriciel, et confirme que les mutations de
DOCK11
entraînent une perte de fonction de la protéine DOCK11. La prédominance des lamellipodes ou l’étalement complet des plaquettes après adhérence au support suggère l’existence d’un déséquilibre de la balance physiologique entre l’activité CDC42 et celle de RHOA dans les plaquettes des patients, ce que nous avons pu confirmer chez deux d’entre eux (
Figure 1
).
|
Les mutations de
DOCK11
affectent la migration lymphocytaire et la polarisation du cytosquelette d’actine
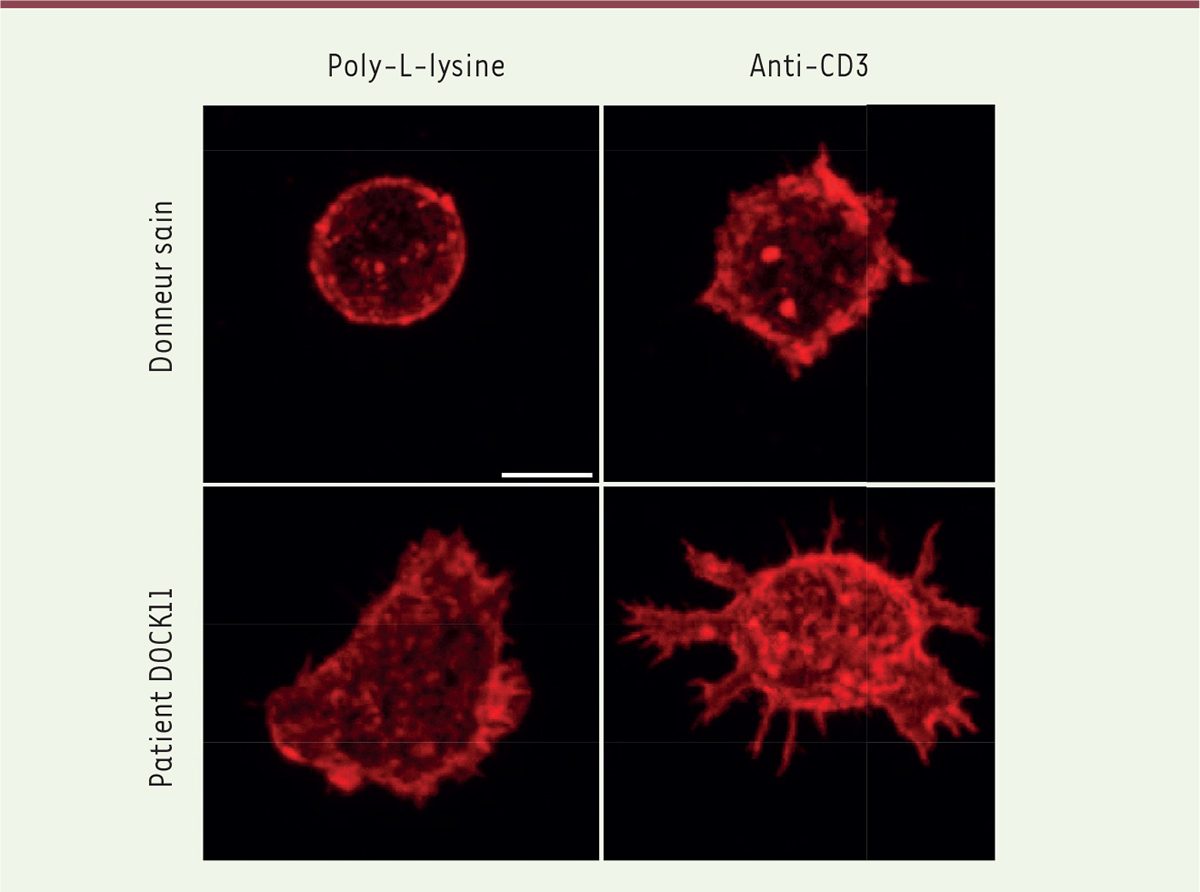
Lorsque les lymphocytes T entrent en contact avec une autre cellule, ils se déforment pour augmenter la surface de contact. Ce processus peut-être mimé expérimentalement en déposant des lymphocytes T sur des lamelles recouvertes d’anticorps stimulant le récepteur de l’antigène (TCR-CD3) et son co-récepteur principal (CD28), ce qui induit un signal d’activation des lymphocytes conduisant à leur étalement. Dans cette expérience, les lymphocytes T des patients présentaient une circularité réduite, une surface d’étalement accrue, et un plus grand nombre de protrusions (
Figure 2
). Afin de vérifier que le déficit de DOCK11 est à l’origine de ces anomalies, nous avons éteint partiellement l’expression du gène
DOCK11
, par la technique d’interférence ARN (
short hairpin RNA
, shRNA), dans des cellules dendritiques dérivées de monocytes provenant d’individus donneurs sains : la présence de protrusions plus grandes et plus proéminentes, reproduisant le phénotype lymphocytaire des patients, a confirmé que ce phénotype résulte du déficit en DOCK11.
 | Figure 2.
Anomalies morphologiques des lymphocytes T, après étalement sur lame de verre, chez les patients porteurs d’une mutation de DOCK11.
Les lames ont été recouvertes soit de poly-L-lysine seule (condition « non activée »), soit de poly-L-lysine et d’anticorps anti-CD28 et anti-CD3 (condition « activée »). Barre d’échelle : 5 μm.
|
Le remodelage du cytosquelette d’actine joue un rôle essentiel dans la migration des lymphocytes, qui doivent se déformer pour patrouiller dans tous les tissus. Grâce à un système de migration spontanée de ces cellules dans des micro-capillaires, nous avons montré que la vitesse de migration des lymphocytes des patients est supérieure à celle des lymphocytes de donneurs sains. La motilité des lymphocytes dans les micro-canaux dépend de l’équilibre de la polymérisation de l’actine à l’avant (reflétant l’activité de CDC42) et à l’arrière (reflétant l’activité de RHOA) de la cellule. Le déficit de DOCK11 et l’activation réduite de CDC42 qui en résulte entraînent un défaut de nucléation de l’actine à l’avant de la cellule, déplaçant alors la polymérisation vers l’arrière, ce qui permet au lymphocyte de se déplacer plus rapidement. DOCK11 joue donc un rôle essentiel dans le contrôle dynamique du cytosquelette d’actine et de la migration des leucocytes dans des conditions de confinement. Les conséquences physiopathologiques de ces anomalies constatées
in vitro
restent cependant à déterminer.
|
Le déficit en DOCK11 entraîne un dysfonctionnement des lymphocytes T régulateurs et l’activation de STAT5B dans les lymphocytes
Un immunophénotypage réalisé sur le sang des patients a révélé une proportion accrue de lymphocytes B CD21
low
et transitionnels, connus pour inclure des lymphocytes B auto-réactifs. Des concentrations plasmatiques élevées de facteurs de croissance des lymphocytes B, tels que APRIL (
A proliferation-inducing ligand
), de BAFF (
B-cell activating factor
), et de cytokines inflammatoires, ont été constatées chez la plupart des patients. Le déficit en DOCK11 favorise donc l’enrichissement ou la survie de lymphocytes B auto-réactifs, un résultat cohérent avec la détection d’auto-anticorps chez les patients. Les lymphocytes T régulateurs tiennent une place centrale dans le contrôle des lymphocytes B et T auto-réactifs. Des mutations de
FOXP3
, qui code un facteur de transcription essentiel au développement et à la fonction des lymphocytes T régulateurs, entraînent d’ailleurs une maladie auto-immune très sévère affectant principalement l’intestin et les glandes endocrines (syndrome IPEX, pour
immunedysregulation, polyendocrinopathy, ectodermal dysplasia X-linked
) [
6
]. Or, les lymphocytes T régulateurs des enfants chez lesquels nous avons identifié les mutations de
DOCK11
ont une expression réduite de
FOXP3
. L’interleukine 2, facteur de croissance principal de ces lymphocytes, induit l’expression de STAT5B, un facteur de transcription essentiel pour une expression soutenue de
FOXP3
, et nous avons montré une expression réduite de
STAT5B
dans les lymphocytes T des patients après stimulation par l’interleukine 2. Ces résultats indiquent que le déficit en DOCK11 perturbe la production de FOXP3 dans les lymphocytes T régulateurs, et est associé à une altération de la voie de signalisation interleukine 2-STAT5B (
Figure 1
).
|
Variabilité d’expression clinique du déficit en DOCK11
Nous avons mis en évidence le déficit en DOCK11 chez des enfants atteints de diverses maladies auto-immunes. Étonnamment, des déficits en DOCK11 ont depuis été identifiés chez des personnes qui présentent un syndrome inflammatoire sévère et une anémie [
7
]. Le mécanisme des anomalies constatées chez ces personnes reste à étudier pour savoir si elles sont en rapport avec le rôle de DOCK11 dans le remodelage du cytosquelette, ou avec une autre fonction de la protéine non encore identifiée. L’ensemble de ces découvertes indique que le déficit en DOCK11 prédispose à une dérégulation de la réponse immunitaire, et suggère que des modificateurs génétiques, épigénétiques ou environnementaux pourraient orienter cette dérégulation vers une maladie auto-immune ou vers une maladie inflammatoire.
|
L.D. est employée par Sanofi, France, et peut détenir des actions dans l’entreprise. F.R.-L. et C.B. déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions les patients et leurs familles pour leur participation à cette étude, ainsi que les cliniciens et le personnel hospitalier qui les ont pris en charge. Les travaux de recherche ont bénéficié du soutien de l’Inserm, du programme « Investissements d’avenir » de l’Agence nationale de la recherche (Institut hospitalo-universitaire Imagine : ANR-10-IAHU-01 ; Recherche hospitalo-universitaire : ANR-18-RHUS-0010), et de subventions de l’Agence nationale de la recherche (ANR-14-CE14-0026-01 Lumugene ; ANR-18-CE17-0001 Action ; ANR-22-CE15-0047-02 « BREAK-ITP », ANR-23-CE17-0022 « Actidock »), et de la Fondation pour la recherche médicale (Équipe FRM EQU202103012670). Les auteurs remercient le Centre de référence des déficits immunitaires héréditaires (CEREDIH) et le Centre de référence des cytopénies auto-immunes de l’enfant (CEREVANCE), qui ont permis le recrutement de patients dans les cohortes OBS’CEREVANCE et ACTION. C.B. a bénéficié d’un poste d’accueil de l’Inserm, et L.D., d’un financement Imagine thesis award.
|
1.
Kamnev
A
,
Lacouture
C
,
Fusaro
M
,
Dupré
L
.
Molecular tuning of actin dynamics in leukocyte migration as revealed by immune-related actinopathies.
.
Front Immunol
.
2021;
;
12
:
(750)
:537.
.
2.
Hodge
RG
,
Ridley
AJ
.
Regulating Rho GTPases and their regulators.
.
Nat Rev Mol Cell Biol
.
2016;
;
17
:
:496.
–
510
.
3.
Dobbs
K
,
Domínguez Conde
C
,
Zhang
SY
,
et al.
Inherited DOCK2 deficiency in patients with early-onset invasive infections.
.
N Engl J Med
.
2015;
;
372
:
(2)
:409.
–
422
.
4.
Engelhardt
KR
,
Gertz
ME
,
Keles
S
,
et al.
The extended clinical phenotype of 64 patients with dedicator of cytokinesis 8 deficiency.
.
J Allergy Clin Immunol
.
2015;
;
136
:
:402.
–
412
.
5.
Boussard
C
,
Delage
L
,
Gajardo
T
,
et al
.
DOCK11 deficiency in patients with X-linked actinopathy and autoimmunity.
.
Blood
.
2023;
;
141
:
:2 713.
–
26
.
6.
Park
JH
,
Lee
KH
,
Jeon
B
,
et al
.
Immune dysregulation, polyendocrinopathy, enteropathy, X-linked (IPEX) syndrome : a systematic review.
.
Autoimmun Rev
.
2020;
;
19
:
:102.
526
.
7.
Block
J
,
Rashkova
C
,
Castanon
I
,
et al
.
Systemic inflammation and normocytic anemia in DOCK11 deficiency.
.
N Engl J Med
.
2023;
;
389
:
:527.
–
39
.
|