| |
| Med Sci (Paris). 40(3): 238–241. doi: 10.1051/medsci/2024004.
Dmrt1
, un gène majeurde la détermination testiculaire et de la fertilité dans les deux sexes chez le lapin
Émilie Dujardin,1,2 Maëlle Pannetier,1,2 and Éric Pailhoux1,2* 1Université Paris-Saclay, Université de Versailles Saint-Quentin-en-Yvelines, INRAE, Biologie de la reproduction, environnement, épigénétique, et développement (BREED)
,
Jouy-en-Josas
,
France 2École nationale vétérinaire d’Alfort, BREED
,
Maisons-Alfort
,
France MeSH keywords: Animaux, Lapins, Mâle, Femelle, Testicule, Fécondité, Régulation de l'expression des gènes au cours du développement, génétique |
DMRT1, le déterminant testiculaire le plus conservé au cours de l’évolution des espèces
Le gène
Dmrt1
(
doublesex and mab-3-related transcription factor 1
) code un facteur de transcription, DMRT1, dont la fonction dans la différenciation testiculaire a été conservée au cours de l’évolution des espèces [
1
]. Après les descriptions initiales chez la mouche drosophile (gène
doublesex
) et le ver
Caenorhabditis elegans
(gène
mab-3
), on a montré que DMRT1 est le déterminant testiculaire chez le poulet, et donc vraisemblablement chez la plupart des oiseaux.
Dmrt1
est localisé sur le chromosome sexuel Z du poulet, et il est requis en double exemplaire (ZZ) pour déclencher la différenciation des gonades en testicules [
2
]
1
. Des duplications de
Dmrt1
ont par ailleurs été décrites dans deux espèces de poisson (
Oryzias latipes
et
Oryzias curvinotus
), où sa copie sur le chromosome Y devient le déterminant testiculaire (
dmrt1bY
ou
dmY)
[
3
], et, chez un amphibien (
Xenopus laevis
), un mutant dominant négatif, localisé sur le chromosome W (
DM-W
), devient le déterminant ovarien de cette espèce [
4
].
Dmrt1
est également le gène cible des mécanismes épigénétiques déclenchés par la température d’incubation des œufs, qui est à l’origine de la détermination du sexe chez la tortue
Trachemys scripta elegans
[
5
].
Chez les mammifères, où le déterminant testiculaire est le gène
Sry
(
sex-determining region of the Y chromosome
), le rôle de
Dmrt1
restait difficile à évaluer du fait de résultats contradictoires selon l’espèce considérée. En effet, l’ablation de
Dmrt1
chez la souris entraîne une infertilité et un dysfonctionnement de la spermatogénèse chez le mâle [
1
], alors que dans l’espèce humaine, plusieurs mutations de
DMRT1
ont été associées à des inversions de sexe chez des femmes de caryotype 46, XY [
6
]. Dans notre espèce,
DMRT1
aurait donc conservé un rôle dans la détermination testiculaire.
|
Dmrt1
, le gène responsable de la différenciation testiculaire chez les chèvres XX mâles
Les résultats de nos travaux sur la mutation « sans cornes » chez la chèvre ont montré que la perte de fonction du gène pro-ovarien
Foxl2
(
Forkhead family box L2
) conduit à une différenciation des crêtes génitales en testicules chez les animaux XX, malgré l’absence du gène
Sry
[
7
,
8
]. Dans les gonades XX encore indifférenciées de ces chèvres, l’inactivation de
Foxl2
induit : 1) une surexpression du gène
Dmrt1
, suivie par l’activation du gène pro-testiculaire
Sox9
(
SRY-box transcription factor 9
), conduisant à la différenciation en testicules, et 2) une « inversion » de la stéroïdogenèse fœtale, caractérisée par le remplacement de la production d’œstrogènes par celle d’androgènes de type mâle [
9
]. Afin d’élucider les rôles respectifs de ces deux conséquences de l’inactivation de
Foxl2
dans la différenciation gonadique anormale des chèvres mâles XX, nous avons réalisé chez le lapin (un lagomorphe que nous avons choisi comme modèle de mammifère non rongeur) : d’une part, l’invalidation du gène
Cyp19a1
codant l’enzyme P450 aromatase à l’origine de la production d’œstrogènes, et d’autre part, l’invalidation du gène
Dmrt1
. L’absence d’œstrogènes ovariens fœtaux chez les lapins mutants privés de l’aromatase diminue considérablement la formation des nids ovigères, puis le nombre de follicules primordiaux (réserve d’ovocytes), et conduit à une infertilité des femelles. Néanmoins, ces stéroïdes ne semblent pas impliqués dans le processus d’inversion sexuelle de type mâle XX [
10
]. Inversement, l’invalidation du gène
Dmrt1
a révélé son rôle primordial dans la différenciation testiculaire chez le lapin [
11
].
|
Dmrt1
est exprimé dans les gonades des deux sexes et dans différents types cellulaires
Nous avons d’abord caractérisé les étapes précoces de la différenciation gonadique normale chez le lapin, notamment l’expression des principaux gènes impliqués, dont
Dmrt1
(
Figure 1
) [
11
]. Étonnamment, l’expression de
Dmrt1
débute dès les premiers stades de la formation des crêtes génitales, à 12 jours
post-coïtum
(j
pc
), dans les deux sexes. Chez les mâles, elle suit de quelques heures (24 heures au maximum) celle du gène
Sry
. Cette expression précoce de
Dmrt1
concerne uniquement les cellules somatiques des gonades dans les deux sexes. Elle va progressivement concerner de plus en plus de cellules, jusqu’à ce que toutes les cellules somatiques expriment ce gène à 15 j
pc
(
Figure 1
).
Sox9
, quant à lui, n’est exprimé qu’à partir de 14 j
pc
, chez le lapin mâle, dans les cellules somatiques médullaires du futur testicule qui co-expriment
Dmrt1
et
Sry
. Ensuite, vers 20 j
pc
, l’expression de
Dmrt1
débutera dans les cellules germinales des deux sexes (
Figure 2A
) et s’éteindra dans les cellules somatiques des futurs ovaires.
Dmrt1
restera exprimé dans les cellules de Sertoli
2
et les spermatogonies des testicules pendant toute la vie des lapins mâles, tandis que chez les femelles, son expression dans les cellules germinales des ovaires s’éteindra complètement lors de la prophase I de la méiose, qui a lieu entre 3 et 15 jours après la naissance chez la lapine (
Figure 1
).
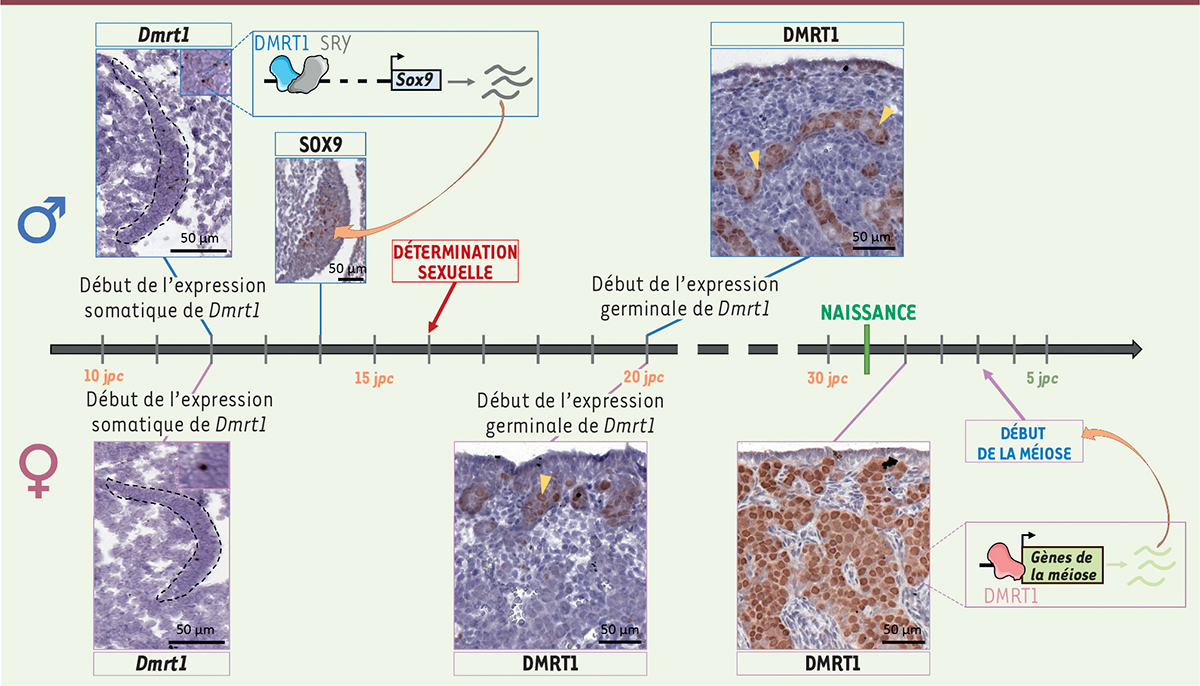
 | Figure 1.
Immunodétection de DMRT1 et schéma de ses différents rôles au cours de la différenciation gonadique chez le lapin.
L’expression de
Dmrt1
débute dans les cellules somatiques des futures gonades (crêtes génitales, entourées par un trait pointillé noir) des lapins des deux sexes dès 12 jours de développement embryonnaire (jours
post coïtum
, j
pc
). Chez le mâle, cette expression, associée à celle de
Sry
, déclenche celle de
Sox9
, un gène crucial pour la différenciation testiculaire. À partir de 20 j
pc
,
Dmrt1
commence aussi à être exprimé dans les cellules germinales (têtes de flèche). Alors que chez le mâle, l’expression dans les cellules de Sertoli du testicule persiste toute la vie, chez la femelle, les cellules somatiques de l’ovaire vont progressivement « éteindre »
Dmrt1
, qui ne restera exprimé que dans les cellules germinales jusqu’au début de la formation des follicules. Cette expression de
Dmrt1
dans les cellules germinales des lapines est nécessaire au bon déroulement du processus méiotique après la naissance et à la fertilité.
|
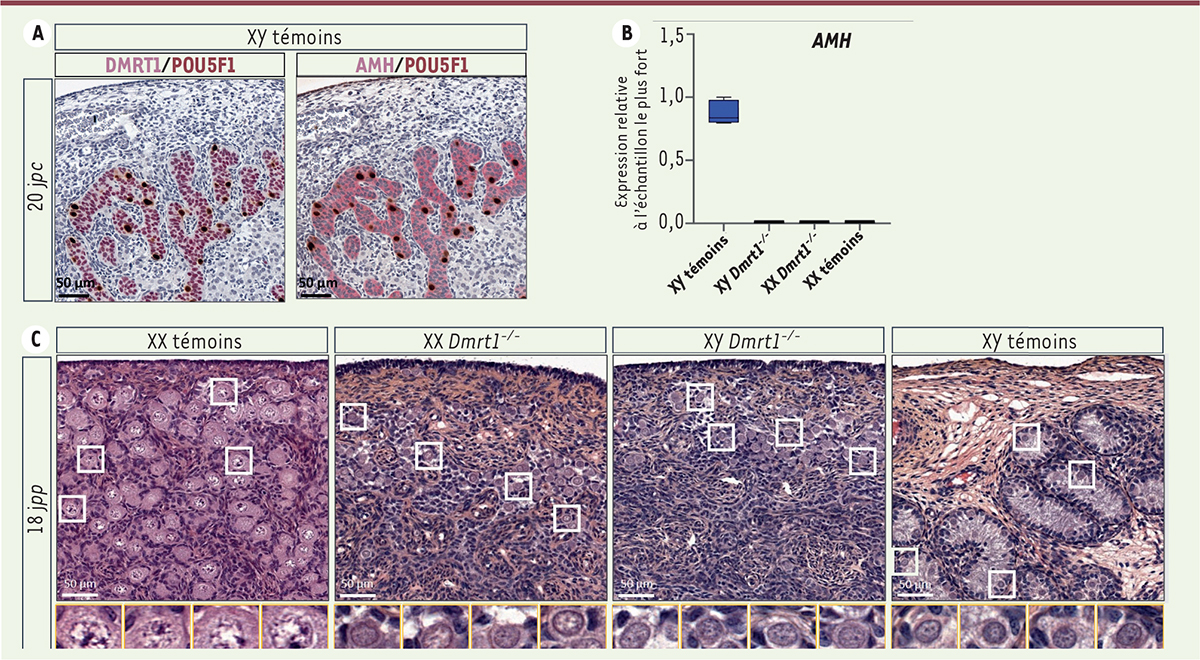
 | Figure 2.
Perturbation de la différenciation testiculaire et de la méiose des cellules germinales femelles en l’absence de DMRT1. A.
Co-immunomarquage de POU5F1 (
POU domain, class 5, transcription factor 1
; en brun) et de DMRT1 ou de l’hormone anti-müllérienne (AMH) (en rose) dans des testicules de lapin à 20 jours de développement embryonnaire (jours
post coïtum
, j
pc
).
B.
Expression du gène codant l’AMH par RT-qPCR dans des gonades de lapin de différents génotypes à 20 j
pc
. L’expression de
Dmrt1
dans les cellules de Sertoli active l’expression de
Sox9
, qui induit à son tour l’expression de ses gènes cibles, dont celui codant l’AMH. Dans les gonades dépourvues de DMRT1, l’expression du gène de l’
AMH
n’est pas déclenchée. C. Histologie des gonades de lapins de différents génotypes 18 jours après la naissance (jours
post-partum
, j
pp
). Les cellules germinales des gonades dépourvues de DMRT1 n’entrent pas en méiose, et restent regroupées en nids ovigères.
|
|
Dmrt1
, un gène de détermination du testicule chez le lapin
Conformément à notre hypothèse, l’invalidation du gène
Dmrt1
chez le lapin entraîne une inversion du sexe des individus XY, chez lesquels se développent des ovaires ainsi que des voies génitales de type femelle. En l’absence de DMRT1, aucune cellule de Sertoli ne se différencie dans la crête génitale des fœtus XY, et les marqueurs spécifiques de ces cellules, tels que l’hormone anti-Müllerienne ou la protéine de signalisation d
esert hedgehog
, ne sont jamais détectés dans leurs gonades (
Figure 2B
). Les gènes codant ces deux protéines sont des cibles directes du facteur de transcription SOX9, dont l’expression dans ces gonades XY dépourvues de DMRT1 est à peine supérieure à celle, très faible, dans les ovaires normaux (cette légère différence pouvant s’expliquer par l’action du facteur SRY). Ces résultats indiquent que chez le lapin, l’expression physiologique de
Sox9
requise pour la différenciation des cellules de Sertoli nécessite la présence de DMRT1, qui se lie vraisemblablement à des sites de fixation présents dans la région régulatrice du gène
Sox9
chez tous les mammifères, sauf les rongeurs [
12
]. Cette différence avec les rongeurs concorde avec le fait que DMRT1 est également capable d’induire l’expression de
Sox9
et la différenciation testiculaire chez les chèvres XX sans cornes, qui sont dépourvues du gène
Sry
[
9
].
|
Dmrt1
, un gène clé de la fertilité femelle chez la lapine
En plus de l’inversion du sexe chez les individus XY, l’invalidation du gène
Dmrt1
chez le lapin a également révélé le rôle clé de DMRT1 dans la différenciation ovarienne, et plus spécifiquement, dans l’entrée en méiose des cellules germinales femelles après la naissance [
11
]. En effet, les cellules germinales ovariennes des individus
Dmrt1
-/-
XX ou XY n’entrent pas en méiose ; elles restent groupées au sein des nids ovigères, et la formation des follicules ovariens qui suit la rupture des nids ne se produit pas (
Figure 2C
). Chez ces individus
Dmrt1
-/-
, des cellules germinales sont encore visibles 18 jours après la naissance (
Figure 2C
), mais elles disparaissent ensuite et sont totalement absentes au moment de la puberté, à partir de 5 mois, ce qui rend ces animaux totalement infertiles. Les cibles du facteur DMRT1 et son rôle exact dans le processus de méiose chez la femelle restent à préciser. Ce rôle semble conservé au moins chez les oiseaux car un phénotype similaire de blocage pré-méiotique a été décrit chez les poules ZW dépourvues de DMRT1 [
2
].
|
L’invalidation du gène
Dmrt1
chez le lapin, en tant que modèle de mammifère non rongeur, a permis de mettre en lumière différentes fonctions de ce gène auparavant mal connues, car non conservées dans les espèces murines (et vraisemblablement chez les autres rongeurs). En plus de son rôle de déterminant testiculaire en tant qu’activateur majeur du gène
Sox9
, DMRT1 est également, chez le lapin, un facteur clé de la différenciation ovarienne et de la fertilité dans les deux sexes (
Figure 1
). Par ailleurs, le dosage génique de
Dmrt1
, critique pour la détermination du sexe gonadique chez les oiseaux, joue également un rôle important chez le lapin puisque les mâles hétérozygotes pour la mutation de
Dmrt1
, qui sont en situation d’haploinsuffisance pour ce gène, ont une infertilité secondaire par arrêt de la spermatogénèse vers l’âge de deux ans. Ces différentes anomalies phénotypiques constatées chez le lapin laissent supposer que des mutations de
DMRT1
pourraient être à l’origine de certaines maladies humaines de la reproduction, telles que l’insuffisance ovarienne et l’azoospermie, en plus d’être impliquées dans l’inversion du sexe chez certaines femmes de caryotype 46, XY.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Zarkower
D
,
Murphy
MW
.
DMRT1 : an ancient sexual regulator required for human gonadogenesis.
.
Sex Dev
.
2022;
;
16
:
:112.
–
25
.
2.
Ioannidis
J
,
Taylor
G
,
Zhao
D
,
et al
.
Primary sex determination in birds depends on DMRT1 dosage, but gonadal sex does not determine adult secondary sex characteristics.
.
Proc Natl Acad Sci USA
.
2021;
;
118
:
:e2020909118.
.
3.
Martinez-Bengochea
AL
,
Kneitz
S
,
Herpin
A
,
et al
.
Sexual development dysgenesis in interspecific hybrids of Medaka fish.
.
Sci Rep
.
2022;
;
12
:
(5)
:408.
.
4.
Yoshimoto
S
,
Okada
E
,
Umemoto
H
,
et al.
A W-linked DM-domain gene, DM-W, participates in primary ovary development in Xenopus laevis.
.
Proc Natl Acad Sci USA
.
2008;
;
105
:
(2)
:469.
–
474
.
5.
Ge
C
,
Ye
J
,
Weber
C
,
et al.
The histone demethylase KDM6B regulates temperature-dependent sex determination in a turtle species.
.
Science
.
2018;
;
360
:
:645.
–
648
.
6.
Murphy
MW
,
Lee
JK
,
Rojo
S
,
et al.
An ancient protein-DNA interaction underlying metazoan sex determination.
.
Nat Struct Mol Biol
.
2015;
;
22
:
:442.
–
451
.
7.
Pailhoux
E
,
Vigier
B
,
Chaffaux
S
,
et al.
A 11.7-kb deletion triggers intersexuality and polledness in goats.
.
Nat Genet
.
2001;
;
29
:
:453.
–
458
.
8.
Boulanger
L
,
Pannetier
M
,
Gall
L
,
et al.
FOXL2 is a female sex-determining gene in the goat.
.
Curr Biol
.
2014;
;
24
:
:404.
–
408
.
9.
Elzaiat
M
,
Jouneau
L
,
Thépot
D
,
et al.
High-throughput sequencing analyses of XX genital ridges lacking FOXL2 reveal DMRT1 up-regulation before SOX9 expression during the sex-reversal process in goats.
.
Biol Reprod
.
2014;
;
91
:
:153.
.
10.
Jolivet
G
,
Daniel-Carlier
N
,
Harscoët
E
,
et al
.
Fetal estrogens are not involved in sex determination but are critical for early ovarian differentiation in rabbits.
.
Endocrinology
.
2022;
;
163
:
:bqab210.
.
11.
Dujardin
E
,
André
M
,
Dewaele
A
,
et al
.
Dmrt1
is a testis-determining gene in rabbits and is also essential for female fertility
.
.
Elife
.
2023;
;
12
:
:RP89284.
.
12.
Gonen
N
,
Futtner
CR
,
Wood
S
,
et al
.
Sex reversal following deletion of a single distal enhancer of Sox9.
.
Science
.
2018;
;
360
:
:1 469.
–
73
.
|