| |
| Med Sci (Paris). 40(1): 107–109. doi: 10.1051/medsci/2023184.Comment les cellules de Cajal-Retzius ont détourné un réseau génique impliqué dans la multiciliation pour acquérir leur identité neuronale Juliette S. Morel1,2 and Frédéric Causeret1,2* 1Université Paris Cité, institut Imagine, équipe Génétique et développement du cortex cérébral
,
Paris
,
France 2Université Paris Cité, institut de psychiatrie et neurosciences de Paris (IPNP), Inserm U1266, équipe Génétique et développement du cortex cérébral
,
Paris
,
France MeSH keywords: Humains, Réseaux de régulation génique, Neurones, Hippocampe, Cortex cérébral, physiologie, physiologie |
Au cours du développement du cortex cérébral, différents types de neurones sont produits. La diversité neuronale qui en découle est essentielle pour l’établissement des réseaux neuronaux qui permettent l’exécution des fonctions motrices, sensorielles et cognitives. La classification des types neuronaux a longtemps reposé sur la combinaison de caractéristiques morphologiques (taille du corps cellulaire, projection axonale, arborisation dendritique) et électrophysiologiques (potentiel de membrane au repos, activité électrique spontanée, etc.) avec quelques marqueurs moléculaires. Plus récemment, l’essor des approches transcriptomiques, en particulier celles fondées sur le séquençage d’ARN en cellule unique (
single cell RNA sequencing
, scRNAseq), a permis de mettre en évidence une diversité neuronale inattendue au sein du cortex cérébral [
1
], et il est apparu que le type de neurotransmetteur et la projection axonale sont les principales sources de cette diversité [
2
–
4
]. Les mécanismes à l’origine de cette diversité neuronale ne sont pas encore tous identifiés, en particulier dans une perspective phylogénétique. Or, comprendre comment de nouveaux types de neurones ont émergé au cours de l’évolution des espèces animales pourrait permettre d’expliquer l’apparition de nouvelles fonctions sous-tendues par des réseaux neuronaux dédiés [
5
].
|
Les cellules de Cajal-Retzius : des neurones transitoires impliqués dans l’organisation du cortex cérébral
Les cellules de Cajal-Retzius font partie des premiers types de neurones produits au cours du développement du cortex cérébral. Ce sont des neurones excitateurs glutamatergiques transitoires qui disparaissent peu après la naissance chez la souris [
6
,
7
]. Les cellules de Cajal-Retzius sécrètent la reeline, une glycoprotéine impliquée dans la migration radiale des neurones pyramidaux qui forment les différentes couches corticales
1
[
8
]. Ces cellules ont également été impliquées dans le positionnement des aires fonctionnelles du cortex [
9
] et la mise en place des circuits corticaux et hippocampiques [
6
,
7
]. Elles peuvent donc être considérées comme des cellules architectes de la corticogenèse.
Les cellules de Cajal-Retzius sont présentes chez les lézards et les oiseaux, ce qui suggère une origine évolutive commune aux amniotes
2
. L’amplification de ces cellules chez les mammifères, en particulier dans le néocortex, plaide en faveur d’un rôle important dans l’évolution du cortex cérébral [
10
]. En réalisant la première caractérisation des cellules de Cajal-Retzius par scRNAseq en 2021, notre équipe de recherche a révélé leur identité particulière par rapport aux autres neurones du télencéphale et a mis en évidence une diversité de sous-populations qui correspondent aux différentes origines de production de ces cellules [
11
].
|
Une porte ouverte sur les mécanismes d’émergence de nouveaux types cellulaires
Nous avons ensuite cherché à comprendre les mécanismes de spécification des cellules de Cajal-Retzius au cours du développement cortical. Nous nous sommes focalisés sur l’ourlet cortical (
cortical hem
), une région médiane du cortex en développement qui produit la majorité des cellules de Cajal-Retzius (
Figure 1A
). Par scRNAseq, nous avons caractérisé la trajectoire de différenciation des cellules de Cajal-Retzius, c’est-à-dire la séquence d’expression de tous les gènes impliqués dans le programme aboutissant à leur production, et nous avons pu comparer cette trajectoire à celle des autres neurones corticaux. Étonnamment, nous avons observé une surreprésentation des gènes impliqués dans le processus de multiciliation au moment où les cellules de Cajal-Retzius commencent à se différencier [
12
]. Ces gènes sont normalement exprimés par les cellules épithéliales d’une structure voisine, les plexus choroïdes
3
: ils permettent l’assemblage, dans ces cellules, de multiples cils motiles favorisant la circulation du fluide cérébrospinal dans les ventricules cérébraux. Cependant, une analyse des cellules de Cajal-Retzius par immunofluorescence a montré qu’elles ne sont pas multiciliées. Ces cellules expriment donc transitoirement tous les gènes nécessaires à la multiciliation sans pour autant en avoir les caractéristiques phénotypiques.
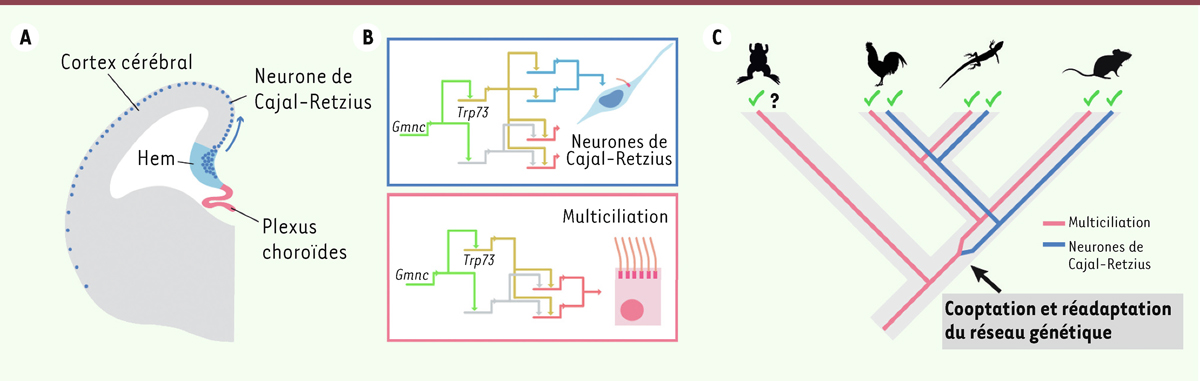
 | Figure 1.
Spécification des neurones de Cajal-Retzius. A.
Les neurones de Cajal-Retzius sont majoritairement produits dans l’ourlet cortical (Hem), un territoire voisin des plexus choroïdes, et migrent tangentiellement à la surface du cortex cérébral.
B.
Un même module de gènes impliqué dans la multiciliation cellulaire est exprimé par les neurones de Cajal-Retzius et les cellules épithéliales des plexus choroïdes.
C.
Scénario évolutif ayant conduit à l’émergence des neurones de Cajal-Retzius par cooptation du module de gènes de multiciliation. Il reste à vérifier la présence ou l’absence des neurones de Cajal-Retzius chez les amphibiens pour valider ce modèle.
|
Quel rôle joue l’expression du module de gènes de multiciliogenèse au cours de la différenciation des cellules de Cajal-Retzius ? Une analyse combinant histologie, traçage génétique et scRNAseq d’une lignée de souris mutantes dont le gène
Gmnc (Geminin coiled-coil domain containing)
, à l’origine de la cascade signalétique de multiciliation, a été inactivé, a révélé une trajectoire de différenciation anormale des cellules de Cajal-Retzius qui n’acquièrent plus leur identité finale : elles conservent toutefois certaines de leurs caractéristiques (migration tangentielle, expression de la reeline), mais ne réalisent pas tout le programme d’expression génique leur conférant leur spécificité, ce qui provoque leur mort précoce par apoptose. Ainsi, le module de multiciliation, s’il n’est pas indispensable pour la production des cellules de Cajal-Retzius, est néanmoins nécessaire à leur différenciation complète. En analysant la contribution des différents gènes situés en aval de Gmnc dans la cascade signalétique, nous avons montré que seuls certains des effecteurs du module de multiciliation, en particulier le facteur de transcription TRP73
(transformation-related protein 73)
, sont indispensables à la spécification de ces cellules (
Figure 1B
).
Comment un même module de gènes peut-il contrôler deux processus aussi distincts que la multiciliogenèse et la spécification d’une identité neuronale ? Pour répondre à cette question, nous avons surexprimé
Gmnc
de manière conditionnelle à différents stades de différenciation ou dans différentes régions par électroporation
in utero
. Nous avons ainsi pu montrer que la dynamique d’expression de
Gmnc
est déterminante, et que les cellules qui prolifèrent et celles qui sont engagées dans la différenciation neuronale « interprètent » différemment l’expression d’un même gène. De plus, des caractéristiques en rapport avec la position des cellules au sein du tissu contribuent à leur capacité à déclencher, ou non, la multiciliogenèse en réponse à l’expression de
Gmnc
.
|
Ces résultats apportent de nouvelles clés pour comprendre l’évolution du cortex cérébral et la spécification cellulaire. La multiciliation, qui se produit non seulement dans certaines cellules épithéliales du cerveau, mais aussi dans celles des voies respiratoires et de l’appareil reproducteur, est un processus très ancien dans l’évolution, et les gènes impliqués sont conservés chez les vertébrés [
13
]. En revanche, les cellules de Cajal-Retzius sont une innovation évolutive plus récente. Nous proposons donc un scénario dans lequel un module ancestral de gènes impliqués dans la multiciliation et exprimés par les cellules épithéliales des plexus choroïdes a été coopté et adapté par les cellules d’un territoire voisin pour contrôler un processus différent : l’émergence d’une nouvelle identité neuronale (
Figure 1C
). Il reste à déterminer le mécanisme de cette cooptation par les futures cellules de Cajal-Retzius. Dans cette perspective, il conviendra de tester l’hypothèse d’une modification des séquences régulatrices de
Gmnc
ayant conduit à une extension de son expression à partir des plexus choroïdes vers le territoire voisin où sont produites les cellules de Cajal-Retzius. Il reste également à déterminer comment la fonction d’un même module de gènes a pu diverger dans deux lignages cellulaires : on pourra notamment rechercher si le facteur de transcription TRP73 a acquis (ou perdu) des gènes cibles dans les cellules de Cajal-Retzius par rapport aux cellules des plexus choroïdes (
Figure 1B
).
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ces travaux de recherche ont bénéficié d’un soutien financier du programme Émergence de l’IdEx université Paris Cité (IDEX RM27J21IDXA7_CAJALIDENT) et de l’Agence nationale de la recherche (ANR-22-CE16-0011-01).
|
Footnotes |
1.
Yao
Z
,
van Velthoven
CTJJ
,
Nguyen
TN
,
et al
.
A taxonomy of transcriptomic cell types across the isocortex and hippocampal formation.
.
Cell
.
2021;
;
184
:
:3222.
–
41.e26
.
2.
Tasic
B
,
Menon
V
,
Nguyen
TN
,
et al
.
Adult mouse cortical cell taxonomy revealed by single cell transcriptomics.
.
Nat Neurosci
.
2016;
;
19
:
:335.
–
46
.
3.
Klingler
E
,
De la Rossa
A
,
Fièvre
S
,
et al.
A translaminar genetic logic for the circuit identity of intracortically projecting neurons.
.
Curr Biol
.
2019
:
:1.
–
8
.
4.
Di Bella
DJ
,
Habibi
E
,
Stickels
RR
,
et al
.
Molecular logic of cellular diversification in the mouse cerebral cortex.
.
Nature
.
2021;
;
595
:
:554.
–
9
.
5.
Arendt
D
,
Bertucci
PY
,
Achim
K
,
et al
.
Evolution of neuronal types and families.
.
Curr Opin Neurobiol
.
2019;
;
56
:
:144.
–
52
.
6.
Causeret
F
,
Moreau
MX
,
Pierani
A
,
et al
.
The multiple facets of Cajal-Retzius neurons.
.
Development
.
2021;
;
148
:
:dev199409.
.
7.
Elorriaga
V
,
Pierani
A
,
Causeret
F
.
Cajal-Retzius cells : Recent advances in identity and function.
.
Curr Opin Neurobiol
.
2023;
;
79
:
:102.
–
686
.
8.
Hirota
Y
,
Nakajima
K
.
Control of neuronal migration and aggregation by reelin signaling in the developing cerebral cortex.
.
Front Cell Dev Biol
.
2017;
;
5
:
:40.
.
9.
Causeret
F
,
Pierani
A
.
Quand la migration de neurones signalisateurs contrôle la régionalisation du cortex cérébral.
.
Med Sci (Paris)
.
2016;
;
32
:
:317.
–
9
.
10.
Bar
I
,
Lambert de Rouvroit
C
,
Goffinet
AM
.
The evolution of cortical development. An hypothesis based on the role of the reelin signaling pathway.
.
Trends Neurosci
.
2000;
;
23
:
:633.
–
8
.
11.
Moreau
MX
,
Saillour
Y
,
Cwetsch
AW
,
et al
.
Single-cell transcriptomics of the early developing mouse cerebral cortex disentangle the spatial and temporal components of neuronal fate acquisition.
.
Development
.
2021;
;
148
:
:dev197962.
.
12.
Moreau
MX
,
Saillour
Y
,
Elorriaga
V
,
et al
.
Repurposing of the multiciliation gene regulatory network in fate specification of Cajal-Retzius neurons.
.
Dev Cell
.
2023;
;
58
:
:1365.
–
1382.e6
.
13.
Spassky
N
,
Meunier
A
.
The development and functions of multiciliated epithelia.
.
Nat Rev Mol Cell Biol
.
2017;
;
18
:
:423.
–
36
.
|