Environ 40 % des personnes atteintes de la maladie de Parkinson présentent des déficits locomoteurs, notamment des troubles de la marche, des troubles de l’équilibre, et des épisodes de gel de la marche, encore appelés « freezing ». Chez les personnes présentant une maladie de Parkinson à un stade avancé, la prévalence des déficits locomoteurs dépasse 90 % [ 1 ]. Ces déficits réduisent considérablement la qualité de vie et augmentent les comorbidités. Malheureusement, ils répondent mal aux thérapies actuellement disponibles, telles que les stratégies de remplacement de la dopamine et la stimulation cérébrale profonde du noyau sous-thalamique [ 2 ]. Ces thérapies améliorent souvent certaines caractéristiques des schémas de marche, mais ont une efficacité limitée sur les éléments résistants à la dopamine, tels que le déclenchement de la marche, l’équilibre, l’instabilité posturale et le freezing . La stimulation cérébrale profonde peut même augmenter la fréquence et la durée des épisodes de freezing . Une autre stratégie consiste à administrer une stimulation électrique continue de la moelle épinière sur ses segments cervicaux ou thoraciques, afin de recruter des fibres afférentes ascendantes nichées dans les colonnes dorsales pour moduler l’activité des noyaux gris centraux et du cortex cérébral. Malgré une réduction des déficits locomoteurs chez certaines personnes présentant une maladie de Parkinson, l’application plus large de cette stratégie a conduit à des résultats variables et insatisfaisants [ 3 ]. L’identification de thérapies complémentaires pour atténuer les déficits locomoteurs est donc une priorité pour améliorer la qualité de vie des personnes présentant une maladie de Parkinson à un stade avancé.
Alors que les thérapies actuellement disponibles se concentrent sur les circuits neuronaux du cerveau qui sont directement affectés par la perte des cellules productrices de dopamine, une stratégie alternative consisterait à cibler les circuits neuronaux de la moelle épinière lombo-sacrée qui produisent finalement la marche, et qui ne sont a priori pas directement affectés par la maladie. Nous avons donc émis l’hypothèse que des stratégies capables de moduler l’activité des circuits neuronaux de la moelle épinière lombo-sacrée pourraient être efficaces pour atténuer les déficits locomoteurs dus à la maladie de Parkinson.
Nous avions précédemment montré que la stimulation électrique épidurale ciblée de la moelle épinière lombo-sacrée modulait l’activité des motoneurones par l’activation d’afférences de grand diamètre, là où elles pénètrent dans la moelle épinière par les zones d’entrée de la racine dorsale du nerf spinal [ 4 ]. Ce principe physiologique permet de contrôler en temps réel l’activité des motoneurones du membre inférieur. Concrètement, les zones d’entrée de la racine dorsale innervant les segments lombo-sacrés sont ciblées avec un timing (une cinétique) reproduisant le schéma temporel naturel d’activation des motoneurones du membre inférieur [ 5 ]. Cette stratégie a permis de rétablir la station debout, la marche, le cyclisme et même la natation chez des personnes paralysées à cause d’une lésion de la moelle épinière [ 6 , 7 ]. Ce programme, fruit de très nombreuses années de recherches fondamentales, translationnelles et cliniques à l’école polytechnique de Lausanne (Suisse), sous la direction de Grégoire Courtine et Jocelyne Bloch, fut mené en collaboration avec Erwan Bézard (université de Bordeaux, CNRS, Inserm) pour la partie d’investigation et de démonstration préclinique chez un primate non humain [ 5 , 8 , 9 ].
Dès 2008, nous avions formulé l’hypothèse que cette neuroprothèse développée pour aider les personnes ayant subi une lésion de la moelle épinière pourrait être adaptée au contexte spécifique des déficits locomoteurs de la maladie de Parkinson. Dans une démarche translationnelle, nous avons tout d’abord montré l’efficacité de la neuroprothèse spinale sur un groupe de primates non humains « parkinsoniens », en étudiant notamment les effets complémentaires de la stimulation cérébrale profonde et de la stimulation électrique épidurale [ 8 ]. Enfin, cette neuroprothèse spinale a été testée chez un patient parkinsonien répondant favorablement au traitement médicamenteux de remplacement de la dopamine et porteur d’un dispositif de stimulation cérébrale profonde ( Figure 1 ). Les résultats ont été stupéfiants : atténuation spectaculaire des déficiences de la marche, des troubles de l’équilibre, et quasi-disparition des épisodes de freezing [ 8 ]. Il en est résulté une franche diminution du nombre de chutes (de deux à cinq chutes par jour avant la chirurgie d’implantation de la neuroprothèse spinale, à une à deux chutes par semaine 16 mois après la chirurgie) [ 8 ]. En outre, la rééducation à la marche renforcée par la neuroprothèse a amélioré l’état neurologique de ce patient, qui a fait état, comme l’ont fait également les personnes de son entourage, d’une amélioration de sa qualité de vie.
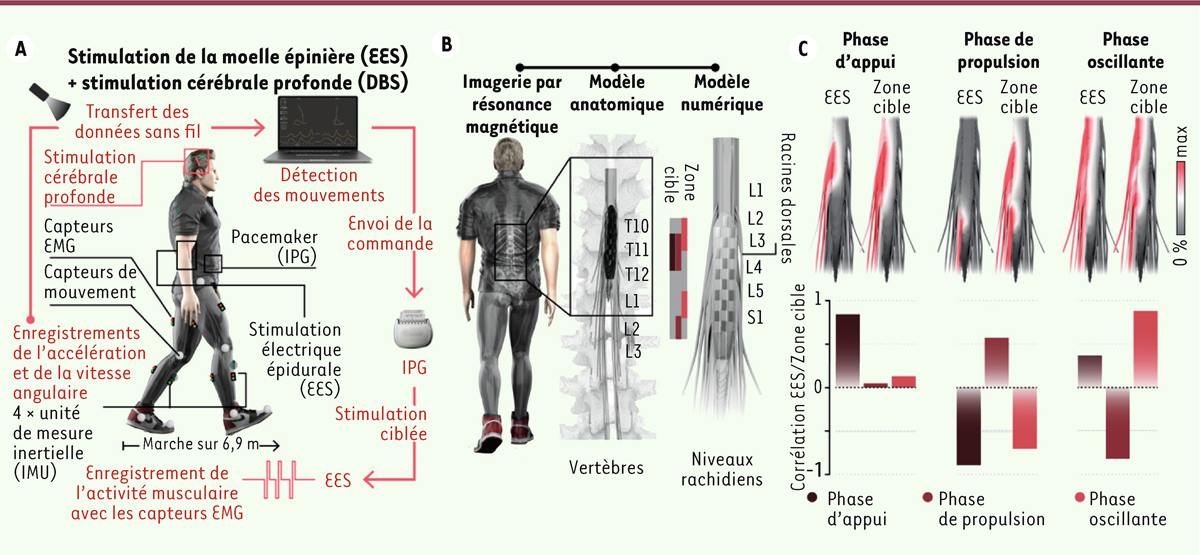
| Figure 1.
Conception de la neuroprothèse pour la maladie de Parkinson. A.
Schéma illustrant la neuroprothèse combinée à la stimulation cérébrale profonde du noyau sous-thalamique, avec ses différentes composantes, chez la personne ayant testé l’efficacité de ce dispositif avec succès.
B.
L’illustration montre le modèle anatomique de la colonne vertébrale de cette personne, construit à partir des images de résonance magnétique nucléaire (IRM) et de tomodensitométrie (modèle à personnaliser pour chaque patient). Ce modèle a été utilisé pour déterminer l’emplacement chirurgical d’un réseau de 16 électrodes, comme le montre l’illustration à droite. La matrice codée en couleur montre les emplacements caudo-rostraux des trois «
hot spots
» de stimulation pour chaque hémichorde (donc six
hot spots
en tout).
C.
Cartes spatiales de l’activation neuronale provoquée par la stimulation électrique épidurale (à gauche) et du
hot spot
ciblé (à droite) pour une hémichorde. Les diagrammes en barres indiquent les corrélations entre les cartes d’activation neuronale provoquée par la stimulation électrique épidurale et les trois
hot spots
ciblés. Ce schéma est répété alternativement pour chaque côté de la moelle épinière afin de provoquer la marche avec alternance des deux côtés. EES : stimulation électrique épidurale ; IPG : stimulateur électrique (
implantable pulse generator
) ; EMG : électromyographie.
|
La maladie de Parkinson présente un large spectre de profils neurologiques associés à des déficits locomoteurs distincts. Par conséquent, nous ne pouvons affirmer que la neuroprothèse sera efficace pour atténuer les déficiences de la marche, remédier aux problèmes d’équilibre et réduire le freezing chez l’ensemble des personnes atteintes de cette maladie. Les études futures devront donc préciser le profil neurologique des personnes qui peuvent bénéficier de cette thérapie. Son extension à d’autres individus présentant la maladie dépend de techniques spécifiques optimisées pour les besoins particuliers de chaque personne. Tout d’abord, la précision du protocole de stimulation électrique épidurale nécessite un portefeuille d’électrodes spinales personnalisé, ciblant l’ensemble des zones d’entrée de la racine dorsale impliquées dans le contrôle des motoneurones du membre inférieur chez cette personne, combiné à une plateforme de neurostimulation polyvalente pour un contrôle rapide et en boucle fermée de la stimulation. Deuxièmement, la synchronisation de la neuroprothèse avec les intentions motrices de la personne nécessite l’identification d’un compromis optimal entre le caractère invasif, la fiabilité et la praticité de la technique utilisée pour détecter ces intentions motrices. Les capteurs portatifs non invasifs sont la solution préférée, à condition que les détections soient fiables et que les capteurs soient pratiques à utiliser dans la vie quotidienne. Chez la personne ayant testé l’efficacité de la neuroprothèse avec succès, les signaux recueillis par ces capteurs étaient suffisants pour la faire fonctionner avec une grande précision. Compte tenu de la grande diversité des déficits neurologiques provoqués par la maladie de Parkinson, il est possible que des symptômes plus sévères ou des déficits locomoteurs encore aggravés nécessitent des signaux de commande de la stimulation plus précis, impliquant des techniques invasives de recueil des signaux correspondant aux intentions motrices. Nous avons montré que les intentions motrices peuvent être décodées à partir de l’activité neuronale du cortex cérébral avec une grande précision en utilisant des implants peu invasifs. Nous avons déjà tiré parti de ce constat pour concevoir un pont numérique entre le cerveau et la moelle épinière, qui a rétabli la marche naturelle chez une personne paralysée à la suite d’une lésion de la moelle épinière [ 10 ]. La faisabilité conceptuelle et technique d’une neuroprothèse contrôlée par le cerveau est donc bien établie. Une autre solution consiste à utiliser des électrodes de stimulation cérébrale profonde pour surveiller l’activité neuronale du noyau sous-thalamique. Nous avons montré que les évènements normaux et pathologiques de la marche peuvent être décodés en temps réel à partir de ces enregistrements chez les personnes présentant une maladie de Parkinson. Cette méthode est intéressante car de nombreuses personnes présentant une maladie de Parkinson reçoivent des électrodes de stimulation cérébrale profonde ciblant ce noyau cérébral avant de présenter des déficits locomoteurs non traitables qui les inciteraient à se faire implanter la nouvelle neuroprothèse.
Nous nous engageons à développer des techniques neuroprothétiques spécifiques optimisées pour les besoins particuliers des personnes présentant une maladie de Parkinson, à identifier celles qui répondent favorablement à cette thérapie, et donc à informer de la conception d’un essai pivot destiné à montrer la sécurité et l’efficacité de la neuroprothèse pour améliorer les déficits locomoteurs de ces personnes.