Les vaccins utilisant l’ARN messager (ARNm) ont été une révolution dans la lutte contre la pandémie de COVID-19 ( coronavirus disease 2 019 ). La rapidité avec laquelle cette nouvelle plateforme vaccinale a été déployée est le fruit de nombreuses années de recherche fondamentale. Les vaccins à ARNm, codant la spicule (ou protéine spike) du virus SARS-CoV-2 ( severe acute respiratory syndrome coronavirus 2 ) dans le cas des vaccins anti-COVID-19 (tozinaméran/BNT162b2, Pfizer/BioNTech ou élasoméran/mRNA-1273, Moderna ), reposent sur deux techniques développées parallèlement : celle de l’ARNm synthétique et celle de la nanoparticule lipidique destinée à l’encapsulation de cet ARNm afin d’empêcher sa dégradation et optimiser sa biodistribution. Les modifications apportées à l’ARNm synthétique servent, quant à elles, à en minimiser la reconnaissance par le système immunitaire inné et à en améliorer la traduction protéique.
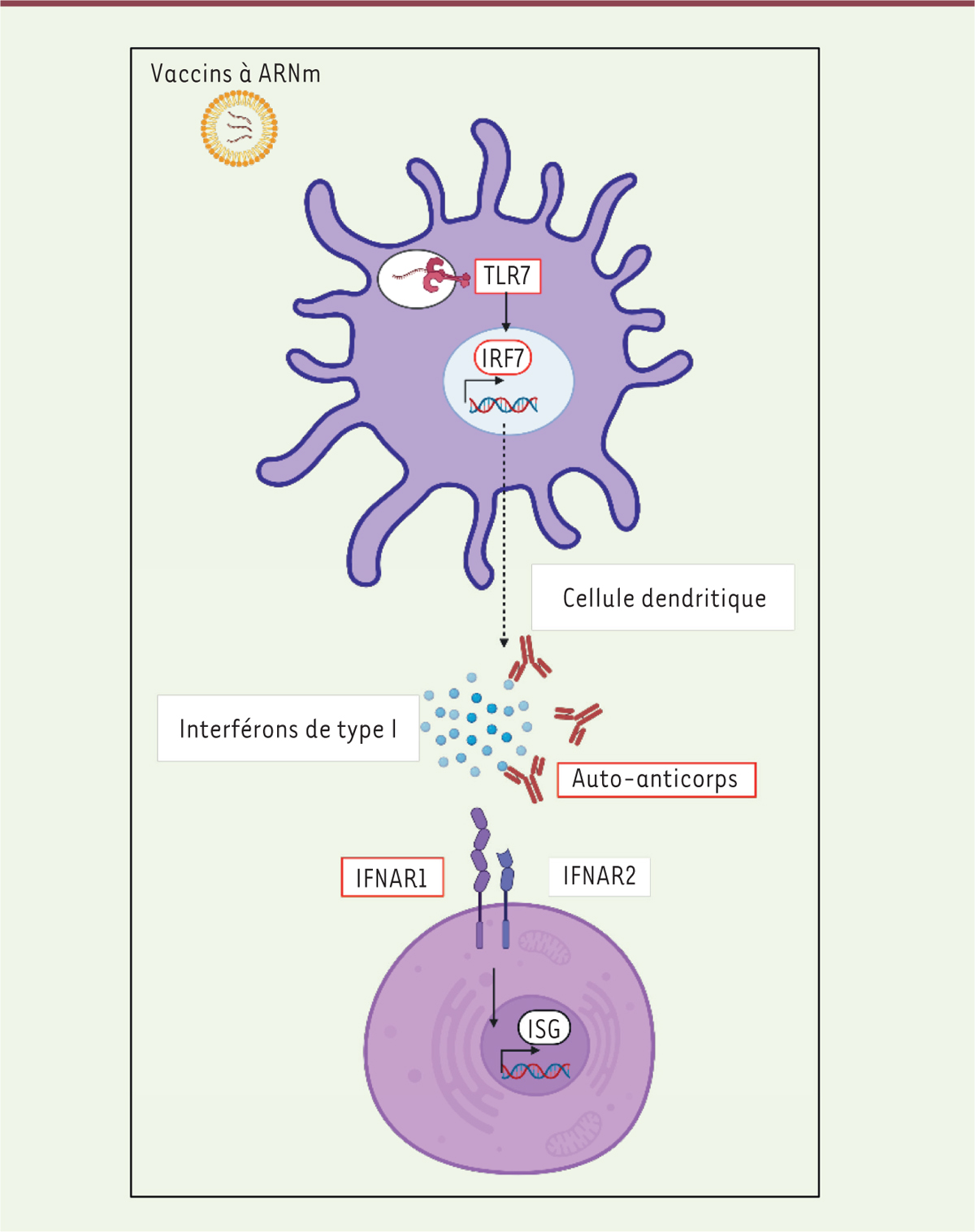
L’ARNm natif est naturellement reconnu par les récepteurs de reconnaissance de motifs moléculaires ( pattern recognition receptor ), notamment par les récepteurs Toll-like (TLR), incluant le TLR7 dans les vésicules endosomiques ( Figure 1 ). Cette reconnaissance de l’ARNm par la cellule aboutit à la production d’interférons de type I, cytokines essentielles de la protection antivirale, illustrée par la réaction inflammatoire systémique induite par la simple injection d’un ARNm purifié codant une protéine non immunogène, telle que la luciférase, chez la souris [ 1 , 2 ]. La contribution, essentielle, de Katalin Karikó et Drew Weissman (auxquels vient d’être attribué le prix Nobel de physiologie ou médecine en 2023) au développement des vaccins à ARNm a été de montrer que le remplacement, dans l’ARN, de l’uridine par la N1-méthylpseudouridine (N1-Me-pUTP), associé à une purification éliminant les ARN double brin et les brins d’ARN contaminants, permettait de considérablement réduire la réponse inflammatoire à l’injection de l’ARNm [ 1 ].
| Figure 1.
Réponse interféron de type I après détection de l’ARNm.
Réponse théorique de l’immunité innée à la détection d’ARNm non modifié et non purifié, entraînant la production d’interférons de type I. Les étapes non fonctionnelles chez certains des individus étudiés sont signalées par un cadre rouge. TLR7 :
toll-like receptor 7
; IRF7 :
interferon regulatory factor 7
; Auto-anticorps : anticorps neutralisant les interférons α ou β dans le cadre d’une polyendocrinopathie auto-immune ou du vieillissement ; IFNAR1, IFNAR2 :
interferon-
α
/
β
receptor subunits 1 and 2
; ISG :
interferon-stimulated genes.
|
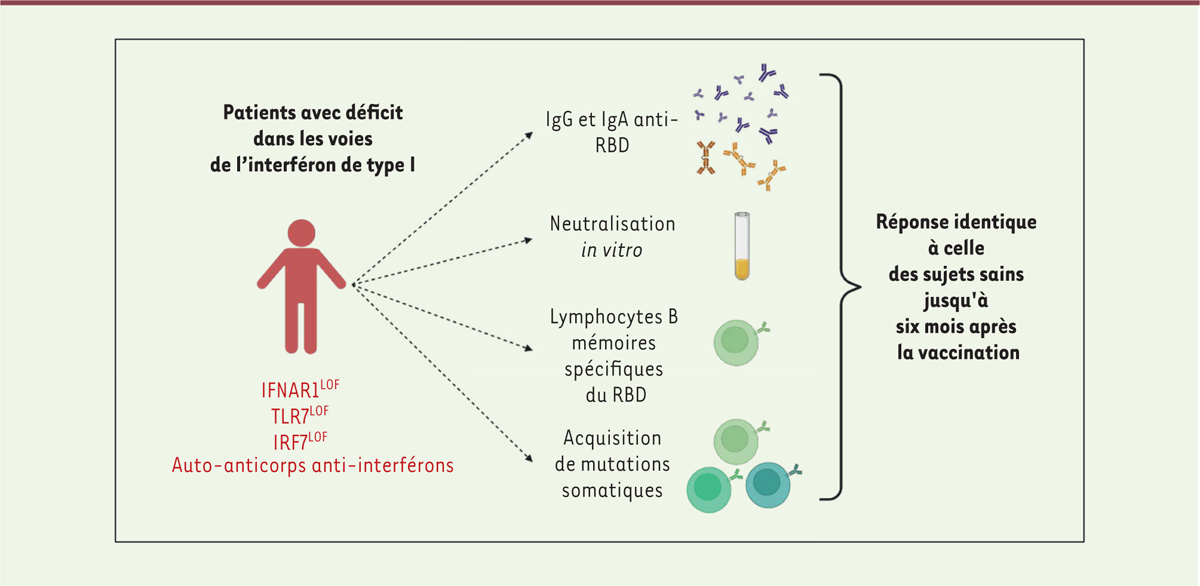
Il restait cependant admis que persistait une sécrétion résiduelle d’interféron de type I par les cellules présentatrices de l’antigène, et notamment les cellules dendritiques plasmacytoïdes, qui permettait l’activation optimale du système immunitaire lors de la vaccination par ARNm. Cette hypothèse faisait craindre un défaut de réponse vaccinale chez les personnes déficientes pour la voie de signalisation de l’interféron de type I, déficits exposant à des formes sévères de COVID-19. Les cas de déficit immunitaire génétique touchant les voies de signalisation de l’interféron de type I sont exceptionnels, mais les déficits acquis par production d’auto-anticorps dirigés contre les interférons de type I sont beaucoup plus fréquents, pouvant atteindre 4 % des sujets âgés, et ils sont détectés dans plus de 20 % des formes létales de COVID-19 [ 3 ].
Les résultats de nombreuses études chez des sujets sains infectés par le SARS-CoV-2 ont montré que la réponse immunitaire humorale contre ce virus cible majoritairement la protéine virale spike, en particulier son domaine RBD ( receptor-binding domain ). C’est par ce domaine que le virus se lie au récepteur hACE2 ( human angiotensin converting enzyme 2) de la cellule hôte et il constitue la cible principale des anticorps neutralisants de la réponse immunitaire [ 4 , 5 ]. Le domaine RBD de la protéine spike du SARS-CoV-2 étant fortement muté par rapport à celui de la protéine spike d’autres coronavirus infectant l’espèce humaine, il est reconnu comme un néo-épitope par le système immunitaire.
Alors qu’une sécrétion d’anticorps est détectée dans le sérum dès les premiers jours de la réponse immunitaire à l’infection, la mise en place d’une réponse mémoire efficace dure plusieurs mois et nécessite la formation de structures spécialisées, appelées centres germinatifs, dans les ganglions lymphatiques. Dans ces structures, les lymphocytes B accroissent progressivement leur affinité pour l’antigène dont ils sont spécifiques grâce à l’acquisition de mutations dans les gènes codant les anticorps qu’ils synthétisent. Cette réaction produit également des lymphocytes B mémoires et des plasmocytes possédant un programme transcriptionnel et épigénétique leur permettant de survivre plusieurs décennies, et pouvant conférer à l’individu une protection durant toute sa vie après certaines infections ou vaccinations [ 6 ]. Les résultats de plusieurs travaux de recherche avaient montré que l’infection par le SARS-CoV-2 ou la vaccination par ARNm contre ce virus provoquait une réponse efficace du centre germinatif, qui pouvait persister jusqu’à six mois et même un an dans certains cas [ 4 , 7 ].