| |
| Med Sci (Paris). 40(1): 42–48. doi: 10.1051/medsci/2023194.Microbiote buccal et foie Sylvie Lê,1,2,3 Matthieu Minty,1,2,3 Émile Boyer,4 Vincent Blasco-Baque,1,2,3 Martine Bonnaure-Mallet,4* and Vincent Meuric4** 1Département dentaire, université Paul Sabatier III (UPS)
,
Toulouse
,
France 2Service d’odontologie Toulouse, CHU Toulouse
,
Toulouse
,
France 3
UMR1297 Inserm, équipe
InCOMM (Intestine ClinicOmics Metabolism & Microbiota)
, Institut des maladies métaboliques et cardiovasculaires (I2MC), université Paul Sabatier
,
Toulouse
,
France 4Inserm U1317, Inrae, université de Rennes, CHU de Rennes, site Pontchaillou-Villejean
,
Rennes
,
France |
Vignette (© Thibault Canceill). Le foie est l’organe le plus volumineux de l’organisme. Il possède de nombreuses fonctions biologiques qui sont vitales. Il participe en effet au stockage et à la répartition des nutriments (glucides transformés en glycogène et lipides en triglycérides), à la synthèse de protéines du sang (albumine, hémoglobine et facteurs de la coagulation), à la détoxification de l’alcool et des médicaments, et à la synthèse de la bile qui participe à la digestion des graisses.
Le foie peut être la cible de plusieurs maladies, telles que les hépatites virales ou les hépatites médicamenteuses, les fibroses et les cirrhoses, dans lesquelles le tissu cicatriciel remplacera progressivement les cellules hépatiques endommagées, comme, par exemple, les maladies de surcharges (en fer ou en cuivre : hémochromatose, maladie de Wilson) et les stéatoses hépatiques non alcooliques (NASH, pour
non-alcoolic steato hepatitis
).
Comme le microbiote intestinal, le microbiote buccal peut influencer, voire même potentiellement participer, au développement de maladies hépatiques. Les dysbioses buccales peuvent en effet contribuer au développement d’une inflammation hépatique, en altérant la réponse immunitaire de l’hôte. Ainsi, les patients présentant une hémochromatose ou une NAFLD (
non-alcoholic fatty liver disease
) ont une importante dysbiose buccale. Des concentrations élevées de certaines bactéries colonisant la cavité buccale, comme
Porphyromonas gingivalis
ont été associées à une augmentation des facteurs de risque à la NAFLD, comme l’obésité ou la résistance à l’insuline.
|
Microbiote buccal et dysbiose parodontale
La bouche abrite une communauté de micro-organismes constituée de bactéries qui composent le microbiote buccal, dans un équilibre avec l’hôte appelé « eubiose ». Ce microbiote représente la deuxième communauté microbienne la plus importante dans l’espèce humaine, après celle qui colonise l’intestin. Il peut subir des changements au cours du temps. L’équilibre entre bactéries et hôte peut être rompu et ainsi être à l’origine de maladies lors de ce déséquilibre appelé « dysbiose ». Cette dysbiose est une altération qualitative, quantitative et fonctionnelle du microbiote, entraînant une rupture des relations bénéfiques que peut avoir le microbiote avec l’hôte, au détriment de sa santé. Au niveau parodontal, cette dysbiose est associés à une augmentation de la proportion de bactéries à Gram négatif. Ces bactéries produisent des facteurs de virulence (comme des lipopolysaccharides [LPS]) perturbant les défenses de l’hôte et sécrètent des produits métaboliques toxiques pour les cellules humaines. Par exemple,
Porphyromonas gingivalis
, qui est considéré comme un pathogène clé de voûte impliqué dans les parodontites, semble influencer certaines maladies générales [
1
,
2
. Ses métabolites induisent en effet la production de cytokines pro-inflammatoires, comme l’IL (interleukine)-6 ou le TNF-α (
tumor necrosis factor alpha
) [
3
–
5
]. Les bactéries, leurs métabolites et les cytokines pro-inflammatoires passent dans la circulation sanguine, ce qui génère une endotoxémie [
4
]. Celle-ci est responsable d’une inflammation, dite de bas grade, touchant des tissus distants, comme le cœur ou le foie [
7
], qui contribuera à aggraver des syndromes métaboliques, comme l’insulino-résistance dans le cas du diabète [
8
]. Les parodontites et
P. gingivalis
sont en effet des facteurs de risque potentiellement impliqués dans des maladies systémiques, comme le diabète, la polyarthite rhumatoïde ou des maladies cardiovasculaires [
9
].
Les parodontites sont des maladies inflammatoires chroniques de la cavité buccale qui résultent d’interactions complexes entre les bactéries d’un microbiote en situation de dysbiose, les réponses immunitaires de l’hôte, et des facteurs environnementaux et nutritionnels qui favorisent ces perturbations inflammatoires et immunologiques [
10
]. C’est cet ensemble de facteurs qui conduit finalement à la destruction des tissus environnant les dents.
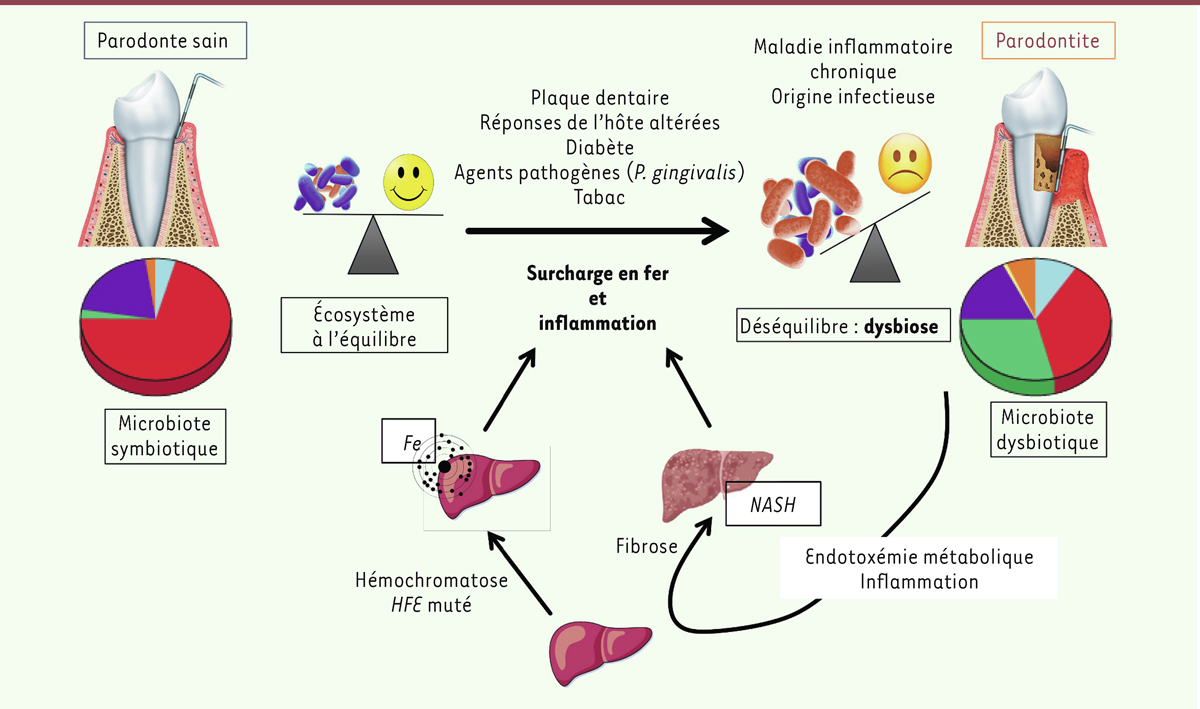
Différentes hypothèses ont été évoquées pour comprendre le rôle de la plaque bactérienne dans les maladies orales que sont les maladies carieuses et les maladies parodontales : plaque spécifique [
11
], plaque non spécifique [
12
], et plaque écologique [
13
]. Le modèle actuel de la maladie parodontale met l’accent sur une action de groupe, une synergie polymicrobienne, plutôt que sur des agents pathogènes particuliers [
14
]. Ce modèle introduit également la notion de dysbiose du microbiote buccal (
Figure 1
).
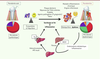 | Figure 1.
Maladie parodontale et microbiote : facteurs influençant la dysbiose.
Rôle potentiel de l’hémochromatose et de la NASH.
|
La complexité du modèle étiopathogénique de la parodontite découle directement de l’amélioration des outils d’analyse (nouvelles techniques de séquençage) car ils permettent d’étudier la communauté bactérienne dans son ensemble, et de façon plus précise.
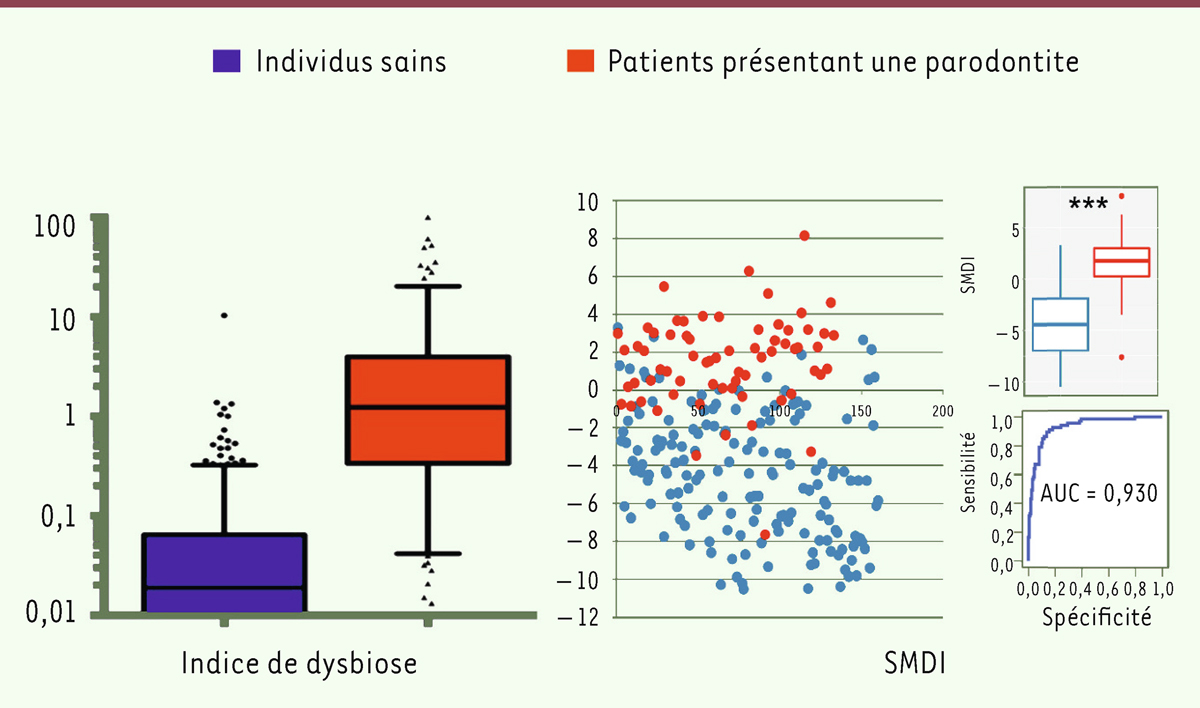
Comment définir la dysbiose dans le cas de la parodontite ? Deux équipes ont réalisé une analyse de l’ensemble des résultats publiés jusqu’à ce jour afin de proposer des indices pertinents définissant la dysbiose buccale [
15
,
16
. La première analyse, réalisée par Meuric
et al.,
a porté sur le microbiote issu du séquençage du gène codant l’ARN ribosomal 16S bactérien et les réseaux bactériens de sujets sains et de sujets malades, provenant de banques de données publiées. Cette analyse a identifié des genres bactériens majoritairement associés à un état sain et d’autres associés à un état pathologique. Les auteurs ont ainsi proposé des ratios reflétant une dysbiose, calculés à partir des abondances de ces différents genres bactériens, avec une bonne corrélation (R = 0,659, p < 0,001). Finalement, un ratio (
Porphyromonas
+
Treponema
+
Tannerella
/
Rothia
+
Corynebacteria
) a été proposé, où l’abondance de genre est calculée au sein du microbiote [
15
]. Dans l’autre analyse, réalisée par Chen
et al.
, des indices de dysbiose du microbiote, appelé SMDI pour
subgingival microbial dysbiosis index,
ont été calculés par apprentissage automatique de données publiées (patients sains et présentant une parodontite). Une version simplifiée de ce SMDI repose sur l’utilisation de trois genres bactériens :
Treponema
,
Fretibacterium
et
Actinomyces
. Elle semble pouvoir être utilisée avec une précision comparable [
16
]. Ces publications proposent donc des indices de dysbiose qui se révèlent relativement simples à calculer et peuvent représenter les modifications du microbiote buccal, reflet de la maladie parodontale (
Figure 2
).
 | Figure 2.
Indices de dysbiose parodontale proposés dans la littérature.
À gauche, l’indice décrit par Meuric
et al.
[
15
]. À droite, le SMDI décrit par Chen
et al.
[
16
]. SMDI :
subgingival microbial dysbiosis index.
|
Fer, hémochromatose et microbiotes buccaux
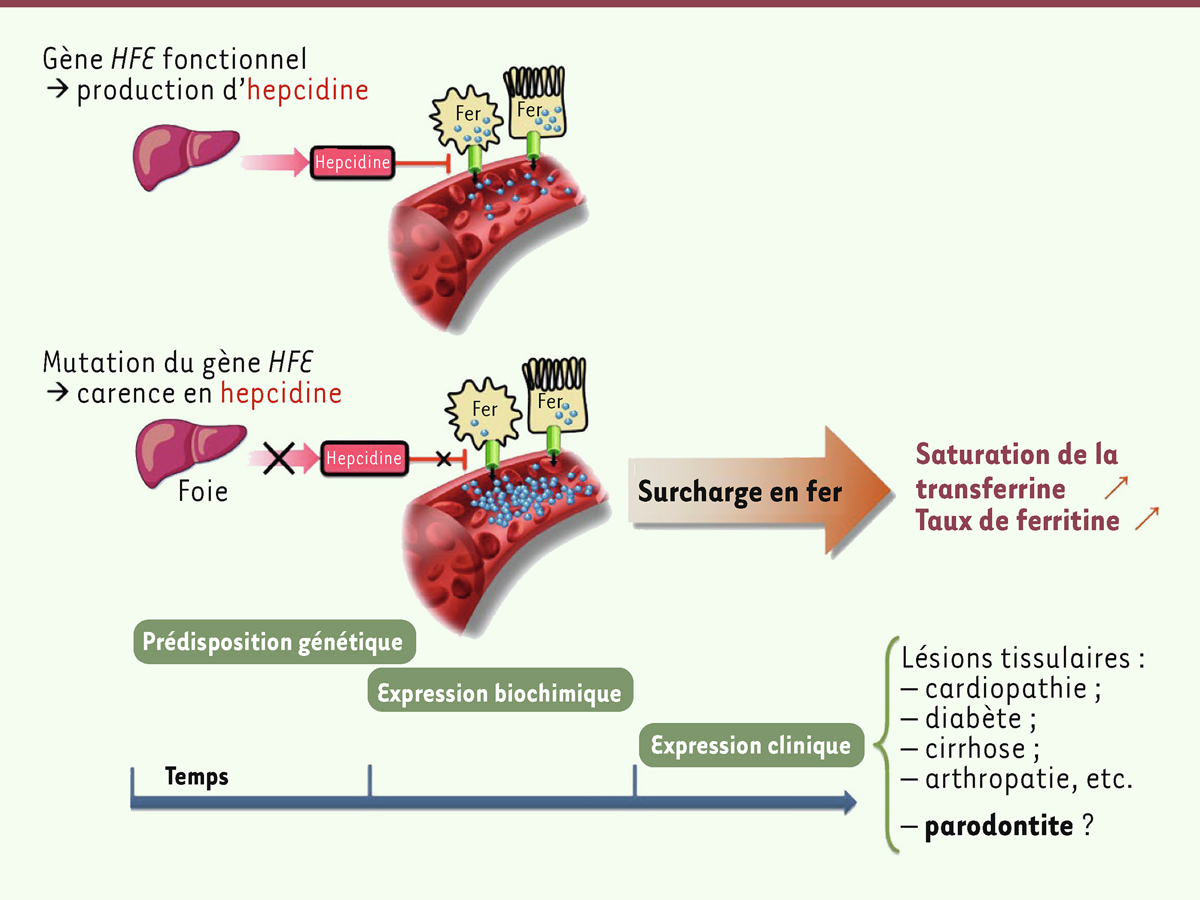
Le fer participe à la masse corporelle à hauteur de 35 à 45 mg par kg. Les deux tiers du fer se trouvent dans l’hémoglobine contenue dans les globules rouges, circulants ou en cours de maturation. Une grande partie est stockée dans le foie et les macrophages. Pour couvrir les pertes journalières, son absorption par l’intestin, de l’ordre de 1 à 2 mg par jour, est nécessaire. C’est l’hepcidine qui assure l’homéostasie du fer. Principalement synthétisée par le foie, l’hepcidine bloque l’export de fer sanguin, en dégradant le transporteur du fer cellulaire (la ferroportine). Elle réduit ainsi l’efflux de fer provenant des réserves et bloque l’absorption du fer alimentaire (
Figure 3
).
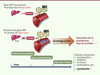 | Figure 3.
Hémochromatose : implication du gène
HFE
dans le contrôle par le foie de la production d’hepcidine régulant le fer dans l’organisme.
|
L’hémochromatose est une atteinte qui se caractérise par une hyperabsorption de fer par le tube digestif, résultant en une surcharge ferrique dans l’organisme. Génétiquement prédisposée, elle est d’abord quiescente, mais des perturbations biologiques, liées à un déficit d’hepcidine, peuvent ensuite apparaître de façon isolée avec une augmentation du coefficient de saturation de la transferrine, c’est-à-dire une augmentation du taux d’occupation des sites qui accueillent le fer (deux atomes de fer par protéine). Ses valeurs normales sont comprises entre 20 % et 45 % ; au-delà, des formes anormales et toxiques de fer (non liées à la transferrine) peuvent apparaître. La ferritine circulante, qui représente une quantité infime du fer circulant, augmente à son tour : au-delà de 300 μg par litre chez l’homme et 200 μg par litre chez la femme, sa concentration est considérée comme pathologique [
17
]. Des signes cliniques, ou des complications viscérales, pouvant mener au diagnostic, apparaissent vers l’âge de 35 à 40 ans chez les hommes et 45 à 50 ans chez les femmes. Ces symptômes sont liés à une accumulation progressive de fer depuis la naissance [
18
]. Lorsque la maladie s’exprime, des atteintes hépatiques (hépatomégalie et cirrhose), cutanées (hyperpigmentation grisâtre ou brune), ostéoarticulaires (arthropathie, déminéralisation osseuse), endocrinienne (diabète) et cardiaques (cardiomyopathie et insuffisance cardiaque) surviennent (
Figure 3
). Un diagnostic précoce évitera la majorité de ces complications, avec comme traitement des phlébotomies répétées (saignées).
Le terme d’hémochromatose est apparu en 1889. L’hypothèse d’une anomalie génétique et héréditaire a été avancée en 1977. La découverte du gène en cause,
HFE
(H pour
high
, élevé, et FE pour fer), est plus récente puisqu’elle date de 1996 [
19
]. Le gène
HFE
participerait à la détection du coefficient de saturation de la transferrine. Cela permettrait à l’hépatocyte de réguler sa production d’hepcidine selon le niveau de fer circulant [
20
]. L’hémochromatose héréditaire est plus couramment rencontrée chez les individus caucasiens [
21
]. Elle résulte de mutations dont les plus importantes sont les mutations du gène
HFE
(sur le chromosome 6) C282Y (p.Cys282Tyr) et H63D (p.His63Asp). La fréquence de la mutation C282Y est variable chez les européens (6,2 %, en moyenne). Elle est plus importante chez les descendants des populations d’Europe du Nord (1/10) [
22
] ; la Bretagne et l’Irlande présentent les plus fortes prévalences.
Chez les micro-organismes comme les bactéries, le fer est essentiel pour différentes fonctions dont la production d’énergie, la réplication de l’ADN, la protection contre le stress oxydant, etc. Pour pouvoir se développer, les bactéries ont donc des besoins en fer de l’ordre de la micromole (10
−6
mole.L
−1
) [
23
]. Cependant, les bactéries du microbiote humain, susceptibles de l’infecter, rencontrent un obstacle : la concentration de fer présent dans les fluides de l’organisme et librement accessible, c’est-à-dire non lié à une protéine. Celle-là se situe aux alentours de l’attomole (10
−18
mole.L
−1
) [
24
] et les bactéries doivent donc mettre en place des stratégies pour l’acquérir. Une surcharge en fer peut donc être un élément permettant à certaines d’entre elles de se multiplier et donc être à l’origine d’infection. Plusieurs cas d’infections bactériennes ont été observés chez des personnes ayant une maladie de surcharge en fer d’origine génétique [
25
,
26
].
Chez le sujet sain, la concentration de transferrine dans la salive est comprise entre 1 et 1,5 mg.L
−1
[
27
]. La transferrine et l’albumine sont également retrouvées dans le fluide gingival [
28
]. Dans un fluide gingival sain, la concentration en fer moyenne est estimée à 1 mg.L
−1
. Elle pourrait atteindre 5 mg.L
−1
chez les patients présentant une parodontite [
29
].
P. gingivalis
est auxotrophe pour le noyau protoporphyrine IX (PPIX) contenant du fer
1
. Elle possède néanmoins tout l’arsenal lui permettant de récupérer le fer de l’hème des globules rouges (hémagglutinines, protéases, transporteurs) libérés au cours de saignements gingivaux. Cette bactérie peut également croître en présence de transferrine humaine dont elle capte le fer en l’absence de saignement [
30
,
31
. Lorsque le milieu est déplété en fer, l’utilisation de la transferrine par
P. gingivalis
est accrue, montrant la capacité d’adaptation de la bactérie aux différentes sources de fer disponibles.
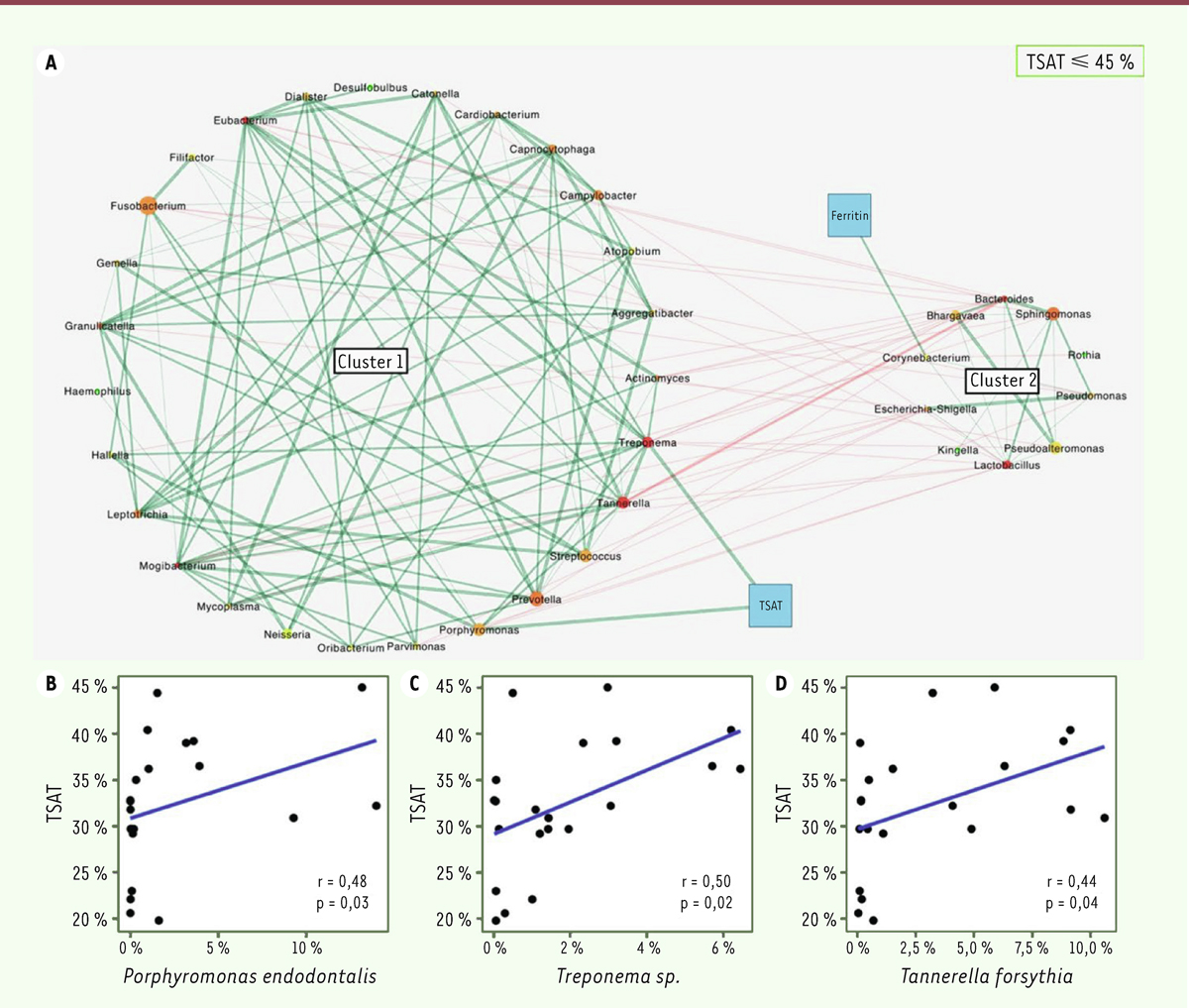
Étant donné l’importance du fer comme facteur favorable pour le développement des bactéries pathogènes parodontales et son influence sur l’inflammation, et considérant la susceptibilité à certains micro-organismes des patients hémochromatosiques, nous avons examiné le statut parodontal de ces patients en lien avec leur microbiote. Nous avons montré qu’en cas de saturation anormale de la transferrine (> 45 %), le risque de présenter une parodontite sévère est significatif (odds ratio = 5,49 – IC 95 % [1,85-16,28],
p
= 0,002), et cela en prenant en compte les variables confondantes que sont l’âge, le sexe, le statut tabagique, et l’indice de plaque. Les personnes souffrant d’hémochromatose héréditaire représentent une population à risque pour la parodontite, dont la sévérité est associée à la surcharge en fer [
32
]. Leurs microbiotes présentent une dysbiose qui est corrélée à la gravité de leur maladie [
33
]. Les bactéries de différents genres et de certaines espèces qui constituent leurs microbiotes sont capables de récupérer le fer de la transferrine. Chez les patients traités, donc non surchargés en fer, le nombre de ces bactéries est corrélé à la saturation en fer (
Figure 4
) [
34
].
 | Figure 4.
Corrélation entre le coefficient de saturation de la transferrine (TSAT) et les genres (A) et espèces (B) bactériens impliqués dans les parodontites chez les patients hémochromatosiques traités
(d’après [
34
]).
|
|
Les stéatopathies métaboliques (ou NAFLD pour
non-alcoholic fatty liver disease
) sont devenues la première cause d’hépatopathie chronique, avec une prévalence de 20 % en Europe. Le pronostic dépend du degré de la fibrose hépatique : un faible degré de fibrose (F0-F2) étant de bon pronostic et une fibrose sévère ou une cirrhose (F3-F4) exposant le patient à une surmortalité par maladies cardio-vasculaires, cancers et complications de la cirrhose.
La stéatose hépatique non alcoolique est une maladie associée au syndrome métabolique (obésité abdominale, diabète, hypertension artérielle, etc.). Elle est caractérisée par une accumulation de graisses dans le foie en dehors de toute consommation excessive d’alcool. Elle peut évoluer en stéato-hépatite non alcoolique [
35
].
Le stade de stéatose hépatique non alcoolique (NAFLD) est associé à une accumulation de triglycérides dans les hépatocytes. Dans cette forme de la maladie, des mesures hygiéno-diététiques peuvent permettre au foie de retrouver un aspect normal. Si la surcharge en triglycérides perdure, le foie devient inflammatoire : c’est le stade de la stéato-hépatite non alcoolique (NASH). En cas d’inflammation prolongée, la NASH évoluera vers la fibrose hépatite, puis vers la cirrhose, avec le risque de développer un cancer hépatique [
36
].
Le microbiote intestinal est un des facteurs étiologiques majeurs de la NAFLD, sa dysbiose est associée très étroitement à la sévérité de la fibrose. Les progrès des analyses de microbiotes ont permis de définir avec précision les différents microbiotes, dont le microbiote oral. Un lien physiopathologique entre constitution du microbiote oral et NAFLD a ainsi été identifié [
37
]. En effet, le microbiote buccal des patients présentant une NAFLD est caractérisé par une augmentation de la présence des bactéries à Gram négatif riches en lipopolysaccharides (LPS), telles que
P. gingivalis,
en dehors de toute infection buccale.
P. gingivalis
a également été retrouvée dans des biopsies hépatiques ; elle serait responsable d’une aggravation de la NAFLD en stimulant l’inflammation hépatique de manière chronique.
|
Un lien entre microbiote oral et NAFLD
Les stéatopathies métaboliques sont complexes et multifactorielles et les mécanismes physiopathologiques impliqués dans l’apparition de la NAFLD ne sont pas complètement compris. Plusieurs paramètres participent au développement de la maladie : l’accumulation de lipides dans le foie, la lipotoxicité, le stress oxydant, l’inflammation chronique, l’insulino-résistance, la sécrétion d’adipokines par le tissu adipeux, et des prédisposions génétiques [
38
].
Le rôle de la dysbiose du microbiote intestinal dans l’inflammation hépatique à l’origine des stéatopathies métaboliques est connu (
Figure 1
) [
39
]. Néanmoins, l’analyse récente du microbiome buccal a montré non seulement que certaines bactéries pathogènes induisaient des maladies bucco-dentaires locales, mais aussi qu’une dysbiose du microbiote buccal pouvait être à l’origine de diverses maladies systémiques, dont la NASH [
40
]. Plusieurs études ont en effet montré l’implication de
P. gingivalis
comme facteur de risque d’aggravation et/ou de mise en place de la NASH [
41
].
P. gingivalis
et son ADN ont été détectés dans les cavités buccales et dans le foie de patients souffrant de NAFLD, à une fréquence plus élevée que chez les individus qui ne présentent pas de stéatose [
41
]. Les patients présentant une NASH et infectés par
P. gingivalis
ont une fibrose plus sévère comparée à celle de patients sans infection [
42
]. L’infection par
P. gingivalis
peut stimuler l’accumulation de graisse dans le foie, augmenter la réponse immunitaire, et entraîner une résistance à l’insuline, montrant le potentiel rôle de
P. gingivalis
dans la progression de la NAFLD/NASH [
43
]. L’infection dentaire par
P. gingivalis
exacerbe en effet la fibrose de la NASH, en activant les cellules hépatiques impliquées dans le déclenchement de la fibrose[
44
]. En effet,
P. gingivalis
et ses métabolites, tels que le LPS et les gingipaïnes (des protéinases sécrétées par
P. gingivalis
) présents au niveau buccal, vont rejoindre la circulation sanguine et diffuser jusqu’au foie. Là, ils stimulent la production de cytokines pro-inflammatoires, comme l’IL(interleukine)-17
2
[
45
], qui vont activer les cellules hépatiques impliquées dans la fibrose, caractérisant le stade le plus sévère de la NASH.
|
La dysbiose du microbiote buccal est sous l’influence de nombreux facteurs, tels que la plaque dentaire, une réponse altérée de l’hôte, le tabac et les micronutriments minéraux comme le fer. L’étude de cette dysbiose a révélé son implication dans de nombreuses maladies dentaires, mais aussi dans la pathogenèse ou l’aggravation de maladies métaboliques (hémochromatose, diabète, polyarthrite rhumatoïde). Identifier les bactéries présentes dans ce microbiote et associées à la NAFLD, ainsi que déterminer leurs mécanismes d’action, devraient faire du microbiote buccal un biomarqueur de prédiction et de diagnostic précoce de maladies générales, et, ainsi, permettre le développement de thérapies ciblant ce microbiote. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Curtis
MA
,
Diaz
PI
,
Van Dyke
TE
.
The role of the microbiota in periodontal disease.
.
Periodontol 2000
.
2020;
;
83
:
:14.
–
25
.
2.
Graves
DT
,
Corrêa
JD
,
Silva
TA
.
The oral microbiota is modified by systemic diseases.
.
J Dent Res
.
2019;
;
98
:
:148.
–
156
.
3.
How
KY
,
Song
KP
,
Chan
KG
.
Porphyromonas gingivalis
: An overview of periodontopathic pathogen below the gum line
.
.
Front Microbiol
.
2016
;
:7.
.
4.
Jia
L
,
Han
N
,
Du
J
,
et al.
Pathogenesis of important virulence factors of Porphyromonas gingivalis via Toll-like receptors.
.
Front Cell Infect Microbiol
.
2019;
;
9
:
:262.
.
5.
Blasco-Baque
V
,
Garidou
L
,
Pomié
C
,
et al.
Periodontitis induced by Porphyromonas gingivalis drives periodontal microbiota dysbiosis and insulin resistance via an impaired adaptive immune response.
.
Gut
.
2017;
;
66
:
:872.
–
885
.
6.
Cani
PD
,
Amar
J
,
Iglesias
MA
et al.
Metabolic endotoxemia initiates obesity and insulin resistance.
.
Diabetes
.
2007;
;
56
:
:1761.
–
1772
.
7.
Thomas
C
,
Minty
M
,
Vinel
A
,
et al.
Oral microbiota: A major player in the diagnosis of systemic diseases.
.
Diagn Basel Switz
.
2021;
;
11
:
:1376.
.
8.
Stanko
P
,
Izakovicova
Holla L
.
Bidirectional association between diabetes mellitus and inflammatory periodontal disease. A review.
.
Biomed Pap
.
2014;
;
158
:
:35.
–
8
.
9.
Bender
P
,
Bürgin
WB
,
Sculean
A
et al.
Serum antibody levels against Porphyromonas gingivalis in patients with and without rheumatoid arthritis: A systematic review and meta-analysis.
.
Clin Oral Investig
.
2017;
;
21
:
:33.
–
42
.
10.
Lamont
RJ
,
Koo
H
,
Hajishengallis
G
.
The oral microbiota: dynamic communities and host interactions.
.
Nat Rev Microbiol
.
2018;
;
16
:
:745.
–
759
.
11.
Syed
SA
,
Loesche
WJ
.
Bacteriology of human experimental gingivitis: effect of plaque age.
.
Infect Immun
.
1978;
;
21
:
:821.
–
829
.
12.
Theilade
E.
.
The non-specific theory in microbial etiology of inflammatory periodontal diseases.
.
J Clin Periodontol
.
1986;
;
13
:
:905.
–
911
.
13.
Marsh
PD
.
Are dental diseases examples of ecological catastrophes?
.
Microbiol Read Engl
.
2003;
;
149
:
:279.
–
294
.
14.
Hajishengallis
G
,
Darveau
RP
,
Curtis
MA
.
The keystone-pathogen hypothesis.
.
Nat Rev Microbiol
.
2012;
;
10
:
:717.
–
725
.
15.
Meuric
V
,
Le Gall-David
S
,
Boyer
E
et al.
Signature of microbial dysbiosis in periodontitis.
.
Appl Environ Microbiol
.
2017;
;
83
:
:e00462.
–
e00417
.
16.
Chen
T
,
Marsh
PD
,
Al-Hebshi
NN
.
SMDI: An index for measuring subgingival microbial dysbiosis.
.
J Dent Res
.
2022;
;
101
:
:331.
–
8
.
17.
Brissot
P
,
Ropert
M
,
Le Lan
C
et al.
Non-transferrin bound iron: a key role in iron overload and iron toxicity.
.
Biochim Biophys Acta
.
2012;
;
1820
:
:403.
–
410
.
19.
Feder
JN
,
Gnirke
A
,
Thomas
W
et al.
A novel MHC class I-like gene is mutated in patients with hereditary haemochromatosis.
.
Nat Genet
.
1996;
;
13
:
:399.
–
408
.
20.
Roetto
A
,
Totaro
A
,
Piperno
A
et al.
New mutations inactivating transferrin receptor 2 in hemochromatosis type 3.
.
Blood
.
2001;
;
97
:
:2555.
–
2560
.
21.
Powell
LW
,
Seckington
RC
,
Deugnier
Y
.
Haemochromatosis.
.
Lancet
.
2016;
;
388
:
:706.
–
716
.
22.
O’Neil
J
,
Powell
L
.
Clinical aspects of hemochromatosis.
.
Semin Liver Dis.
.
2005;
;
25
:
:381.
–
391
.
23.
Weinberg
ED
.
Role of iron in host-parasite interactions.
.
J Infect Dis
.
1971;
;
124
:
:401.
–
410
.
24.
Bullen
JJ
.
The significance of iron in infection.
.
Rev Infect Dis
.
1981;
;
3
:
:1127.
–
1138
.
25.
Barton
JC
,
Acton
RT
.
Hemochromatosis and Vibrio vulnificus wound infections.
.
J Clin Gastroenterol
.
2009;
;
43
:
:890.
–
893
.
26.
Quenee
LE
,
Hermanas
TM
,
Ciletti
N
et al.
Hereditary hemochromatosis restores the virulence of plague vaccine strains.
.
J Infect Dis
.
2012;
;
206
:
:1050.
–
1058
.
27.
Kim
Y-J
,
Kim
Y-K
,
Kho
H-S
.
Effects of smoking on trace metal levels in saliva.
.
Oral Dis
.
2010;
;
16
:
:823.
–
830
.
28.
Curtis
MA
,
Sterne
JA
,
Price
SJ
et al.
The protein composition of gingival crevicular fluid sampled from male adolescents with no destructive periodontitis: baseline data of a longitudinal study.
.
J Periodontal Res
.
1990;
;
25
:
:6.
–
16
.
29.
Mukherjee
S.
.
The role of crevicular fluid iron in periodontal disease.
.
J Periodontol
.
1985;
;
56
:
:22.
–
27
.
30.
Inoshita
E
,
Iwakura
K
,
Amano
A
et al.
Effect of transferrin on the growth of Porphyromonas gingivalis.
.
J Dent Res
.
1991;
;
70
:
:1258.
–
1261
.
31.
Shizukuishi
S
,
Tazaki
K
,
Inoshita
E
et al.
Effect of concentration of compounds containing iron on the growth of Porphyromonas gingivalis.
.
FEMS Microbiol Lett
.
1995;
;
131
:
:313.
–
317
.
32.
Meuric
V
,
Lainé
F
,
Boyer
E
et al.
Periodontal status and serum biomarker levels in HFE hemochromatosis patients. A case series study.
.
J Clin Periodontol
.
2017;
;
44
:
:892.
–
897
.
33.
Boyer
E
,
Martin
B
,
Gall-David
SL
,
et al.
Periodontal pathogens and clinical parameters in chronic periodontitis.
.
Mol Oral Microbiol
.
2020;
;
35
:
:19.
–
28
.
34.
Boyer
E
,
Gall-David
SL
,
Martin
B
et al.
Increased transferrin saturation is associated with subgingival microbiota dysbiosis and severe periodontitis in genetic haemochromatosis.
.
Sci Rep
.
2018;
;
8
:
:15532.
.
35.
Maurice
J
,
Manousou
P
.
Non-alcoholic fatty liver disease.
.
Clin Med Lond Engl
.
2018;
;
18
:
:245.
–
250
.
36.
Team Review.
,
LaBrecque
DR
,
Abbas
Z
et al.
World Gastroenterology Organisation global guidelines: Nonalcoholic fatty liver disease and nonalcoholic steatohepatitis.
.
J Clin Gastroenterol
.
2014;
;
48
:
:467.
–
473
.
37.
Sasaki
N
,
Katagiri
S
,
Komazaki
R
et al.
Endotoxemia by Porphyromonas gingivalis Injection aggravates non-alcoholic fatty liver disease, disrupts glucose/lipid metabolism, and alters gut microbiota in Mice.
.
Front Microbiol
.
2018;
;
9
:
:2470.
.
38.
Pierantonelli
I
,
Svegliati-Baroni
G
.
Nonalcoholic fatty liver disease: basic pathogenetic mechanisms in the progression from NAFLD to NASH.
.
Transplantation
.
2019;
;
103
:
:e1.
.
39.
Brandl
K
,
Schnabl
B
.
Intestinal microbiota and nonalcoholic steatohepatitis.
.
Curr Opin Gastroenterol
.
2017;
;
33
:
:128.
–
133
.
40.
Wang
L
,
Mogami
S
,
Karasawa
H
et al.
Preventive effect of rikkunshito on gastric motor function inhibited by L-dopa in rats.
.
Peptides
.
2014;
;
55
:
:136.
–
144
.
41.
Yoneda
M
,
Naka
S
,
Nakano
K
et al.
Involvement of a periodontal pathogen, Porphyromonas gingivalis on the pathogenesis of non-alcoholic fatty liver disease.
.
BMC Gastroenterol
.
2012;
;
12
:
:16.
.
42.
Furusho
H
,
Miyauchi
M
,
Hyogo
H
et al.
Dental infection of Porphyromonas gingivalis exacerbates high fat diet-induced steatohepatitis in mice.
.
J Gastroenterol
.
2013;
;
48
:
:1259.
–
1270
.
43.
Hatasa
M
,
Yoshida
S
,
Takahashi
H
,
et al.
Relationship between NAFLD and periodontal disease from the view of clinical and basic research, and immunological response.
.
Int J Mol Sci
.
2021;
;
22
:
:3728.
.
44.
Nagasaki
A
,
Sakamoto
S
,
Chea
C
,
et al.
Odontogenic infection by Porphyromonas gingivalis exacerbates fibrosis in NASH via hepatic stellate cell activation.
.
Sci Rep
.
2020;
;
10
:
:4134.
.
45.
Tang
Y
,
Bian
Z
,
Zhao
L
,
et al.
Interleukin-17 exacerbates hepatic steatosis and inflammation in non-alcoholic fatty liver disease.
.
Clin Exp Immunol
.
2011;
;
166
:
:281.
–
290
.
|