| |
| Med Sci (Paris). 40(1): 35–41. doi: 10.1051/medsci/2023193.La parodontite : un risque sous-estimé des maladies cardiovasculaires Adrian Brun,1,2,3#* Catherine Petit,4,5,6#** Olivier Huck,4,5,6 Philippe Bouchard,1,2,7 Maria Clotilde Carra,2,7,8 and Marjolaine Gosset1,2,9 1
Unité de recherche URP2496,
Biomedical Research In Odontology
(BRIO)
,
France 2Université Paris Cité, faculté de santé, UFR d’odontologie
,
Montrouge
,
France 3Hôpital Henri Mondor (AP-HP), service de médecine bucco-dentaire
,
Créteil
,
France 4Laboratoire de nanomédecine régénérative, Inserm UMR 1260, CRBS
,
1 rue Eugène Boeckel
,
67000Strasbourg
,
France 5Département de parodontologie, faculté de chirurgie dentaire Robert Frank
,
Strasbourg
,
France 6Hôpitaux universitaires de Strasbourg, pôle de médecine et chirurgie bucco-dentaire
,
Strasbourg
,
France 7Hôpital Rothschild (AP-HP), service d’odontologie
,
5 rue Santerre75012Paris 8Epidemiology and Statistics Research Centre
, Inserm UMR1153
,
Paris
,
France 9Hôpital Charles Foix (AP-HP), service de médecine bucco-dentaire
,
Ivry/Seine
,
France |
Vignette (© Thibault Canceill).
Afin de réduire la morbidité et la mortalité dues aux maladies cardiovasculaires (MCV, ou CVD pour
cardiovascular disease
) causées par l’athérosclérose (ou AS-CVD) (
Encadré 1
), il convient d’identifier la nature du risque résiduel. En d’autres termes, comment expliquer que des patients dont les facteurs de risque classiques de l’athérosclérose sont maîtrisés, restent susceptibles de présenter un évènement cardiovasculaire tel qu’un infarctus du myocarde (IM), un accident vasculaire cérébral (AVC) ou une artérite des membres inférieurs (AMI) ? L’identification et la maîtrise d’autres facteurs de risque sont donc un enjeu et, ces dernières années, la parodontite sévère a été identifiée comme un des facteurs contribuant au risque cardiovasculaire.
La parodontite (
Figure 1
) est une maladie inflammatoire chronique des tissus de soutien des dents dont le facteur étiologique principal est la dysbiose du microbiote parodontal
1
. Elle se caractérise cliniquement par la destruction irréversible du parodonte pouvant évoluer, en l’absence de traitement, jusqu’à la perte dentaire. Cette maladie est très prévalente : elle concerne 83 % des personnes âgées de plus de 65 ans et, dans ses formés sévères, 11 % de la population adulte mondiale [
1
,
2
. Elle est pourtant facile à prévenir et à soigner dans ses formes débutantes, ce qui pourrait conduire à une réduction du risque pour la santé orale et cardiovasculaire. Le lien entre parodontite et athérome constitue donc une thématique de recherche d’intérêt en termes de santé publique. On observe par ailleurs un regain d’intérêt concernant l’étude du lien entre le microbiote oral, l’oralome
2
et les maladies cardiovasculaires [
3
]. Se posent alors quatre questions auxquelles nous tentons de répondre :
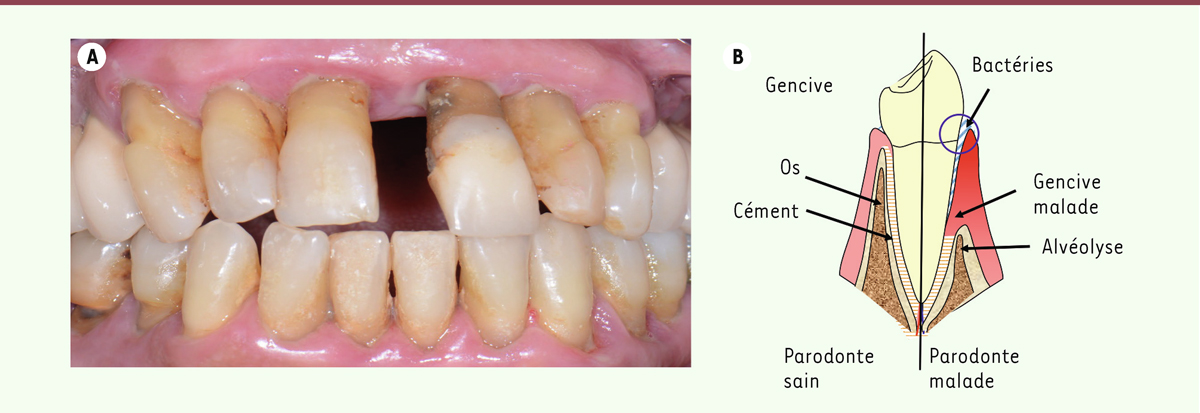
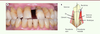 | Figure 1.
La parodontite. A.
Patiente de 62 ans, sans antécédent médical rapporté présentant une parodontite sévère et de réhabilitation complexe (stade IV), d’évolution rapide (grade C) généralisée. La patiente présente par ailleurs plusieurs facteurs de risque cardiovasculaire (surpoids, tabac).
B.
Représentation schématique du parodonte sain et atteint de parodontite : le parodonte est l’ensemble des tissus de soutien de la dent ; il est composé de la gencive, de l’os parodontal, du cément et de l’attache parodontale qui lie la dent à l’os alvéolaire. Face à une dysbiose orale, en présence de facteurs de risque, l’inflammation gingivale entraine la destruction de l’attache parodontale et de l’os de soutien des dents, générant une poche parodontale entre la gencive et la dent. Cliniquement, l’inflammation gingivale s’observe (aspect rouge, œdématié, avec d’éventuelles suppurations) et l’exposition des racines dans la cavité buccale témoigne de la destruction parodontale.
|
|
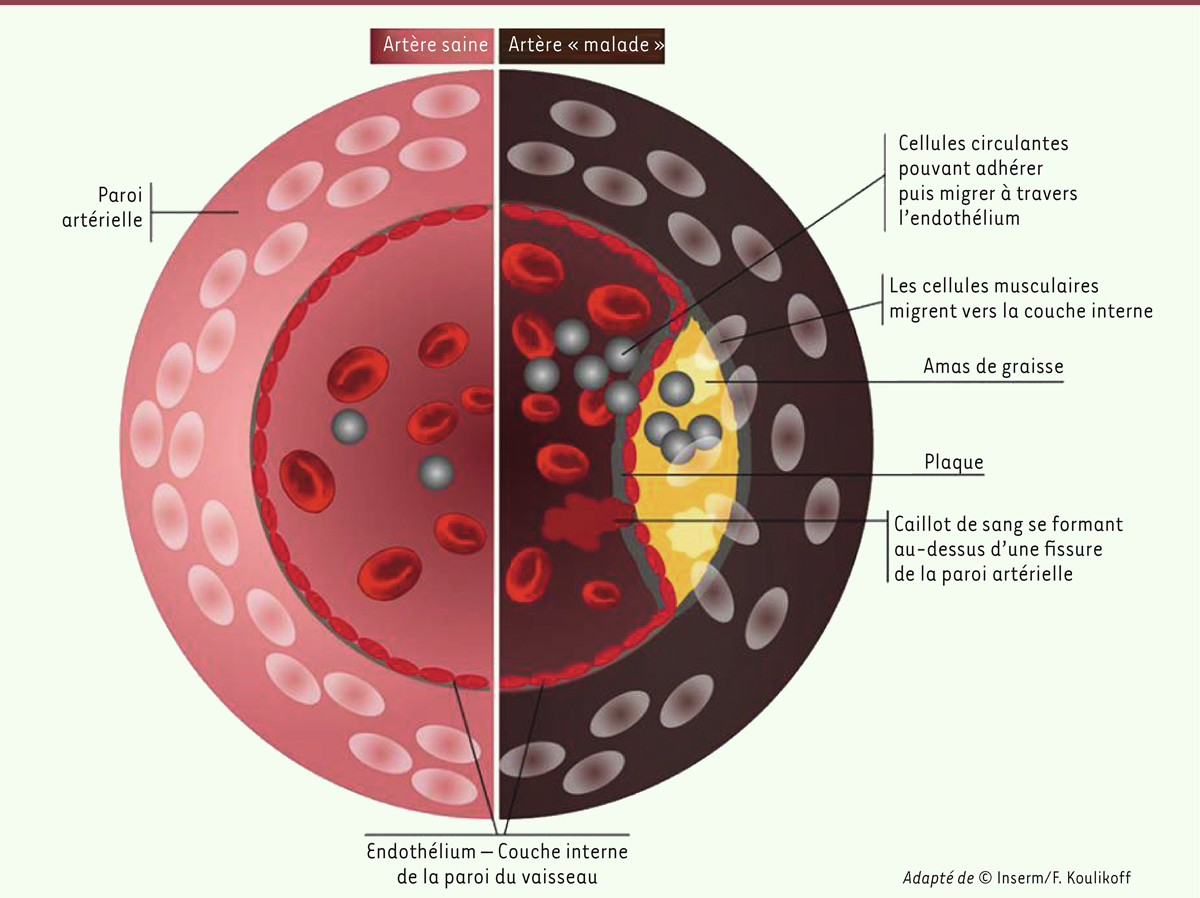
Au cours de la vie, un mécanisme d’obstruction des artères de moyen et gros calibres, nommé athérosclérose (
Figure 2
), se développe et évolue en fonction de contraintes et facteurs associés. Le processus d’athérosclérose débute dès l’enfance et est influencé par de nombreux facteurs de risque dont les plus connus sont le tabac, le diabète, le surpoids, l’hypertension, l’hypercholestérolémie, l’alcool, ou encore la sédentarité [
53
]. Il correspond au développement d’une plaque (d’athérome), essentiellement composée de lipides dans sa phase initiale, au sein de la paroi artérielle, dans des zones préférentielles du système circulatoire où le flux sanguin est perturbé (par exemple, la bifurcation carotidienne). À terme, ces plaques peuvent subir de nombreux remaniements entraînant la transformation de la paroi artérielle (sclérose), conduire à l’obstruction du vaisseau, ou encore se rompre et entraîner la libération d’un embole qui circule dans le sang jusqu’à obstruer une artère à distance (on parle alors d’athérothrombose), avec des conséquences souvent dramatiques. Les plaques les plus vulnérables à la rupture sont celles qui présentent une hémorragie intraplaque [
54
,
55
]. L’obstruction d’une artère empêche le glucose et l’oxygène d’atteindre les tissus périphériques, ce qui entraîne une nécrose du tissu [
56
]. Lorsqu’il s’agit d’une artère cérébrale, on parle d’AVC ischémiques, qui représentent la majorité des AVC. Lorsqu’une artère coronaire est obstruée, on parle d’infarctus du myocarde (IDM).
|
 | Figure 2. Schéma d’une paroi artérielle saine comparée à celle atteinte d’athérosclérose. |
1 - L’association entre parodontite et MCV est-elle confirmée ? 2 - Cette association est-elle expliquée par un lien biologique ? 3 - Le traitement parodontal a-t-il un impact sur le risque cardiovasculaire ? 4 - Un lien causal peut-il être évoqué entre les deux maladies ? |
L’association entre parodontite et MCV est-elle confirmée ? Les études observationnelles sur l’association entre parodontite et MCV sont nombreuses mais se heurtent à des écueils méthodologiques spécifiques. Les critères d’évaluation sont le plus souvent des variables de substitution (ou proxys) et rarement des événements. Les indicateurs cliniques parodontaux sont souvent hétérogènes et la qualité des données est variable d’une source à l’autre, certaines provenant de bases de données de compagnies d’assurance, de cohortes digitales ou de registres nationaux. Les études sont principalement conduites dans des pays industrialisés. Enfin, nous ne possédons aucune donnée concernant les préventions primordiales et primaires.
Néanmoins, en 2019, la synthèse des études épidémiologiques explorant l’association entre parodontite et MCV, réalisée à la suite de la conférence de consensus entre l’
European Federation of Periodontology
et la
World Heart Federation
[
4
], et récemment actualisée [
58
], confirme une association
indépendante
entre parodontite et athérosclérose. Cette association, à l’instar de celle entre parodontite et hypertension artérielle, ne semble donc plus aujourd’hui discutable.
Cependant, la question de savoir si la parodontite doit être considérée comme un marqueur ou un indicateur de risque (c’est-à-dire associée mais sans relation causale) ou comme un facteur de risque (c’est-à-dire un facteur causal de l’athérosclérose et de ses conséquences cliniques) reste posée.
Pour répondre à cette question, il faudrait disposer d’essais cliniques randomisés de bonne qualité démontrant que le traitement d’une parodontite prévient un événement cardiovasculaire quel qu’il soit (IM, AVC, AMI), ce dont nous ne disposons pas actuellement. De plus, tous les critères de causalité classiques de Bradford Hill
3
ne sont pas satisfaits, en particulier en ce qui concerne la spécificité et la temporalité. Les études ne montrent pas toutes les mêmes résultats et il n’est pas démontré que la parodontite précède toujours l’événement cardiovasculaire. Néanmoins, nous savons qu’un traitement parodontal améliore les marqueurs de l’athérosclérose. Il est possible que la parodontite ne soit pas une cause nécessaire et suffisante (une cause produit un effet) mais simplement une cause suffisante appartenant à un panel de risques qui entraînerait l’événement. Cette approche proposée par Rothman semble bien correspondre à une causalité sous-jacente entre les deux maladies [
5
]. Mais la question la plus importante liée à cette association n’est peut-être pas la causalité. Des facteurs de risque communs pourraient conduire à la fois à la parodontite et à la MCV, déterminant ainsi un « terrain commun » (
Figure 3
). Dans cette perspective, la parodontite ne serait pas une cause contributive à la MCV mais l’une des multiples manifestations cliniques des facteurs de risque partagés. Cela pourrait inaugurer une approche de prévention bidirectionnelle, le patient parodontal étant à risque de MCV, mais aussi, le patient à risque de MCV étant à risque de parodontite.
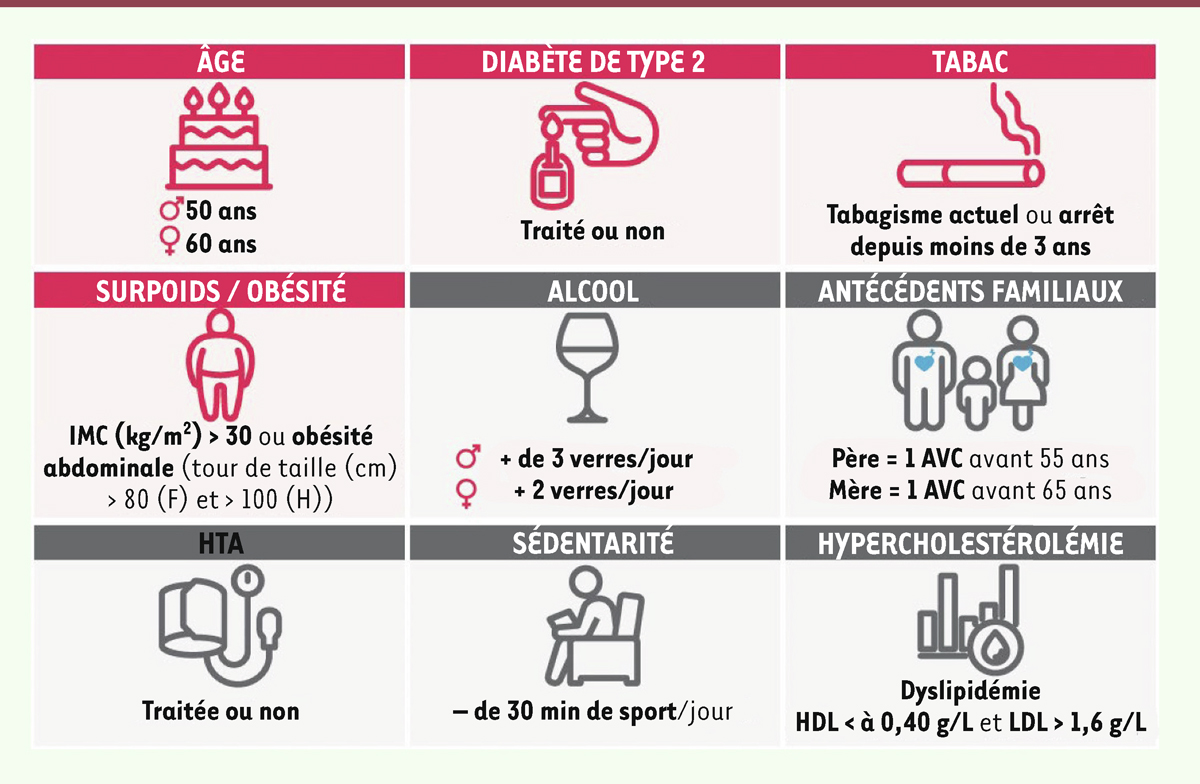
 | Figure 3.
Facteurs de risque des maladies cardiovasculaires et facteurs de risque des parodontites.
Sont représentés en rouge les facteurs de risque communs aux maladies cardiovasculaires et aux maladies parodontales parmi l’ensemble des facteurs de risque des maladies cardiovasculaires (gris et rouge). Schéma issu de la brochure d’information de la SFPIO, d’iVasc et de Meridol sur les relations entre Parodontite et MCV.
|
|
L’association entre parodontite et MCV peut-elle être expliquée par un lien biologique ?
Les parodontites sont associées à une inflammation systémique de bas grade et à des bactériémies chroniques de faible intensité. Le passage de bactéries parodontales (dont le pouvoir pathogène intrinsèque est limité) dans la circulation sanguine existe lors de gestes de la vie quotidienne (mastication, brossage dentaire) [
6
], comme lors de certains soins dentaires dits invasifs (avec effraction de la barrière épithéliale, par exemple lors d’avulsions dentaires [ou extractions], d’un détartrage sous-gingival, d’un débridement, ou d’un surfaçage) [
7
]. Ces bactéries (
Porphyromonas gingivalis, Tannerella forsythia, Treponema denticola,
etc.) pourront alors se greffer dans des sites d’angiogenèse, telles que les plaques d’athérome au niveau des artères carotides [
8
] et coronaires [
9
]. Cette greffe pourrait s’expliquer par un tropisme particulier des bactéries pour les caillots sanguins [
10
,
11
et favoriser la vulnérabilité accrue de la plaque à la rupture [
12
]. À cet égard, des études récentes ont montré que la prévalence des MCV est augmentée en fonction du nombre de pathogènes identifiés : le risque d’AVC [
13
] et l’épaisseur des plaques carotidiennes [
14
] augmentent chez des patients hébergeant au moins cinq agents pathogènes.
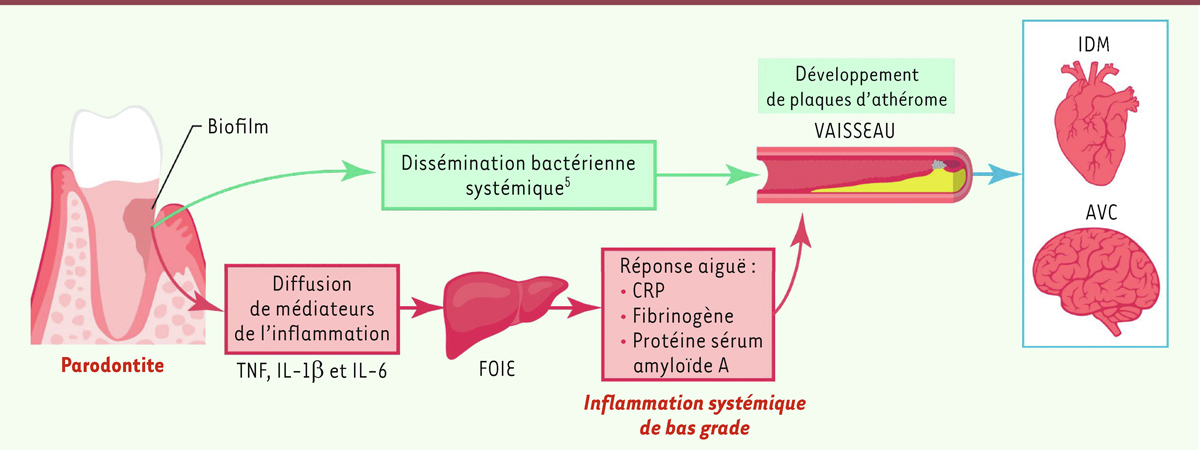
D’un point de vue mécanistique, les bactéries parodontales et l’inflammation qui résulte de leur présence favoriseraient l’athérosclérose et ses conséquences (
Figure 4
), selon plusieurs hypothèses [
15
,
16
].
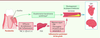 | Figure 4.
Représentations des liens entre la composante inflammatoire et bactérienne des parodontites et les maladies cardiovasculaires
(figure adaptée de [
17
]). Schéma issu de la brochure d’information de la SFPIO, d’iVasc et de Meridol sur les relations entre Parodontite et MCV.
|
La théorie dite du « cheval de Troie »
Les bactéries pourraient infecter et survivre dans les leucocytes en circulation pour se disséminer jusqu’aux plaques d’athérome (théorie dite du « cheval de Troie ») [
17
]. L’expression des facteurs de virulence bactériens (gingipaïnes, lipopolysaccharides, fimbriae, etc.) au sein de la plaque la fragiliserait jusqu’à sa rupture, et limiterait sa cicatrisation. Notons que les études confirmant la viabilité des bactéries au sein des cellules vasculaires présentes dans les plaques d’athérome restent peu nombreuses [
18
].
Une réponse immunitaire innée disproportionnée
La fixation des bactéries orales (intactes, sous forme de débris, transportées par des leucocytes ou circulant librement dans le sang) au niveau de la plaque d’athérome et du thrombus (dans un contexte d’athérothrombose) (
Figure 5
) entraînerait une réponse immunitaire innée locale disproportionnée, caractérisée notamment par un recrutement plus important de polynucléaires neutrophiles et à leur activation à l’origine d’une dégranulation d’enzymes protéolytiques, comme les métalloprotéases ou la myéloperoxidase, fragilisant la plaque [
19
,
20
.
P. gingivalis
faciliterait également la différenciation des macrophages en cellules spumeuses, un phénotype (phénotype M1 pro-inflammatoire) favorisant l’athérosclérose et entraînant la déstabilisation de la plaque [
21
]. La bactérie exercerait également ses activités « pro-athérosclérotiques » sur les cellules endothéliales, les plaquettes ou les lymphocytes T [
16
].
 | Figure 5.
Identification in situ de bactéries parodontales dans une plaque d’athérome.
Coupe transversale d’une plaque d’athérome carotidienne humaine traitée à l’EDTA. La présence de
Porphyromonas gingivalis
est déterminée par immunofluorescence (en vert). Les noyaux cellulaires sont colorés en bleu par le DAPI.
|
L’implication de protéines de phase aiguë produites par le foie
Les médiateurs inflammatoires systémiques provenant du parodonte, ou de l’interaction des micro-organismes parodontaux avec les cellules inflammatoires dans des sites éloignés de la cavité orale, conduiraient à une sécrétion de protéines de phase aiguë par le foie (protéine C réactive [CRP], fibrinogène), des marqueurs dont l’expression est corrélée au risque d’accident vasculaire. Ces protéines favoriseraient la mise en place d’un état « pro-thrombotique » de l’endothélium vasculaire qui faciliterait l’initiation et l’accélération du développement des plaques d’athérome [
22
].
Un mimétisme moléculaire
Les anticorps produits en réponse à la présence de bactéries parodontales reconnaîtraient le soi comme un pathogène, promouvant le développement des plaques d’athérome [
23
]. Ce phénomène dit de « réactivité croisée » repose sur un mécanisme de mimétisme moléculaire. Une étude a mis en évidence l’existence d’un sous-groupe important de patients atteints de parodontite qui présentaient des concentrations élevées d’anticorps dirigés contre la cardiolipine
4
, des auto-anticorps pro-thrombotiques associés à l’athérosclérose, dans le fluide gingival et le sérum [
24
].
Une reprogrammation épigénétique
L’infection par
P. gingivalis
induirait une reprogrammation épigénétique des cellules progénitrices de la moelle osseuse, ce qui conduirait à une production accrue de cellules myéloïdes ayant une capacité pro-inflammatoire augmentée (un mécanisme appelé immunité innée entraînée ou
trained immunity
) [
25
].
Les modèles précliniques
Pour étudier le rôle de la parodontite dans l’athérosclérose, plusieurs équipes se sont appuyées sur des modèles précliniques. Dans un modèle d’infection par
P. gingivalis
par gavage oral, comme dans un modèle d’injection intraveineuse, le développement de la plaque d’athérome est accéléré chez des souris génétiquement déficientes en apolipoprotéine E (les souris ApoE
-/-
, un modèle classique d’athérosclérose) en comparaison de souris contrôles [
26
,
27
. Un dysfonctionnement endothélial, caractéristique d’une réponse de vasodilatation de l’endothélium induite par l’acétylcholine, a été retrouvé chez ces souris [
28
].
Dans un modèle murin d’anévrisme de l’aorte abdominale induit par chirurgie, l’injection intraveineuse de
P. gingivalis
est à l’origine d’une augmentation significative de la taille de l’anévrisme, associée à un recrutement de polynucléaires neutrophiles et à une agrégation plaquettaire [
29
]. Des études récentes ont également mis en évidence un rôle d’autres bactéries parodontales dans ces mécanismes, dont
Fusobacterium nucleatum
[
30
].
Enfin, des modifications du microbiote intestinal en réponse à la parodontite et l’infection par
P. gingivalis
chez la souris ApoE
-/-
induisent l’augmentation de métabolites intestinaux dont le triméthylamine N-oxyde (TMAO) en est un exemple, pouvant jouer sur l’accélération de l’athérosclérose [
31
].
|
Le traitement parodontal a-t-il un impact sur le risque cardiovasculaire ?
Le traitement parodontal non chirurgical, avec l’acquisition de comportements favorables à la santé orale (maîtrise des techniques d’hygiène orale) et l’instrumentation mécanique supra- et sous-gingivale, vise à perturber le microbiote à l’origine de la réponse inflammatoire de l’hôte. La prise en charge des facteurs de risque comportementaux, locaux, environnementaux et des maladies systémiques associées à un traitement de soutien parodontal régulier est nécessaire pour réduire le risque de progression de la parodontite [
32
].
De nombreuses études cliniques ont montré qu’un traitement parodontal efficace pourrait également avoir des répercussions systémiques, notamment chez les patients à risque de CV. Plusieurs essais contrôlés randomisés ont montré une amélioration de la fonction endothéliale (dilatation des vaisseaux sous l’effet du flux sanguin) [
33
–
35
], une diminution de la pression artérielle [
34
,
36
, et une diminution de l’épaississement de l’intima-média carotidienne [
37
,
38
, à la suite du traitement parodontal, réduisant ainsi le risque de survenue de maladie cardiovasculaire. De même, l’amélioration de l’état parodontal a été associé à une réduction des marqueurs sériques de l’inflammation de bas grade, tels la CRP et l’IL (interleukine)-6, dans de nombreux essais cliniques [
33
,
34
,
36
,
39
]. L’amélioration de ces paramètres de la santé cardiovasculaire, suite au traitement parodontal, est d’autant plus notable chez les patients souffrant de comorbidités, comme les patients diabétiques [
34
] ou les patients ayant des antécédents de MCV [
40
]. En revanche, le traitement parodontal semble avoir un impact négligeable sur les marqueurs du métabolisme lipidiques, comme le cholestérol total, les lipoprotéines de faible densité (LDL), les triglycérides et les lipoprotéines de haute densité (HDL) [
4
,
40
].
|
Un lien causal peut-il être évoqué entre les deux maladies ?
En cas de parodontite, la littérature rapporte une augmentation du risque de survenue d’un premier infarctus du myocarde (entre 1,28 [95 % CI : 1,03-1,60] et 2,53 [95 % CI : 1,927 – 3,324] [41–43]), une hausse du risque d’AVC (de 1,6 [95 % CI : 1,25-2,00] à 2,88 [95 % CI : 1,53 – 5,41] [
44
,
45
), une élévation du risque de maladie coronarienne (de 1,14 [95 % CI : 1,074-1,213] [
6
]) et une hausse du risque d’athérosclérose de la carotide (de 1,27 [95 % CI : 1,14-1,41] [
47
]). Les risques d’AVC [
48
] et d’hypertension artérielle [
49
] semblent augmenter avec la sévérité de la parodontite.
A contrario
, plusieurs études de cohorte rapportent une diminution de la survenue d’infarctus du myocarde [
50
,
51
et une baisse des AVC [
48
] chez les patients ayant bénéficié d’un traitement parodontal. Cependant, ces résultats épidémiologiques relevant une association entre la parodontite et l’athérosclérose ne permettent pas de définir la parodontite comme un facteur causal indépendant dans l’apparition et la progression des MCV, ces deux pathologies partageant des facteurs de risques similaires parmi lesquels le tabagisme, l’obésité et le diabète. Seule une étude semble suggérer un lien, indépendant de tout autre facteur, entre la parodontite et la MCV. Dans cette étude ayant suivi 304 patients pendant quatre ans, les auteurs montrent que l’inflammation parodontale est associée à l’inflammation artérielle et au risque de survenue d’évènements cardiovasculaires majeurs, indépendamment de tout autre facteur de risque [
52
]. Si les conclusions de l’article suggèrent une relation de causalité entre MCV et parodontite, elles ne se basent que sur des évènements cardiovasculaires survenus chez 13 des 304 patients. Bien que la méthodologie de l’étude soit intéressante, un suivi d’un plus grand nombre de patients, sur une plus longue, serait nécessaire pour conclure sur la puissance de cette relation de causalité.
|
La prévention et le traitement des maladies parodontales pourraient jouer un rôle dans la prévention des maladies cardiovasculaires, en particulier chez les personnes à haut risque, en raison d’un antécédent d’évènement cardiovasculaire (AVC, IM, AMI), ou simplement de l’existence de comorbidités (comme le diabète). La grande prévalence des parodontites, leur facilité de prévention et de traitement, associées à la gravité des événements cardiovasculaires lorsqu’ils surgissent, créent les conditions d’un suivi parodontal régulier et spécifique chez les sujets à risque de maladies cardiovasculaires athérosclérotiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Chen
MX
,
Zhong
YJ
,
Dong
QQ
,
et al.
Global, regional, and national burden of severe periodontitis, 1990–2019 : An analysis of the Global Burden of Disease Study 2019.
.
J Clin Periodontol
.
2021;
;
48
:
:1165.
–
88
.
2.
Trindade
D
,
Carvalho
R
,
Machado
V
,
et al.
Prevalence of periodontitis in dentate people between 2011 and 2020: A systematic review and meta-analysis of epidemiological studies.
.
J Clin Periodontol
.
2023;
;
50
:
:604.
–
26
.
3.
Tonelli
A
,
Lumngwena
EN
,
Ntusi
NAB
.
The oral microbiome in the pathophysiology of cardiovascular disease.
.
Nat Rev Cardiol
.
2023;
;
20
:
:386.
–
403
.
4.
Sanz
M
,
Marco Del Castillo
A
,
Jepsen
S
,
et al.
Periodontitis and cardiovascular diseases : Consensus report.
.
J Clin Periodontol
.
2020;
;
47
:
:268.
–
88
.
5.
Rothman KJ.
Causes.
.
Am J Epidemiol
.
1976;
;
104
:
:587.
–
592
.
6.
Tomás
I
,
Diz
P
,
Tobías
A
,
et al.
Periodontal health status and bacteraemia from daily oral activities : systematic review/meta-analysis.
.
J Clin Periodontol
.
2012;
;
39
:
:213.
–
28
.
7.
Horliana
ACRT
,
Chambrone
L
,
Foz
AM
,
et al.
Dissemination of periodontal pathogens in the bloodstream after periodontal procedures : a systematic review.
.
PloS One
.
2014;
;
9
:
:e98271.
.
8.
Figuero
E
,
Sánchez-Beltrán
M
,
Cuesta-Frechoso
S
,
et al.
Detection of periodontal bacteria in atheromatous plaque by nested polymerase chain reaction.
.
J Periodontol
.
2011;
;
82
:
:1469.
–
77
.
9.
Mahalakshmi
K
,
Krishnan
P
,
Arumugam
SB
.
Association of periodontopathic anaerobic bacterial co-occurrence to atherosclerosis - A cross-sectional study.
.
Anaerobe
.
2017;
;
44
:
:66.
–
72
.
10.
Engelmann
B
,
Massberg
S
.
Thrombosis as an intravascular effector of innate immunity.
.
Nat Rev Immunol
.
2013;
;
13
:
:34.
–
45
.
11.
Massberg S,
Grahl L,
von Bruehl M-L.
et al.
Reciprocal coupling of coagulation and innate immunity via neutrophil serine proteases.
.
Nat Med
.
2010;
;
16
:
:887.
–
896
.
12.
Brun
A
,
Nuzzo
A
,
Prouvost
B
,
et al.
Oral microbiota and atherothrombotic carotid plaque vulnerability in periodontitis patients. A cross-sectional study.
.
J Clin Periodontol
.
2021;
;
56
:
:339.
–
50
.
13.
Elkind
MSV
,
Ramakrishnan
P
,
Moon
YP
et al.
Infectious burden and risk of stroke : the northern Manhattan study.
.
Arch Neurol
.
2010;
;
67
:
:33.
–
38
.
14.
Elkind
MSV
,
Luna
JM
,
Moon
YP
et al.
Infectious burden and carotid plaque thickness : the northern Manhattan study.
.
Stroke
.
2010;
;
41
:
:e117.
–
e122
.
15.
Schenkein
HA
,
Papapanou
PN
,
Genco
R
,
et al.
Mechanisms underlying the association between periodontitis and atherosclerotic disease.
.
Periodontol 2000
.
2020;
;
83
:
:90.
–
106
.
16.
Ruan
Q
,
Guan
P
,
Qi
W
,
et al.
Porphyromonas gingivalis regulates atherosclerosis through an immune pathway.
.
Front Immunol
.
2023;
;
14
:
:1103592.
.
17.
Zheng
S
,
Yu
S
,
Fan
X
,
et al.
Porphyromonas gingivalis survival skills : Immune evasion.
.
J. Periodontal Res
.
2021;
;
56
:
:1007.
–
18
.
18.
Kozarov
EV
,
Dorn
BR
,
Shelburne
CE
et al.
Human atherosclerotic plaque contains viable invasive Actinobacillus actinomycetemcomitans and Porphyromonas gingivalis.
.
Arterioscler Thromb Vasc Biol
.
2005;
;
25
:
:e17.
–
e18
.
19.
Rangé H,
Labreuche
J
,
Louedec
L
,
et al.
Periodontal bacteria in human carotid atherothrombosis as a potential trigger for neutrophil activation.
.
Atherosclerosis
.
2014;
;
236
:
:448.
–
55
.
20.
Silvestre-Roig
C
,
Braster
Q
,
Ortega-Gomez
A
,
et al.
Neutrophils as regulators of cardiovascular inflammation.
.
Nat Rev Cardiol
.
2020;
;
17
:
:327.
–
40
.
21.
Lin
J
,
Huang
D
,
Xu
H
,
et al.
Macrophages : A communication network linking Porphyromonas gingivalis infection and associated systemic diseases.
.
Front Immunol
.
2022;
;
13
:
:952040.
.
22.
Huck
O
,
Elkaim
R
,
Davideau
J-L
,
et al.
Porphyromonas gingivalis-impaired innate immune response via NLRP3 proteolysis in endothelial cells.
.
Innate Immun
.
2015;
;
21
:
:65.
–
72
.
23.
Schenkein
HA
,
Loos
BG
.
Inflammatory mechanisms linking periodontal diseases to cardiovascular diseases.
.
J Clin Periodontol
.
2013;
;
40
:
:S51.
–
69
.
24.
Chen
Y-W
,
Nagasawa
T
,
Wara-Aswapati
N
,
et al.
Association between periodontitis and anti-cardiolipin antibodies in Buerger disease.
.
J Clin Periodontol
.
2009;
;
36
:
:830.
–
5
.
25.
Omar
M
,
Alexiou
M
,
Rekhi
UR
,
et al.
DNA methylation changes underlie the long-term association between periodontitis and atherosclerotic cardiovascular disease.
.
Front Cardiovasc Med
.
2023;
;
10
:
:1164499.
.
26.
Lalla
E
,
Lamster
IB
,
Hofmann
MA
et al.
Oral infection with a periodontal pathogen accelerates early atherosclerosis in apolipoprotein E-null mice.
.
Arterioscler Thromb Vasc. Biol
.
2003;
;
23
:
:1405.
–
1411
.
27.
Li
L
,
Messas
E
,
Batista
EL
et al.
Porphyromonas gingivalis infection accelerates the progression of atherosclerosis in a heterozygous apolipoprotein E-deficient murine model.
.
Circulation
.
2002;
;
105
:
:861.
–
867
.
28.
Parvaneh
M
,
Witting
PK
,
Ku
J
,
et al.
Periodontitis induces endothelial dysfunction in mice.
.
Sci Rep
.
2021;
;
11
:
:14993.
.
29.
Delbosc
S
,
Alsac
J-M
,
Journe
C
,
et al.
Porphyromonas gingivalis participates in pathogenesis of human abdominal aortic aneurysm by neutrophil activation. Proof of concept in rats.
.
PloS One
.
2011;
;
6
:
:e18679.
.
30.
Zhou
L-J
,
Lin
W-Z
,
Meng
X-Q
,
et al.
Periodontitis exacerbates atherosclerosis through Fusobacterium nucleatum-promoted hepatic glycolysis and lipogenesis.
.
Cardiovasc Res
.
2023
;
:cvad045.
.
31.
Xiao
L
,
Huang
L
,
Zhou
X
,
et al.
Experimental Periodontitis Deteriorated Atherosclerosis Associated With Trimethylamine N-Oxide Metabolism in Mice.
.
Front Cell Infect Microbiol
.
2021;
;
11
:
:820535.
.
32.
Sanz
M
,
Herrera
D
,
Kebschull
M
,
et al.
Treatment of stage I-III periodontitis-The EFP S3 level clinical practice guideline.
.
J Clin Periodontol
.
2020;
;
(47 Suppl)
22
:
:4.
–
60
.
33.
Higashi
Y
,
Goto
C
,
Hidaka
T
,
et al.
Oral infection-inflammatory pathway, periodontitis, is a risk factor for endothelial dysfunction in patients with coronary artery disease.
.
Atherosclerosis
.
2009;
;
206
:
:604.
–
10
.
34.
D’Aiuto F,
Gkranias
N
,
Bhowruth
D
,
et al.
Systemic effects of periodontitis treatment in patients with type 2 diabetes : a 12 month, single-centre, investigator-masked, randomised trial.
.
Lancet Diabetes Endocrinol
.
2018;
;
6
:
:954.
–
65
.
35.
Saffi
MAL
,
Rabelo-Silva
ER
,
Polanczyk
CA
,
et al.
Periodontal therapy and endothelial function in coronary artery disease : A randomized controlled trial.
.
Oral Dis
.
2018;
;
24
:
:1349.
–
57
.
36.
Zhou
Q-B
,
Xia
W-H
,
Ren
J
,
et al.
Effect of Intensive Periodontal Therapy on Blood Pressure and Endothelial Microparticles in Patients With Prehypertension and Periodontitis : A Randomized Controlled Trial.
.
J Periodontol
.
2017;
;
88
:
:711.
–
22
.
37.
Kapellas
K
,
Maple-Brown
LJ
,
Jamieson
LM
,
et al.
Effect of periodontal therapy on arterial structure and function among aboriginal australians : a randomized, controlled trial. Hypertens.
.
Dallas Tex 1979
.
2014;
;
64
:
:702.
–
8
.
38.
Piconi
S
,
Trabattoni
D
,
Luraghi
C
,
et al.
Treatment of periodontal disease results in improvements in endothelial dysfunction and reduction of the carotid intima-media thickness.
.
FASEB J
.
2009;
;
23
:
:1196.
–
204
.
39.
Caúla
AL
,
Lira-Junior
R
,
Tinoco
EMB
,
et al.
The effect of periodontal therapy on cardiovascular risk markers : a 6-month randomized clinical trial.
.
J Clin Periodontol
.
2014;
;
41
:
:875.
–
82
.
40.
Teeuw
WJ
,
Slot
DE
,
Susanto
H
,
et al.
Treatment of periodontitis improves the atherosclerotic profile : a systematic review and meta-analysis.
.
J Clin Periodontol
.
2014;
;
41
:
:70.
–
9
.
41.
Rydén
L
,
Buhlin
K
,
Ekstrand
E
,
et al.
Periodontitis Increases the Risk of a First Myocardial Infarction : A Report From the PAROKRANK Study.
.
Circulation
.
2016;
;
133
:
:576.
–
83
.
42.
Xu
S
,
Song
M
,
Xiong
Y
,
et al.
The association between periodontal disease and the risk of myocardial infarction : a pooled analysis of observational studies.
.
BMC Cardiovasc Disord
.
2017;
;
17
:
:50.
.
43.
Shi
Q
,
Zhang
B
,
Huo
N
,
et al.
Association between Myocardial Infarction and Periodontitis : A Meta-Analysis of Case-Control Studies.
.
Front Physiol
.
2016;
;
7
:
:519.
.
44.
Lafon
A
,
Pereira
B
,
Dufour
T
,
et al.
Periodontal disease and stroke : a meta-analysis of cohort studies.
.
Eur J Neurol
.
2014;
;
21
:
:1155.
–
61
,
e66–7.
.
45.
Leira
Y
,
Seoane
J
,
Blanco
M
,
et al.
Association between periodontitis and ischemic stroke : a systematic review and meta-analysis.
.
Eur J Epidemiol
.
2017;
;
32
:
:43.
–
53
.
46.
Bahekar
AA
,
Singh
S
,
Saha
S
,
et al.
The prevalence and incidence of coronary heart disease is significantly increased in periodontitis : a meta-analysis.
.
Am Heart J
.
2007;
;
154
:
:830.
–
7
.
47.
Zeng
X-T
,
Leng
W-D
,
Lam
Y-Y
,
et al.
Periodontal disease and carotid atherosclerosis : A meta-analysis of 17,330 participants.
.
Int J Cardiol
.
2016;
;
203
:
:1044.
–
51
.
48.
Sen
S
,
Giamberardino
LD
,
Moss
K
,
et al.
Periodontal Disease, Regular Dental Care Use, and Incident Ischemic Stroke.
.
Stroke
.
2018;
;
49
:
:355.
–
62
.
49.
Muñoz
Aguilera E
,
Suvan
J
,
Buti
J
,
et al.
Periodontitis is associated with hypertension : a systematic review and meta-analysis.
.
Cardiovasc Res
.
2020;
;
116
:
:28.
–
39
.
50.
Lee
Y-L
,
Hu
H-Y
,
Chou
P
,
et al.
Dental prophylaxis decreases the risk of acute myocardial infarction : a nationwide population-based study in Taiwan.
.
Clin Interv Aging
.
2015;
;
10
:
:175.
–
82
.
51.
Park
S-Y
,
Kim
S-H
,
Kang
S-H
,
et al.
Improved oral hygiene care attenuates the cardiovascular risk of oral health disease : a population-based study from Korea.
.
Eur Heart J
.
2019;
;
40
:
:1138.
–
45
.
52.
Van Dyke
TE
,
Kholy
KE
,
Ishai
A
,
et al.
Inflammation of the periodontium associates with risk of future cardiovascular events.
.
J Periodontol
.
2021;
;
92
:
:348.
–
58
.
53.
Boehme
AK
,
Esenwa
C
,
Elkind
MSV
.
Stroke Risk Factors, Genetics, and Prevention.
.
Circ Res
.
2017;
;
120
:
:472.
–
95
.
54.
Michel
J-B
,
Delbosc
S
,
Ho-Tin-Noé
B
,
et al.
From intraplaque haemorrhages to plaque vulnerability : biological consequences of intraplaque haemorrhages.
.
J Cardiovasc Med Hagerstown Md
.
2012;
;
13
:
:628.
–
34
.
55.
Michel
J-B
,
Martin-Ventura
JL
,
Nicoletti
A
,
et al.
Pathology of human plaque vulnerability : Mechanisms and consequences of intraplaque haemorrhages.
.
Atherosclerosis
.
2014;
;
234
:
:311.
–
9
.
56.
Derdeyn
CP
.
Mechanisms of ischemic stroke secondary to large artery atherosclerotic disease.
.
Neuroimaging Clin N Am
.
2007;
;
17
:
:303.
–
11
,
vii-viii.
.
57.
Hajishengallis
G
.
Periodontitis : from microbial immune subversion to systemic inflammation.
.
Nat Rev Immunol
.
2015;
;
15
:
:30.
–
44
.
58.
Carra
MC
,
Rangé
H
,
Caligiuri
G
,
Bouchard
P
.
Periodontitis and atherosclerotic cardiovascular disease: A critical appraisal.
.
Periodontol 2000
.
2023
; Nov 23. doi:
10.1111/prd.12528
.
|