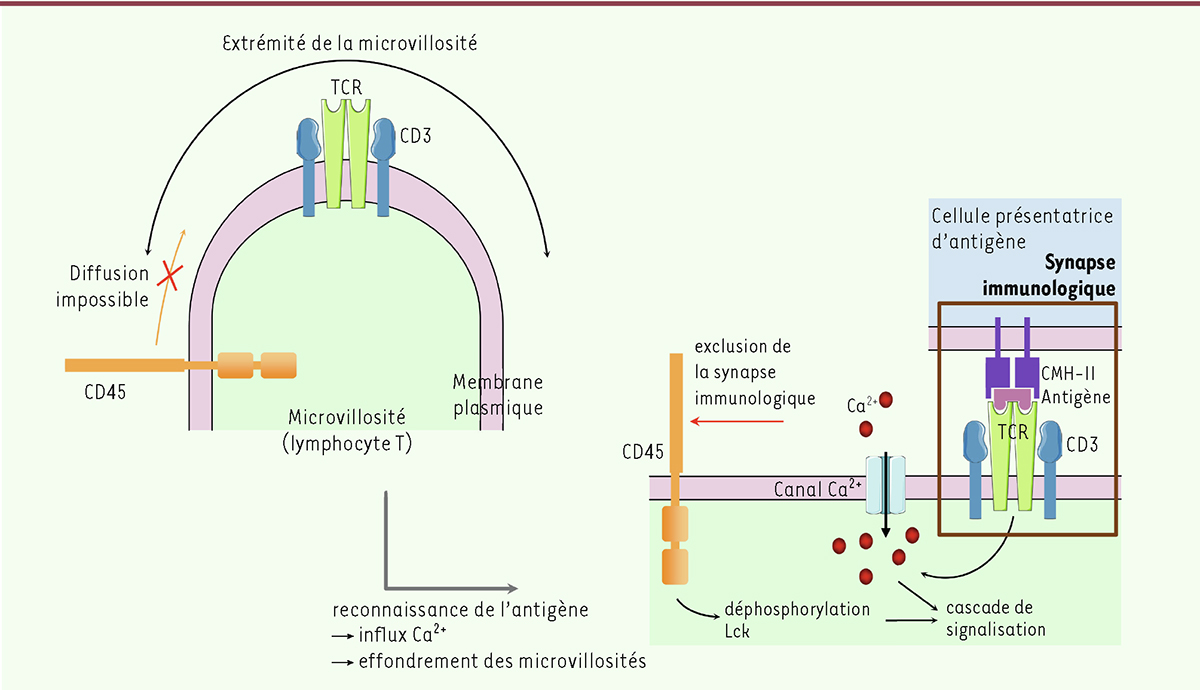
Les lymphocytes T (LT) sont des acteurs majeurs de l’immunité adaptative. Leur activation nécessite que leur récepteur de l’antigène, ou TCR ( T-cell receptor), composé de deux chaînes α et β associées à la molécule CD3 pour former le « complexe TCR », reconnaisse un peptide antigénique lui-même associé aux molécules du complexe majeur d’histocompatibilité (CMH) de la cellule présentatrice d’antigène (CPA) ( Figure 1 , « synapse immunologique »). Lors de cette reconnaissance, une zone de contact étroit entre LT et CPA est donc formée au niveau de ce que l’on nomme la synapse immunologique (SI) dans laquelle est localisé le complexe TCR/CMH mais également des molécules d’adhérence, telles que des intégrines [ 1 ], des co-récepteurs (comme CD4) et diverses protéines de signalisation dont la Lck ( lymphocyte-specific protein tyrosine kinase ) [ 2 ] ( → ).
(→) Voir la Synthèse de J. Bouchet et A. Alcover, m/s n° 6-7, juin-juillet 2014, page 665
| Figure 1.
Modèle de pré-exclusion de CD45 de l’extrémité des microvillosités
. L’extrémité des microvillosités a une membrane plasmique plus épaisse à cause de l’enrichissement du feuillet interne en cholestérol. Avant la reconnaissance de l’antigène, CD45 est exclu des extrémités de ces microvillosités à cause de sa MIL trop courte, empêchant sa diffusion dans l’extrémité de la microvillosité. Une première reconnaissance entre TCR et CMH-peptide (contact bref) suffit à provoquer un influx calcique et donc à initier la signalisation. La formation de la SI s’accompagne d’une déphosphorylation activatrice de Lck par CD45, exclu de la SI à cause de son domaine extracellulaire de taille trop importante, mais demeurant à proximité de celle-ci.
|
La présence de nombreuses protéines au niveau de la SI est donc nécessaire à la signalisation du TCR, et il semble que l’absence de CD45 de cette zone de contact rapprochée soit également importante.
En effet, CD45, également appelé antigène commun des leucocytes, est une protéine transmembranaire de la famille des protéines tyrosine phosphatases qui, présente à la surface des cellules hématopoïétiques, régule divers processus cellulaires, dont la signalisation des TCR. Bien que CD45 joue un rôle central dans l’activation du LT, sa localisation précise à la membrane plasmique reste discutée. CD45 est composée de deux domaines tyrosine phosphatase intracellulaires et d’un domaine extracellulaire, dont la taille et la structure varient selon un processus d’épissage alternatif de l’ARNm codant CD45 [ 3 , 4 ]. En effet, en fonction de son état de maturation, d’activation et de différenciation, un LT exprime à sa membrane une isoforme différente de la protéine CD45. À ce jour, aucun ligand activateur n’a été identifié pour CD45, dont le mécanisme d’activation demeure inconnu [ 4 ]. On sait, en revanche, que l’exclusion de cette protéine de la SI est nécessaire au contact étroit entre LT et CPA, son domaine extracellulaire étant de taille trop importante par rapport à celle du complexe TCR/CMH-peptide [ 5 ].
En conditions physiologiques, la phosphorylation des motifs ITAM ( immunoreceptor tyrosine based activation motif ) du complexe TCR est à l’origine d’une signalisation intracellulaire [ 6 ] et CD45 est capable de déphosphoryler ces motifs, les rendant inactifs [ 7 ]. La phosphatase CD45 permet également la déphosphorylation activatrice de la kinase Lck, initiant la signalisation du TCR [ 6 – 8 ]. CD45 empêche donc la signalisation en absence d’antigène par la déphosphorylation des ITAM, mais elle permet également l’initiation de la signalisation lors de la formation de la SI via l’augmentation de sa distance avec les TCR qui empêche la déphosphorylation des ITAM, et par son rôle dans l’activation de Lck.
Les LT présentent des digitations de leur membrane plasmique qui se créent par le biais de la polymérisation des filaments d’actine à l’extrémité distale de ces microvillosités (EM), au niveau desquelles existe une surconcentration des TCR. Les EM constitueraient donc une surface membranaire privilégiée pour l’activation des LT et la reconnaissance initiale de l’antigène. Cette surface s’aplanirait ensuite, permettant la formation d’une SI stable [ 5 , 6 , 9 ].
Il a été montré que CD45 est exclue à 95 % de zones plus épaisses de la membrane contenant beaucoup de cholestérol (les radeaux lipidiques) [ 10 ]. Or, les zones de courbure forte de membrane (telles que les EM) sont riches en cholestérol [ 11 ].
Dans une publication de 2021, Jung et al. de l’Institut d’immunologie de La Jolla (San Diego, Californie, États-Unis) ont voulu déterminer si l’exclusion de CD45 des EM des LT se produisait avant (pré-exclusion) ou seulement après la reconnaissance de l’antigène par le LT. Ils ont mis en évidence des mécanismes de pré-exclusion et ont étudié ses conséquences sur la signalisation associée aux TCR.