| |
| Med Sci (Paris). 40(2): 147–153. doi: 10.1051/medsci/2023217.Comprendre la totipotence embryonnaire à partir des cellules 2C-like Lounis Yakhou,1 Anaelle Azogui,1 Pierre Therizols,1 and Pierre-Antoine Defossez1* 1Équipe dynamiquede la méthylation de l’ADN des génomes eucaryotes, Centre épigénétique et destin cellulaire, UMR7216 CNRS, université Paris-Cité
,
35 rue Hélène Brion
,
75205Paris Cedex 13
,
France |
Vignette (© Inserm / Lassalle, Bruno).
La formation d’un organisme complexe à partir d’une seule cellule repose sur la propriété de totipotence qui caractérise les premières cellules embryonnaires. La totipotence est un concept qui désigne la capacité pour une cellule à initier et à orchestrer la génération d’un nouvel organisme de manière autonome (voir [
1
] pour revue). Par définition, le zygote et les blastomères sont totipotents, puisque chacune de ces cellules, prise isolément, est capable de contribuer au développement complet d’un individu.
La fécondation à l’origine du zygote implique la fusion non seulement du matériel génétique mais aussi de l’ensemble du contenu intracellulaire des deux gamètes. En effet, le zygote reçoit principalement les transcrits et les protéines accumulés par l’ovocyte au cours de sa maturation, de telle sorte qu’une transition materno-zygotique est nécessaire pour que se manifeste pleinement l’identité embryonnaire. Ce processus est constitué de deux événements simultanés : d’une part, la dégradation des transcrits maternels et, d’autre part, l’activation du génome zygotique (ou ZGA). La ZGA se compose elle-même de deux phases : une activation diffuse, dite mineure, à même d’effacer l’organisation génomique héritée des gamètes, et une activation, dite majeure, véritable première étape de l’individualisation du zygote [
2
]. L’activation majeure de la ZGA est un événement stéréotypé au sein d’une espèce, mais avec un délai d’apparition variable entre les espèces. Par exemple, la ZGA murine a lieu juste après la première division zygotique (au stade embryonnaire « 2-cellules »), tandis que la ZGA humaine se produit plus tardivement (au stade « 8-cellules ») [
3
].
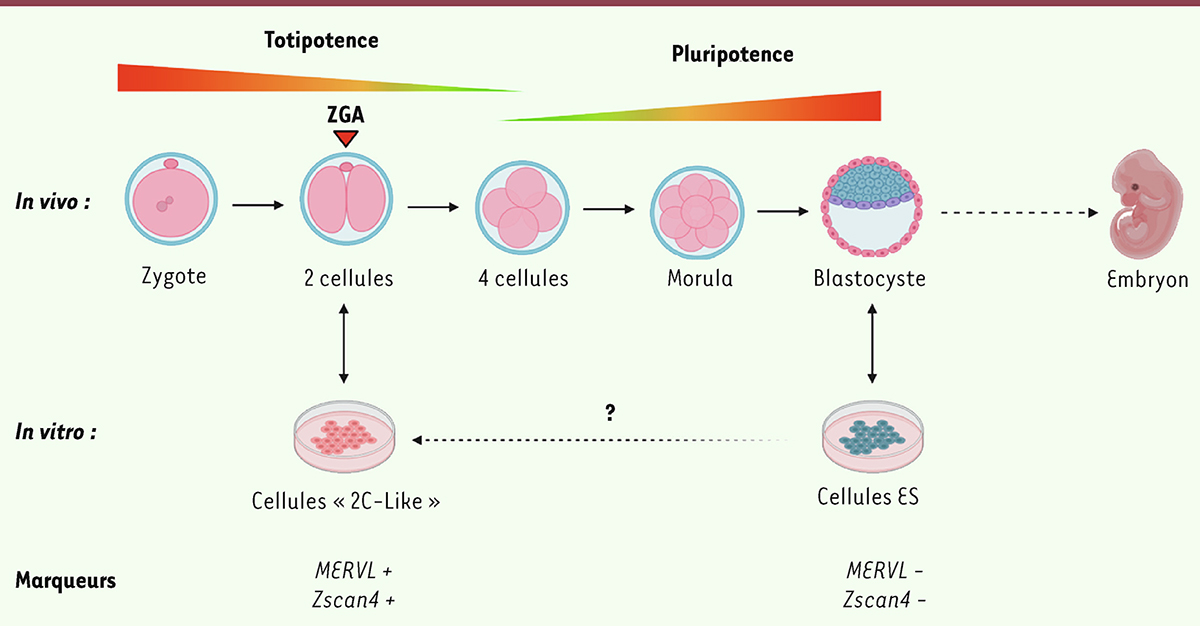
Seules les cellules issues des premières divisions embryonnaires sont totipotentes, tandis que les cellules des structures embryonnaires ultérieures sont pluripotentes (voir [
4
] pour revue). Il est important de distinguer ces deux états successifs : les cellules pluripotentes embryonnaires sont capables de se différencier dans n’importe quel type cellulaire de l’embryon, mais ne peuvent assurer seules le développement, notamment car elles ne sont pas à l’origine des tissus extra-embryonnaires, pourtant indispensables, comme le placenta (
Figure 1
).
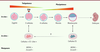 | Figure 1.
Transition de la totipotence à la pluripotence : récapitulation in vitro par les cellules ES et les cellules 2C-like.
In vitro
, la pluripotence peut être reproduite par les cellules souches embryonnaires (cellules « ES »), des cellules issues de la masse cellulaire interne du blastocyste. Ces cellules possèdent des marqueurs spécifiques, mais n’expriment plus les marqueurs de totipotence, tels que MERVL et
Zscan4
. Cependant, ces cellules peuvent sporadiquement réexprimer ces marqueurs ainsi que d’autres, spécifiques de l’embryon au stade 2 cellules, pour donner des cellules «
2 cell-like
» (2C-like). Cependant, les mécanismes de reprogrammation des cellules ES en cellules 2C-like sont encore mal connus.
|
L’étude expérimentale de la pluripotence a été rendue possible depuis les années 1970 grâce à plusieurs modèles cellulaires qui ont abouti à l’établissement de lignées de cellules souches embryonnaires (ou cellules ES) murines, puis humaines. En revanche, l’étude
in vitro
du zygote et de ses facultés propres a été difficile, jusqu’aux développements récents de cellules « quasi-totipotentes » (
totipotent-like
). Dans cette revue, nous présentons les avancées de la recherche concernant la totipotence et son identification parmi les cellules ES murines il y a une dizaine d’années, jusqu’à la création des premiers modèles de cellules totipotentes humaines.
|
La découverte des 2CLC, des cellules semblables à l’embryon 2-cellules Le premier modèle de cellules « quasi-totipotentes » trouve ses origines dans la détection de l’expression de deux marqueurs de l’activation du génome zygotique (ZGA) au sein d’une sous-population de cellules souches embryonnaires (ES). La détection de ces marqueurs de la ZGA dans les cellules ES a établi une connexion inattendue entre des lignées cellulaires pluripotentes et les blastomères totipotents, deux entités pourtant très distinctes d’un point de vue développemental.
Le premier de ces marqueurs est un rétrotransposon de la famille MERVL
(murine endogenous retrovirus-L
) dont l’expression est spécifique de la ZGA chez la souris (
Figure 1
). À l’image de leur orthologue humain, HERVL, les transposons MERVL sont présents en centaines de copies, flanquées par de longues répétitions terminales (LTR), qui servent de promoteurs alternatifs aux gènes exprimés à l’occasion de la ZGA. Ils représentent ainsi un ensemble d’éléments régulateurs d’origine virale cooptés par les génomes hôtes pour coordonner l’expression de transcrits chimériques éphémères [
5
].
L’autre marqueur identifié est aussi commun aux ZGA murines et humaines : ZSCAN4 (
zinc finger and SCAN domain-containing 4
) (
Figure 1
) [
6
]. De manière surprenante, cette protéine à doigts-de-zinc est également exprimée, bien que sporadiquement, par une fraction (environ 5 %) de cellules ES murines en culture. L’importance de cette activation a été explorée par une cartographie de destinée (ou
lineage tracing
) [
7
]. Cette méthode utilise le système
Cre/loxP
pour rendre fluorescentes les cellules ES de manière conditionnelle, c’est-à-dire au moment où la recombinase Cre, placée en aval du promoteur du gène
Zscan4
, est exprimée. Cette fluorescence persistante a servi de cicatrice indélébile qui a fini par marquer l’ensemble de la population ES, montrant que chaque cellule pluripotente a connu cet événement après quelques semaines en culture. L’oscillation entre les états ZSCAN4
+
et ZSCAN4
-
, bien que temporaire et minoritaire à un instant donné, semble toutefois nécessaire à l’auto-renouvellement des cellules ES
in vitro
, sans doute par l’implication de ZSCAN4 dans l’élongation des télomères [
7
].
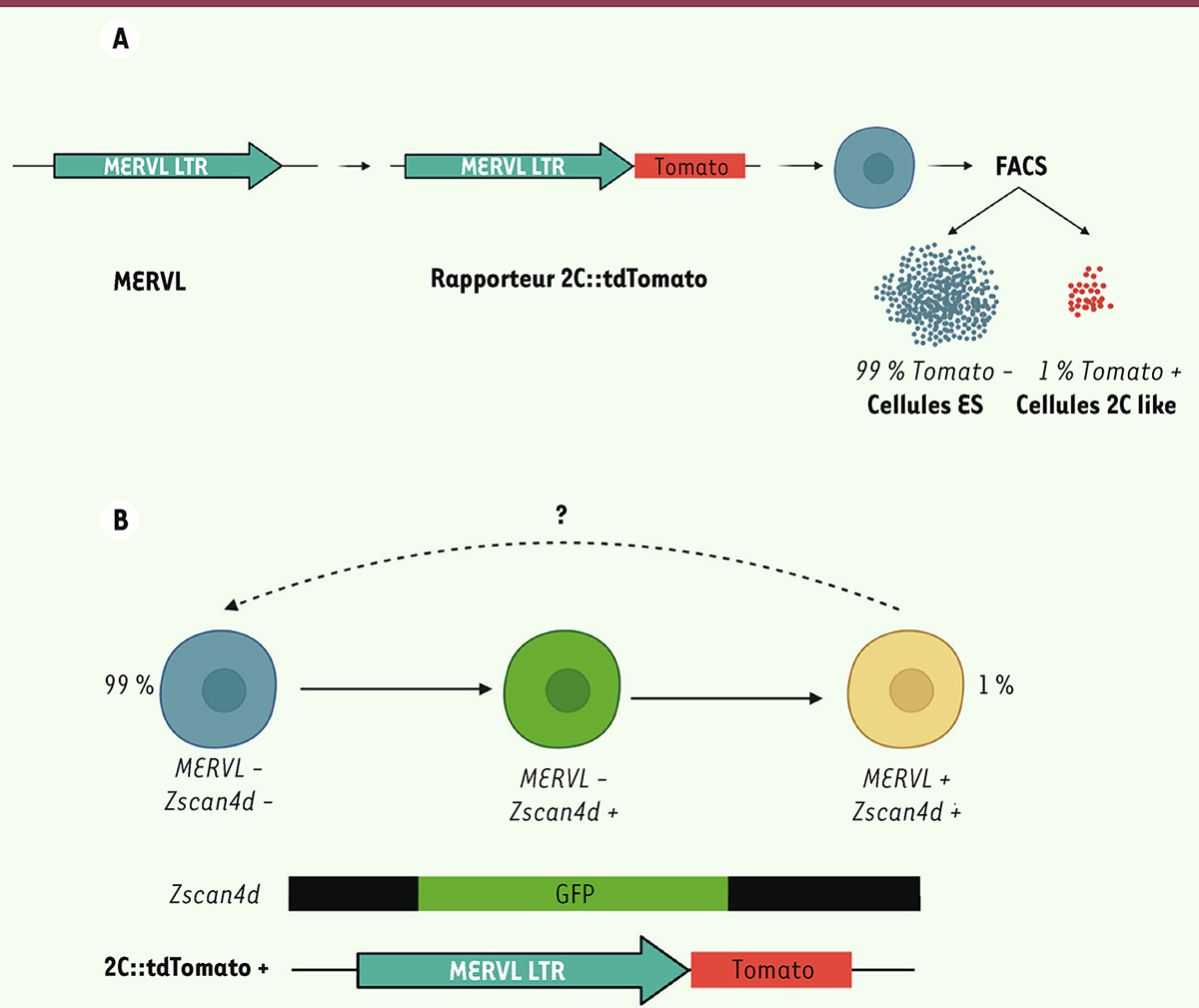
En 2012, cette sous-population de cellules ES exprimant des marqueurs de ZGA a été formellement identifiée par Macfarlan
et al.,
en utilisant une élégante méthode de génie génétique permettant de suivre l’expression de
MERVL
dans chaque cellule [
8
]. Le système rapporteur, nommé 2C : tdTomato, a été construit en fusionnant une portion du gène codant MERVL à une séquence codant une protéine fluorescente rouge (tdTomato) en aval d’une LTR (
long terminal repeat
) de
MERVL
, de telle sorte que les cellules exprimant MERVL deviennent fluorescentes. L’étude de l’activité de ce rapporteur a prouvé l’existence d’une population rare (moins de 1 %) de cellules ES ressemblant à l’embryon 2-cellules (ou 2CLC, pour
2C-like cells
) (
Figure 2A
).
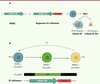 | Figure 2.
Mise en évidence expérimentale d’une sous-population totipotente dans les cellules souches embryonnaires. A.
En suivant l’expression de MERVL grâce à un rapporteur fluorescent (tdTomato) et en triant par FACS les cellules tdTomato
+
(donc MERVL
+
), Macfarlan
et al.
[
8
] ont confirmé l’existence d’une population rare de moins de 1 % de cellules ES ressemblant aux cellules embryonnaires au stade 2 cellules, les cellules 2C-like.
B.
L’analyse par cytométrie en flux de rapporteurs fluorescents a établi la chronologie de la transition ES/2CLC. En revanche, le devenir des cellules 2C-like n’a pas (encore) été déterminé : apoptose ? retour à l’état ES ?
|
Les 2CLC sont donc des cellules ES exprimant les marqueurs de l’embryon totipotent (MERVL, ZSCAN4), avec une chronologie constante : les cellules ZSCAN4
+
sont les précurseurs des cellules ZSCAN4
+
MERVL
+
(
Figure 2B
). La fraction de cellules 2CLC présente en culture n’est pas statique, mais elle résulte d’un équilibre des flux entrant et sortant de cet état, comme l’a montré la réversibilité de la fluorescence des cellules 2C : tdTomato
+
après tri par cytométrie en flux [
8
]. Cet équilibre dynamique est nécessaire à la persistance de cette sous-population, puisque les cellules 2CLC sont incapables de proliférer dans les conditions de culture standard. Macfarlan
et al.
ont aussi évalué le potentiel fonctionnel de ces cellules 2CLC, par des expériences de chimères embryonnaires : contrairement à la fraction pluripotente, les cellules 2CLC injectées dans des
morula
contribuent aussi à la formation de tissus extra-embryonnaires [
8
].
La transition entre les cellules ES et les cellules 2CLC a par la suite été précisée à l’échelle moléculaire, à la fois pour comprendre comment était levée la répression qui pèse sur les deux marqueurs ZSCAN4 et MERVL, et pour disséquer les conséquences de cette activation. Par exemple, la reprogrammation chromatinienne, qui permet d’augmenter l’accessibilité des éléments MERVL, est promue par un ralentissement de la vitesse de la fourche de réplication de l’ADN des cellules souches [
9
]. Le paysage épigénétique des cellules 2CLC est globalement plus dynamique que celui des cellules ES, avec notamment des niveaux de méthylation de l’ADN plus bas, à cause de l’action du réseau de gènes situés en aval de
ZSCAN4
/
MERVL
[
10
]. Tous ces mécanismes contribuent à augmenter la probabilité de l’événement stochastique qu’est l’apparition du phénotype 2CLC.
|
La recherche des facteurs régulant l’état 2C-like
La découverte des cellules 2CLC a initié la quête d’un hypothétique régulateur maître de la transition materno-zygotique des mammifères, à l’instar de
Zelda
chez la drosophile [
11
] (
→
).
(→) Voir la Nouvelle de H. Gilgenkrantz,
m/s
n° 1, janvier 2003, page 27
Un tel régulateur serait spécifiquement exprimé lors de la ZGA, et serait capable d’induire l’expression de tout le programme transcriptionnel embryonnaire. C’est ainsi qu’en 2017, trois équipes, De Iaco
et al.
[
12
], Hendrickson
et al.
[
13
]
,
et Whiddon
et al.
[
14
], ont indépendamment proposé DUX4 (
double homeobox 4
) comme candidat potentiel pour ce rôle. DUX4 était jusqu’alors connu pour son rôle pathogène dans les myopathies facio-scapulo-humérales, où son activation ectopique provoque l’apoptose des myotubes due à l’expression de gènes chimériques associés aux LTR de
HERVL
[
15
] (→).
(→) Voir la Nouvelle de J. Dufourt
et al
.,
m/s
n° 11, novembre 2019, page 821
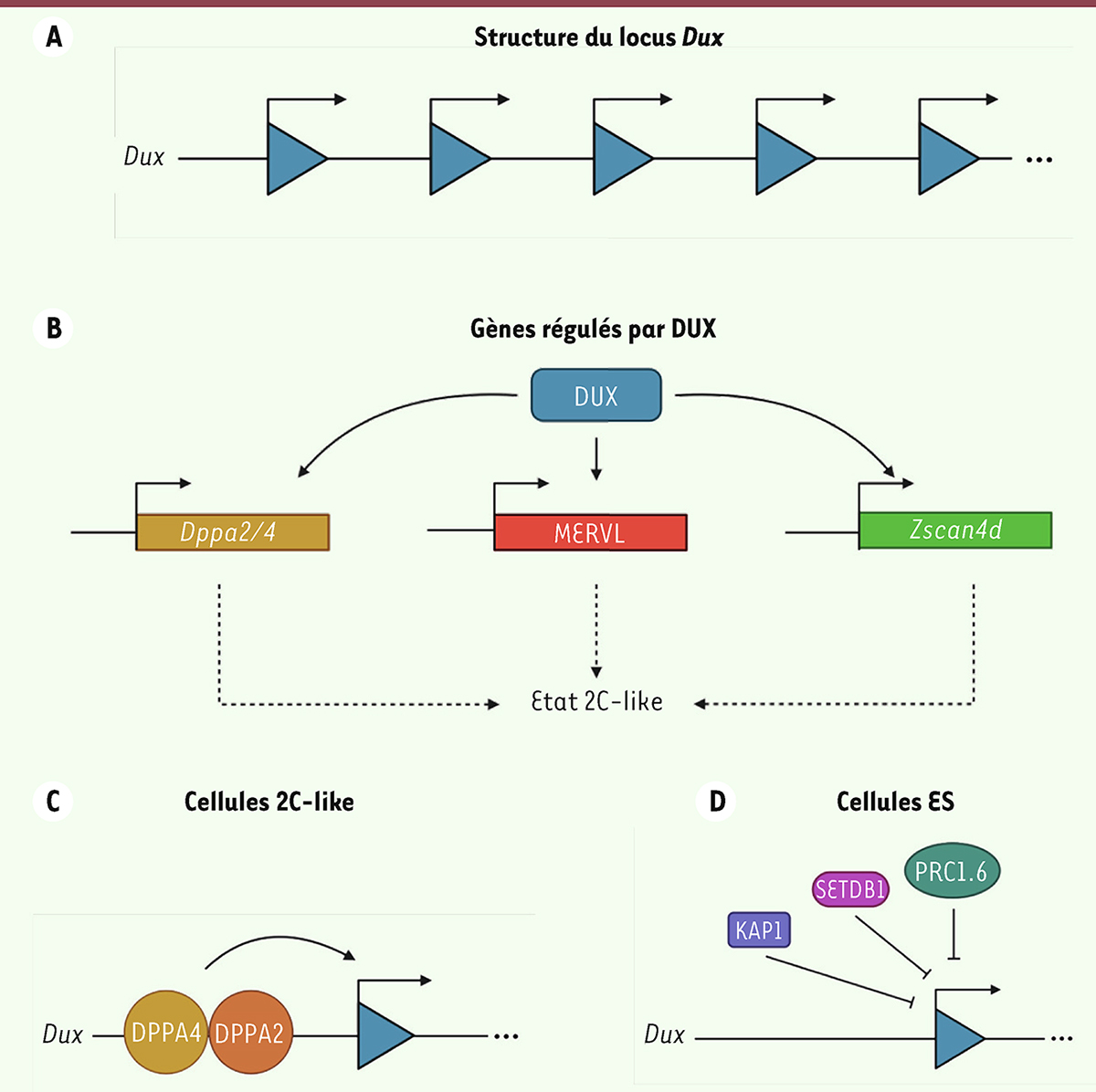
Plusieurs arguments soutiennent la thèse de DUX4 comme étant le régulateur maître de la ZGA humaine. Cette protéine est capable de lier l’ADN et existe exclusivement chez les mammifères placentaires. Elle est codée par un gène dépourvu d’intron (donc potentiellement plus simple à traduire au début de la ZGA) et présent en dizaines de copies dans le locus
D4Z4
, une région macrosatellitaire sub-télomérique humaine (
Figure 3A
). Par nature, cette région répétée fait partie de l’hétérochromatine, sauf dans les cellules totipotentes. L’orthologue murin
Dux
a des caractéristiques génomiques similaires au locus
D4Z4
, et est également spécifiquement exprimé pendant la ZGA.
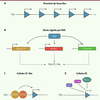 | Figure 3.
In vitro, DUX régule la transition entre pluripotence et totipotence. A.
Le locus
Dux
est constitué de plusieurs dizaines de copies.
B.
DUX est capable d’induire l’expression des facteurs de totipotence MERVL,
Zscan4d
, mais aussi celle des gènes codant les facteurs de transcription DPPA2 et DPPA4, eux-mêmes capables d’induire l’expression de
Dux
. Ensemble, l’expression de ces facteurs induit un état 2C-like.
C.
Le dimère de facteurs de transcription DPPA2/DPPA4 lie le locus
Dux
et active son expression dans les cellules 2C-like.
D.
Les facteurs KAP1, SETDB1 et le complexe enzymatique non-canonique PRC1.6 répriment l’expression de
Dux
dans les cellules ES.
|
DUX est un facteur indispensable à l’apparition des cellules 2CLC dans une culture de cellules ES murines : sa surexpression suffit à induire une plus grande proportion de cellules 2CLC, tandis que son inhibition supprime la rare population naturellement présente. Fonctionnellement, le motif de liaison de DUX se trouve dans le promoteur des marqueurs de la ZGA. Il semble que DUX active directement l’expression de ses cibles en agissant comme un facteur pionnier, rendant la chromatine permissive à la transcription. DUX interagit avec plusieurs partenaires, protéines comme ARN non-codants, pour activer directement la cascade du programme transcriptionnel totipotent, à commencer par ceux concernant MERVL et ZSCAN4 (
Figure 3B
) [
16
,
17
]. Remonter la chaîne de causalité menant à la transition ES/2C-like a permis d’identifier les facteurs de transcription en amont de DUX : DPPA2 et DPPA4 [
18
]. Ce dimère, exprimé dans l’ovocyte, le zygote et les cellules pluripotentes, est nécessaire à la formation spontanée de cellules 2CLC en activant directement
Dux
lorsque le locus est décompacté (
Figure 3C
). Cet événement initial est ensuite amplifié par les multiples boucles de rétroaction positive.
DUX étant un régulateur essentiel pour l’apparition de l’état 2C-like
in vitro
, il est attendu que sa présence soit nécessaire à la ZGA
in vivo.
Ce n’est cependant pas le cas, en effet, l’absence de DUX ou DPPA2/4, au stade 2C (deux cellules), n’empêche pas la poursuite du développement chez la souris [
19
,
20
]. Il est possible que DUX promeuve plutôt l’expression de gènes spécifiques des mammifères impliqués dans la formation du placenta, puisque les embryons dont le gène
Dux
est inactivé subissent des défauts pré- et post-implantatoires (retards de segmentation, échecs de gastrulation, etc.).
Plusieurs voies de répression redondantes maintiennent l’identité pluripotente des cellules ES en inhibant le programme transcriptionnel 2C. Ces barrières à la conversion ont été identifiées par des stratégies de criblage par siARN (
small interfering RNA
) ou par délétion
via le système
CRISPR, en utilisant des lignées rapportrices devenant fluorescentes lorsqu’un marqueur de la ZGA est exprimé. Les cellules 2CLC pouvaient ainsi être isolées par cytométrie en flux, puis séquencées afin de déterminer quelle barrière avait été levée [
21
,
22
]. Les complexes protéiques en question regroupent souvent des facteurs de transcription interagissant avec des facteurs chromatiniens, comme le couple KAP1 (
KRAB-associated protein 1,
ou TRIM28 [
tripartite motif containing 28
]) / SETDB1 (
SET domain bifurcated histone lysine methyltransferase 1
), ou le complexe enzymatique non canonique Polycomb 1.6 (
Figure 3D
).
Ces approches ont été complétées par des études individuelles rapportant plus d’une dizaine de répresseurs de l’état 2C-like, généralement des répresseurs chromatiniens dont la perte active les gènes de la ZGA (voir [
23
] pour revue). Le développement récent d’analyses du transcriptome au niveau de la cellule unique (ou scRNA-seq pour
single-cell RNA sequencing,
) a permis d’accéder aux dynamiques de transition ES/2CLC. Des états intermédiaires, inaccessibles avec les modèles rapporteurs fluorescents, ont ainsi pu être capturés. Par exemple, les gènes associés à la pluripotence sont sous-exprimés avant l’activation du programme transcriptionnel 2C. Les étapes de rétro-conversion (de l’état 2C-like à l’état ES) ont aussi été mises en évidence, avec le rôle de facteurs protégeant l’ARNm de
Dux
[
24
,
25
].
|
Deux modèles complémentaires pour expliquer la sortie de l’état totipotent
Modéliser la reprogrammation des cellules ES en cellules 2CLC
in vitro
peut aider à expliquer la transition de la totipotence vers la pluripotence. Deux hypothèses non-exclusives sont actuellement considérées afin d’expliquer comment l’expression de
Dux
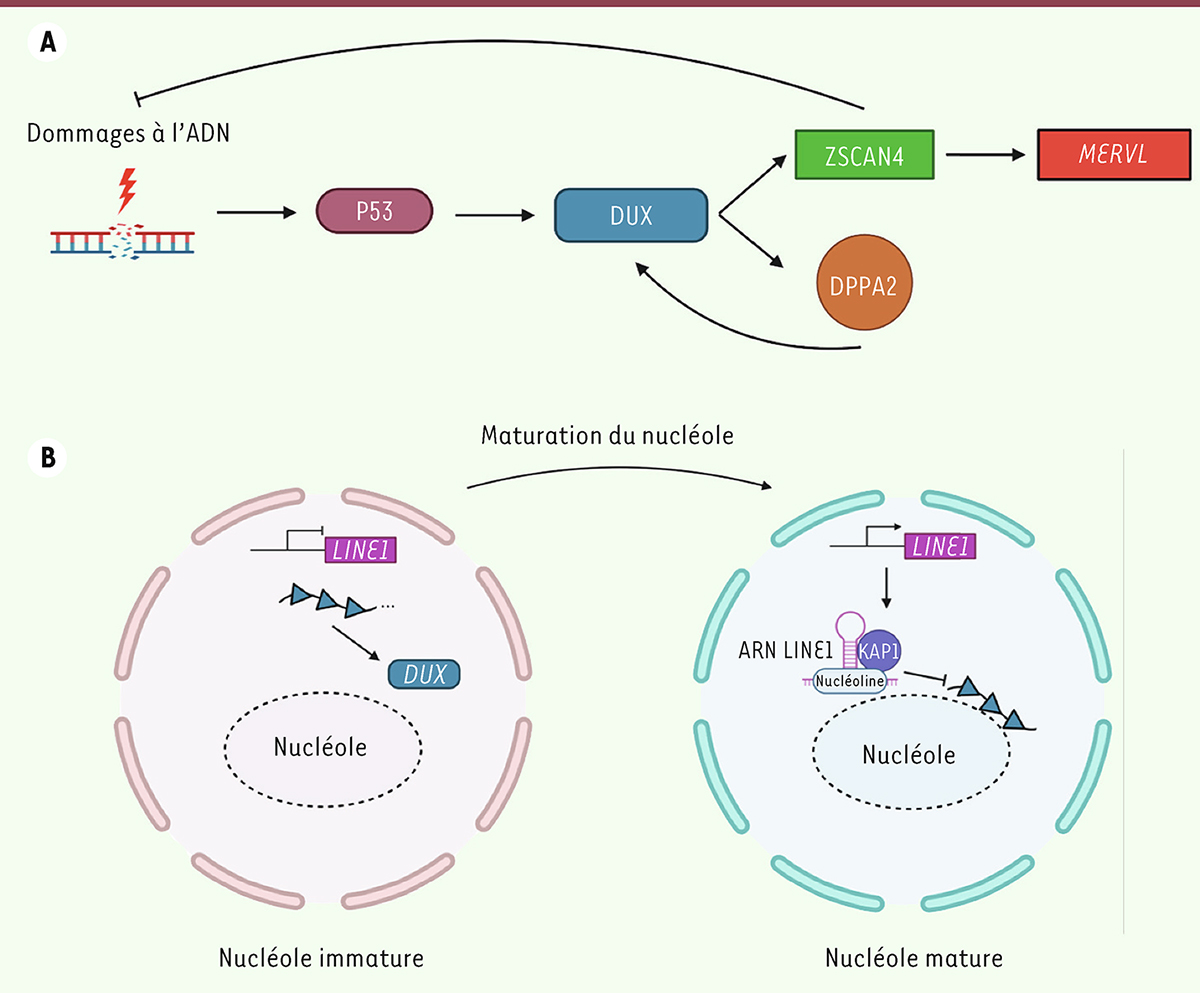
peut être réprimée à la fin de la ZGA : la réparation des dommages à l’ADN et la maturation nucléolaire.
Selon Grow
et al,
l’auto-inhibition de la ZGA repose sur la réponse aux dommages à l’ADN médiée par la voie impliquant TP53 (
tumor protein 53
) [
26
]. En effet, l’induction exogène de stress réplicatif ou de cassures double-brin de l’ADN produisent la transition des cellules ES en cellules 2CLC [
27
,
28
]. Puisque TP53 est un activateur direct de
Dux
dans les cellules ES, il semble que la signalisation induite par cette protéine maintienne le programme transcriptionnel 2C tant que l’intégrité du génome n’est pas rétablie. L’embryon 2-cellules étant soumis à plusieurs sources de dommages à l’ADN, liées à la réorganisation du génome et à la ZGA, il serait logique que la mitose suivante soit repoussée jusqu’à ce que toutes les réparations aient eu lieu. Dans ce modèle, l’instabilité génomique induite par les mitoses fréquentes des cellules ES les convertirait en 2CLC et les maintiendrait dans cet état aussi longtemps que nécessaire. La rétro-conversion dépendrait d’une boucle de rétrocontrôle négatif utilisant ZSCAN4 comme protecteur contre les dommages à l’ADN (
Figure 4A
) [
29
]. Cependant, la signalisation impliquant TP53 n’est pas un mécanisme nécessaire à la régulation de la ZGA
in vivo
, puisque l’absence de la protéine reste compatible avec un développement prénatal complet.
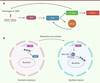 | Figure 4.
Les modèles de la régulation transcriptionnelle de DUX. A.
Les dommages à l’ADN induisent la transition des cellules ES en cellules 2C-like
via
l’activation de P53, qui elle-même induit l’expression de
Dux
. L’expression de
Dux
entraîne la synthèse des facteurs de totipotences ZSCAN4, MERVL, ainsi que celle du facteur de transcription DPPA2. ZSCAN4 agirait comme protecteur contre les dommages à l’ADN.
B.
Dans les cellules ES, qui ont un nucléole mature, un complexe composé de l’ARN de la famille des rétrotransposons LINE1, de la nucléoline et de KAP1/TRIM28 séquestre le gène
Dux
à la périphérie du nucléole, contribuant à maintenir sa répression. À l’inverse, les cellules 2C-like ont un nucléole immature dans lequel l’ARN LINE1 n’est pas exprimé, ce qui permet l’expression de
Dux
.
|
Selon la seconde hypothèse, c’est la maturation des structures nucléaires propres à l’embryon totipotent qui peut expliquer la sortie de l’état totipotent [
30
]. Le zygote murin possède une organisation nucléaire héritée de l’ovocyte, avec notamment des régions péri-centromériques entourant le corps précurseur nucléolaire. Après la ZGA, ces régions se détachent du corps précurseur nucléolaire et se condensent en chromocentres répartis dans le nucléoplasme [
31
]. Une évolution inverse est observée lors de la transition ES/2CLC : les chromocentres sont décondensés et relocalisés à la périphérie nucléolaire. La perte de l’intégrité nucléolaire modifie l’organisation tridimensionnelle du génome, entraînant la perte des interactions inhibitrices présentes dans les cellules ES [
32
].
Au niveau moléculaire, ces interactions inhibitrices prennent la forme d’interactions entre protéines et ARN non-codants [
33
]. La famille de rétrotransposons autonomes
LINE1
(
long interspersed element-1
) produit des ARN qui interagissent avec la nucléoline, une protéine importante pour la transcription d’ARN ribosomal dans le nucléole. La nucléoline recrute à son tour le facteur chromatinien KAP1/TRIM28, répresseur direct de
Dux
[
34
,
35
]. Dans les cellules ES, le complexe LINE1/Nucléoline/KAP1 séquestre le locus
Dux
dans la périphérie nucléolaire, où la synthèse d’ARN ribosomal contribue à maintenir sa répression (
Figure 4B
). La maturation nucléolaire de l’embryon 2-cellules, consistant en l’activation de l’expression des gènes ribosomaux pendant la ZGA, agit donc comme un mécanisme de rétrocontrôle négatif qui favorise la répression de
Dux
par la réorganisation tridimensionnelle de l’hétérochromatine.
|
Vers l’obtention d’un modèle cellulaire humain de la totipotence Au cours de la dernière décennie, la totipotence a été approchée par la découverte fortuite d’une sous-population de cellules ES exprimant des marqueurs associés à l’embryon 2-cellules. Ces cellules 2CLC constituent un modèle expérimental reproductible et facile à manipuler pour représenter les blastomères, avec lesquels elles partagent plusieurs propriétés génomiques, transcriptionnelles et structurales. Cependant, la totipotence ne pouvant être réduite à un simple état transcriptionnel, le suivi de marqueurs spécifiques ne saurait suffire à caractériser la totipotence. Les expériences de chimères embryonnaires ne sont pas exemptes de limitations, puisque les cellules testées s’insèrent dans un processus embryonnaire en cours, au lieu de l’initier comme le font les blastomères.
Après l’identification des cellules 2CLC, les efforts de reprogrammation dirigée vers la totipotence se sont concentrés sur l’augmentation du potentiel de différenciation. Des cocktails chimiques inhibant sélectivement la machinerie responsable de l’épissage alternatif des ARNm (pour mimer un état pré-ZGA) ou des facteurs chromatiniens (pour reformer un paysage zygotique) ont ainsi été mis au point [
36
]. Ces nouveaux modèles sont transcriptionnellement plus proches de l’embryon 2-cellules que ne le sont les 2CLC, et sont même capables de s’auto-organiser sous forme de blastoïdes pour s’implanter dans la paroi utérine (voir [
37
] pour revue). D’un point de vue mécanistique, la recherche de facteurs pionniers, remplaçant DUX, a conduit à l’identification de la famille de facteurs de transcription OBOX, nécessaires et suffisants à l’activation du génome zygotique murin
in vivo
[
38
].
Ces derniers développements avec les cellules murines ont inspiré la recherche d’un modèle humain de totipotence, malgré les différences qui existent entre les deux espèces. À l’image des cellules 2CLC, des cellules 8CLC humaines, exprimant les marqueurs de la ZGA humaine (HERVL, ZSCAN4, TPRX1 [
tetrapeptide repeat homeobox 1
]), ont été identifiées dans les cultures de cellules ES humaines [
39
]. En suivant des stratégies similaires de système rapporteur fluorescent, et l’utilisation de scRNA-seq, des cocktails d’inhibiteurs chimiques (ciblant MEK [
mitogen-activated protein (MAP) kinase kinase
], PARP [poly (ADP-ribose) polymérase], HDAC [histone désacétylase], et EZH2 [
enhancer of zeste 2 polycomb repressive complex 2 subunit
]) ont très récemment permis d’induire un état proche de la totipotence
in vitro
(voir [
40
] pour revue).
Il est indéniable que ces efforts visant à mieux comprendre le fonctionnement de l’initiation du développement embryonnaire auront des répercussions positives sur d’autres champs de recherche. Les organoïdes, reconstituant les rapports tridimensionnels entre plusieurs types cellulaires à partir de cellules pluripotentes, pourraient être enrichis et complexifiés par de nouveaux outils rendant plus malléables l’identité cellulaire. L’étude de la totipotence est aussi intimement liée aux projets biomédicaux de reprogrammation et de régénération tissulaire, qui pourraient tirer profit de l’exploitation du potentiel intrinsèque dans le génome de toute cellule différenciée. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Condic
ML
.
Totipotency : What It Is and What It Is Not.
.
Stem Cells Dev
.
2014;
;
23
:
:796.
–
812
.
2.
Jukam
D
,
Shariati
SAM
,
Skotheim
JM
.
Zygotic Genome Activation in Vertebrates.
.
Dev Cell
.
2017;
;
42
:
:316.
–
332
.
3.
Rossant
J.
.
Mouse and human blastocyst-derived stem cells : vive les differences.
.
Development
.
2015;
;
142
:
:9.
–
12
.
4.
Afanassieff
M
,
Aksoy
I
,
Beaujean
N
et al.
Cinquante nuances de pluripotence.
.
Med Sci (Paris)
.
2018;
;
34
:
:944.
–
953
.
5.
Kigami
D
,
Minami
N
,
Takayama
H
et al.
MuERV-L Is One of the Earliest Transcribed Genes in Mouse One-Cell Embryos.
.
Biol Reprod
.
2003;
;
68
:
:651.
–
654
.
6.
Falco
G
,
Lee
SL
,
Stanghellini
I
et al.
Zscan4: A novel gene expressed exclusively in late 2-cell embryos and embryonic stem cells.
.
Dev Biol
.
2007;
;
307
:
:539.
–
550
.
7.
Zalzman
M
,
Falco
G
,
Sharova
LV
,
et al.
Zscan4 regulates telomere elongation and genomic stability in ES cells.
.
Nature
.
2010;
;
464
:
:858.
–
863
.
8.
Macfarlan
TS
,
Gifford
WD
,
Driscoll
S
,
et al.
Embryonic stem cell potency fluctuates with endogenous retrovirus activity.
.
Nature
.
2012;
;
487
:
:57.
–
63
.
9.
Nakatani
T
,
Lin
J
,
Ji
F
,
et al.
DNA replication fork speed underlies cell fate changes and promotes reprogramming.
.
Nat Genet
.
2022;
;
54
:
:318.
–
27
.
10.
Eckersley-Maslin
MA
,
Svensson
V
,
Krueger
C
,
et al.
MERVL/Zscan4 Network Activation Results in Transient Genome-wide DNA Demethylation of mESCs.
.
Cell Rep
.
2016;
;
17
:
:179.
–
192
.
11.
Dufourt
J
,
Bellec
M
,
Messina
O
,
et al.
Zelda, le maestro du réveil du génome zygotique.
.
Med Sci (Paris)
.
2019;
;
35
:
:821.
–
841
.
12.
De Iaco
A
,
Planet
E
,
Coluccio
A
,
et al.
DUX-family transcription factors regulate zygotic genome activation in placental mammals.
.
Nat Genet
.
2017;
;
49
:
:941.
–
945
.
13.
Hendrickson
PG
,
Dorais
JA
,
Grow
EJ
,
et al.
Conserved roles of mouse DUX and human DUX4 in activating cleavage-stage genes and MERVL/HERVL retrotransposons.
.
Nat Genet
.
2017;
;
49
:
:925.
–
934
.
14.
Whiddon
JL
,
Langford
AT
,
Wong
CJ
,
et al.
Conservation and innovation in the DUX4-family gene network.
.
Nat Genet
.
2017;
;
49
:
:935.
–
940
.
15.
La Gilgenkrantz
H.
.
myopathie facio-scapulo-humérale : un défaut de répression ?
.
Med Sci (Paris)
.
2003;
;
19
:
:27.
–
28
.
16.
Yang
F
,
Huang
X
,
Zang
R
,
et al.
DUX-miR-344-ZMYM2-Mediated Activation of MERVL LTRs Induces a Totipotent 2C-like State.
.
Cell Stem Cell
.
2020;
;
26
:
:234.
–
50
.
17.
Zuo
F
,
Jiang
J
,
Fu
H
,
et al.
A TRIM66/DAX1/Dux axis suppresses the totipotent 2-cell-like state in murine embryonic stem cells.
.
Cell Stem Cell
.
2022;
:
29
:
:948.
–
61
.
18.
Eckersley-Maslin
MA
,
Alda-Catalinas
C
,
Blotenburg
M
,
et al.
Dppa2 and Dppa4 directly regulate the Dux-driven zygotic transcriptional program.
.
Genes Dev
.
2019;
;
33
:
:194.
–
208
.
19.
Chen
Z
,
Zhang
Y
.
Loss of DUX causes minor defects in zygotic genome activation and is compatible with mouse development.
.
Nat Genet
.
2019;
;
51
:
:947.
–
951
.
20.
Chen
Z
,
Xie
Z
,
Zhang
Y
.
DPPA2 and DPPA4 are dispensable for mouse zygotic genome activation and pre-implantation development.
.
Development
.
2021;
;
148
:
:dev200178.
.
21.
Rodriguez-Terrones
D
,
Gaume
X
,
Ishiuchi
T
,
et al.
A molecular roadmap for the emergence of early-embryonic-like cells in culture.
.
Nat Genet
.
2018;
;
50
:
:106.
–
119
.
22.
Gupta
N
,
Yakhou
L
,
Richard
Albert J
,
et al.
A genome-wide screen reveals new regulators of the 2-cell-like cell state.
.
Nat Struct Mol Biol
.
2023;
;
30
:
:1105.
–
18
.
23.
Iturbide
A
,
Torres-Padilla
ME
.
A cell in hand is worth two in the embryo : recent advances in 2-cell like cell reprogramming.
.
Curr Opin Genet Dev
.
2020;
;
64
:
:26.
–
30
.
24.
Fu
X
,
Wu
X
,
Djekidel
MN
,
et al.
Myc and Dnmt1 impede the pluripotent to totipotent state transition in embryonic stem cells.
.
Nat Cell Biol
.
2019;
;
21
:
:835.
–
844
.
25.
Fu
X
,
Djekidel
MN
,
Zhang
Y
.
A transcriptional roadmap for 2C-like-to-pluripotent state transition.
.
Sci Adv
.
2020;
;
6
:
:eaay5181.
.
26.
Grow
EJ
,
Weaver
BD
,
Smith
CM
,
et al.
p53 convergently activates Dux/DUX4 in embryonic stem cells and in facioscapulohumeral muscular dystrophy cell models.
.
Nat Genet
.
2021;
;
53
:
:1207.
–
20
.
27.
Atashpaz
S
,
Samadi
Shams S
,
Gonzalez
JM
,
et al.
ATR expands embryonic stem cell fate potential in response to replication stress.
.
eLife
.
2020;
;
9
:
:e54756.
.
28.
Canat
A
,
Atilla
D
,
Torres-Padilla
ME
.
Hyperosmotic stress induces 2-cell-like cells through ROS and ATR signaling.
.
EMBO Rep
.
2023;
;
24
:
:e56194.
.
29.
Srinivasan
R
,
Nady
N
,
Arora
N
,
et al.
Zscan4 binds nucleosomal microsatellite DNA and protects mouse two-cell embryos from DNA damage.
.
Sci Adv
.
2020;
;
6
:
:eaaz9115.
.
30.
Xie
SQ
,
Leeke
BJ
,
Whilding
C
,
et al.
Nucleolar-based Dux repression is essential for embryonic two-cell stage exit.
.
Genes Dev
.
2022;
;
36
:
:331.
–
47
.
31.
Borsos
M
,
Torres-Padilla
ME
.
Building up the nucleus : nuclear organization in the establishment of totipotency and pluripotency during mammalian development.
.
Genes Dev
.
2016;
;
30
:
:611.
–
621
.
32.
Yu
H
,
Sun
Z
,
Tan
T
,
et al.
rRNA biogenesis regulates mouse 2C-like state by 3D structure reorganization of peri-nucleolar heterochromatin.
.
Nat Commun
.
2021;
;
12
:
:6365.
.
33.
Percharde
M
,
Lin
CJ
,
Yin
Y
,
et al.
A LINE1-Nucleolin Partnership Regulates Early Development and ESC Identity.
.
Cell
.
2018;
;
174
:
:391.
–
405
.
34.
Cossec
JC
,
Theurillat
I
,
Chica
C
,
et al.
SUMO Safeguards Somatic and Pluripotent Cell Identities by Enforcing Distinct Chromatin States.
.
Cell Stem Cell
.
2018;
;
23
:
:742.
–
757
.
35.
Tessier
S
,
Ferhi
O
,
Geoffroy
MC
,
et al.
Exploration of nuclear body-enhanced sumoylation reveals that PML represses 2-cell features of embryonic stem cells.
.
Nat Commun
.
2022;
;
13
:
:5726.
.
36.
Shen
H
,
Yang
M
,
Li
S
,
et al.
Mouse totipotent stem cells captured and maintained through spliceosomal repression.
.
Cell
.
2021;
;
184
:
:2843.
–
59
.
37.
Nakatani
T
,
Torres-Padilla
ME
.
Regulation of mammalian totipotency : a molecular perspective from in vivo and in vitro studies.
.
Curr Opin Genet Dev
.
2023;
;
81
:
102 083
.
38.
Ji
S
,
Chen
F
,
Stein
P
,
et al.
OBOX regulates mouse zygotic genome activation and early development.
.
Nature
.
2023;
;
620
:
:1047.
–
53
.
39.
Taubenschmid-Stowers
J
,
Rostovskaya
M
,
Santos
F
,
et al.
8C-like cells capture the human zygotic genome activation program in vitro.
.
Cell Stem Cell
.
2022;
;
29
:
:449.
–
59
.
40.
Taubenschmid-Stowers
J
,
Reik
W
.
Human 8-cell embryo-like cells from pluripotent stem cells.
.
Curr Opin Genet Dev
.
2023;
;
81
:
:102066.
.
|