| |
| Med Sci (Paris). 40(2): 139–142. doi: 10.1051/medsci/2023209.Signalisation par la nétrine, mémoire et latéralisation du cerveau Cloé Fixary-Schuster,1* François Lapraz,1** and Stéphane Noselli1*** 1Institut de biologie Valrose (iBV), Université Côte d’Azur, CNRS, Inserm
,
Nice
,
France MeSH keywords: Humains, Encéphale, Transduction du signal, Nétrines |
L’asymétrie est une caractéristique fondamentale des organismes vivants. Elle se manifeste à toutes les échelles biologiques, de l’homochiralité des briques biochimiques (acides aminés, sucres), à l’asymétrie des cellules, tissus, organes et organisme entier, jusqu’au comportement. L’asymétrie droite-gauche (DG) est une forme d’asymétrie prépondérante qui est présente chez les animaux « bilatériens », c’est-à-dire l’ensemble des animaux à l’exception des éponges et cnidaires (méduses et coraux). Quoiqu’elle ne soit pas forcément visible extérieurement (contrairement aux asymétries antéro-postérieure et dorso-ventrale), l’asymétrie DG n’en est pas moins essentielle sur le plan fonctionnel. De nombreuses maladies du développement, ainsi qu’une proportion élevée des fausses couches, résultent de défauts d’asymétrie DG au cours de l’embryogenèse.
La plupart des travaux réalisés ces dernières années se sont focalisés sur l’asymétrie DG des organes viscéraux (
e.g.
, cœur, tube digestif), donnant lieu à plusieurs modèles mécanistiques de la brisure de symétrie, comme l’implication des cils et de la voie de signalisation de la protéine nodal, ou celle du cytosquelette d’actine et de la myosine 1D. En comparaison, les connaissances concernant les asymétries DG du système nerveux restent très limitées.
La latéralité cérébrale est présente des invertébrés jusqu’aux vertébrés, et se manifeste à différentes échelles (morphologique, activité neuronale, connectivité ou expression de gènes), mais également sous la forme de comportements latéralisés comme le langage parlé, traité en majorité (chez 95 % des personnes) par l’hémisphère gauche (aire de Broca) [
1
], ou la préférence manuelle (90 % des individus humains sont droitiers) [
2
]. Des défauts d’asymétrie cérébrale sont corrélés à de nombreux troubles cognitifs comme l’autisme, la schizophrénie ou la dyslexie [
3
]. L’origine développementale, génétique et moléculaire, ainsi que les rôles de ces asymétries restent cependant mal connus, et les études dans l’espèce humaine sont souvent controversées.
Les travaux réalisés sur des modèles animaux, dont le poulet, le poisson zèbre et le ver nématode (
Caenorhabditis elegans
), ont permis de montrer l’implication de facteurs environnementaux tels que la lumière [
4
], mais aussi de quelques gènes conservés tels que
nodal
[
5
] ou
notch
[
6
]. Ces découvertes restent cependant parcellaires, et ne permettent pas de comprendre les mécanismes sous-tendant de nombreux types d’asymétrie existant dans ces espèces. De même, les liens entre asymétries et fonctions cérébrales ne sont pas clairement identifiés, et la question de l’existence de mécanismes conservés au cours de l’évolution reste ouverte. Ces dernières années, la mouche drosophile a émergé comme un organisme modèle majeur pour l’étude des asymétries DG, avec la découverte du rôle du gène
myosine 1D
dans l’établissement des asymétries DG viscérales, un rôle conservé au cours de l’évolution chez les vertébrés [
7
,
8
]. La drosophile possède également des asymétries cérébrales qui n’avaient pas encore été étudiées en détail. Une étude récente vient de combler ce manque en identifiant les premiers gènes nécessaires à la formation de l’asymétrie cérébrale dans cette espèce, et en montrant que la perte d’asymétrie s’accompagne de défauts cognitifs spécifiques. La drosophile devient ainsi un nouveau modèle d’étude génétique et comportementale pour comprendre l’origine, l’évolution et le rôle physiologique des asymétries cérébrales.
|
La drosophile, nouveau modèle d’étude des asymétries DG cérébrales
Le cerveau de la drosophile, comme celui des autres animaux, a un aspect globalement symétrique. Il existe cependant une asymétrie DG cérébrale, sous la forme d’une paire de neuropiles
1
appelés « corps asymétriques » (CA) gauche et droit. Les CA font partie du complexe central, un ensemble de neuropiles qui joue le rôle de centre intégrateur sensoriel et moteur chez les mouches adultes (
Figure 1A
,
B
). Les CA présentent à la fois une asymétrie morphologique (le CA droit a un volume quatre fois supérieur à celui du CA gauche) [
9
] et une asymétrie de connectivité. En effet, un petit groupe de neurones (9 par hémisphère en moyenne), appelés neurones H (du fait de leur forme rappelant la lettre H) envoient leurs projections axonales uniquement dans le CA droit (
Figure 1C
,
D
) [
9
,
10
]. Il s’agit d’une asymétrie directionnelle
2,
, car elle présente un biais de population marqué, tout comme les asymétries cérébrales humaines (
e.g.
, l’aire du langage ou la préférence de main). En effet, les neurones H projettent leurs axones uniquement dans le CA droit (projections dites asymétriques) chez 95 % des drosophiles (
Figure 1E
), alors qu’ils les projettent à la fois dans les CA gauche et droit (projections dites symétriques) chez seulement 5 % des individus [
9
,
10
]. L’asymétrie de projection axonale des neurones H s’établit progressivement au cours du développement, les neurones H projetant d’abord leurs axones de façon symétrique dans les deux CA, avant la régression des axones du côté gauche : ainsi, chez 95 % des mouches adultes, seules subsistent les projections axonales dans le CA droit [
10
].
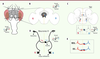 | Figure 1.
Asymétrie cérébrale droite-gauche chez la drosophile : corps asymétriques et neurones H. A.
Schéma d’une tête de drosophile adulte (vue frontale). L’emplacement du cerveau est indiqué par la zone grisée.
B.
Schéma d’une coupe frontale du cerveau passant par le complexe central, qui comprend les corps asymétriques. Toutes les vues suivantes (
B-E
) sont des vues postérieures, ce qui permet de placer les parties droite et gauche du cerveau de la mouche respectivement à droite et à gauche pour le lecteur. Les corps asymétriques gauche (en rouge) et droit (en bleu), désignés tous deux par une tête de flèche noire, se trouvent au centre du cerveau de part et d’autre de la ligne médiane (indiquée en trait pointillé jaune). Ils sont encadrés par deux neuropiles : le corps en éventail (
fan-shaped body
, en gris clair) du côté postérieur, et le corps ellipsoïde (
ellipsoid body
, en gris foncé) du côté antérieur. G : hémisphère cérébral gauche ; D : hémisphère cérébral droit.
C-D.
Les neurones H des deux hémisphères projettent leurs axones asymétriquement dans le corps asymétrique droit.
C..
Image confocale des neurones H, qui sont au nombre de 9 par hémisphère. La position des corps cellulaires de ces neurones dans l’hémisphère gauche ou l’hémisphère droit est indiquée par une tête de flèche rouge ou bleue. La ligne médiane est indiquée par une ligne en trait pointillé jaune. Les positions des corps asymétriques (CA) gauche (CAg) et droit (CAd) sont indiquées par deux ellipses, respectivement rouge et bleue. Barre d’échelle : 50 µm.
D.
Schéma des neurones H à l’âge adulte. Les corps cellulaires sont situés à la périphérie du cerveau, tandis que leurs projections axonales dans le CA sont au centre et leurs projections dendritiques
1
dans la région dorsale.
E.
L’asymétrie de projection axonale des neurones H est directionnelle. Chez 95 % des mouches de génotype « sauvage », les axones des neurones H de l’hémisphère gauche (en rouge) se projettent de façon contralatérale (
i.e.
, dans l’hémisphère opposé à celui où se trouvent leurs corps cellulaires), en traversant la ligne médiane, dans le CA droit, alors que les axones des neurones H de l’hémisphère droit (en bleu) se projettent de façon ipsilatérale (
i.e.
, dans le même hémisphère que celui où se trouvent leurs corps cellulaires) dans le CA droit. Chez les 5 % de mouches restantes, les neurones H des hémisphères gauche et droit (en rouge et en bleu, respectivement) projettent tous deux leurs axones de façon ipsilatérale et contralatérale, dans les CA gauche et droit [
10
].
1
Contrairement aux neurones des vertébrés, les neurones de la drosophile sont unipolaires, c’est-à-dire que les dendrites (fibres post-synaptiques) et les axones (fibres pré-synaptiques) sont portés par un neurite principal unique.
|
Comme dans l’espèce humaine, les asymétries DG cérébrales et viscérales sont indépendantes chez la drosophile. En effet, nous avons montré que le gène codant la myosine 1D, nécessaire et suffisant pour induire les asymétries DG viscérales, n’est pas requis pour la mise en place de l’asymétrie DG cérébrale [
10
].
|
La signalisation par la nétrine contrôle l’asymétrie de projection axonale des neurones H
Afin d’identifier les gènes requis pour la mise en place de l’asymétrie de projection axonale des neurones H, nous avons réalisé un criblage génétique par ARN interférents (ARNi) ciblant les molécules de guidage axonal. Ce criblage a révélé que plusieurs gènes impliqués dans la voie de signalisation de la nétrine B sont essentiels à l’asymétrie cérébrale (
Figure 2A
). En particulier, nous avons montré que la perte de fonction de l’un ou l’autre des deux récepteurs, Unc-5 (
uncoordinated-5
) et Frazzled (ou DCC,
deleted in colorectal cancer
), capables de se lier à la nétrine B et d’activer sa voie de signalisation, ou du ligand nétrine B (NetB) lui-même, induit une perte d’asymétrie partielle ou totale des projections des neurones H. Chez 100 % des mouches mutantes pour
unc-5
ou pour
netB
, les neurones H projettent leurs axones symétriquement (
Figure 2B
). Par quel mécanisme la voie de la nétrine B contrôle-t-elle l’asymétrie de projection axonale des neurones H ? Se pourrait-il que cette voie soit activée de façon asymétrique, d’un seul côté du cerveau (gauche ou droit) ? Pour tester cette hypothèse, nous avons induit la perte de fonction du ligand NetB ou de son récepteur Unc-5 uniquement dans l’hémisphère droit ou gauche du cerveau des mouches. Nous avons ainsi pu déterminer que l’asymétrie de projection nécessite la présence du récepteur Unc-5 dans les neurones H des hémisphères droit et gauche, tandis que la présence de son ligand NetB n’est requise que dans l’hémisphère droit (
Figure 2C
), ce qui indique donc une activité asymétrique de cette voie de signalisation.
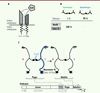 | Figure 2.
La signalisation par la nétrine B contrôle l’asymétrie de projection axonale des neurones H et la mémoire à long terme. A.
Schéma simplifié de la voie de signalisation de la nétrine B (NetB). Cette voie est impliquée dans le guidage axonal chez la drosophile et les vertébrés. Lorsque le ligand NetB interagit avec ses récepteurs Unc-5 et/ou Frazzled (Fra) exprimés à la surface des neurones, une cascade de signalisation est activée. En fonction du récepteur avec lequel NetB interagit, la réponse pourra être la répulsion (liaison à Unc-5 seul ou à Unc-5 et Fra) ou l’attraction (liaison à Fra seul) des projections axonales.
B.
La voie de signalisation de la nétrine B contrôle l’asymétrie de projection axonale des neurones H. Les résultats du criblage génétique pour la perte de fonction du ligand (NetB) et du récepteur (Unc-5) de la voie de la nétrine B sont présentés en pourcentage. Vingt cerveaux adultes ont été analysés par condition. La perte de fonction de NetB (NetB
-
), Unc-5 (Unc-5
-
) ou Fra (Fra
-
), induit une perte d’asymétrie partielle (Fra
-
) ou totale (NetB
-
ou Unc-5
-
) des projections axonales des neurones H.
C.
Modèle de contrôle de l’asymétrie de projection des neurones H par la voie de la nétrine B chez la drosophile. Au cours du stade pupe (stade intermédiaire entre la larve et l’adulte chez les diptères), le ligand NetB, à droite dans les neurones colorés en bleu-ciel (appartenant au même lignage cellulaire que les neurones H), agirait comme un signal attracteur (symbolisé par la flèche en bleu clair) pour les neurones H gauches et droits (en noir), qui expriment les récepteurs Unc-5 et Fra. À l’âge adulte, les neurones H qui projetaient leurs axones de façon symétrique dans les CA gauche et droit au stade pupe, projettent désormais leurs axones uniquement dans le CA droit. La ligne médiane est indiquée par un trait pointillé jaune. La succession des différents stades de développement de la drosophile est représentée par une frise.
|
La voie de la nétrine B est impliquée dans le guidage des axones exprimant les récepteurs Unc-5 et/ou Frazzled par un mécanisme de répulsion ou d’attraction. Ainsi, le modèle d’action de la voie de la nétrine B chez la drosophile (
Figure 2C
) implique l’activité unilatérale de NetB dans des neurones de l’hémisphère droit, qui entraîne à son tour l’activation des récepteurs Unc-5 et Frazzled dans les neurones H, induisant l’attraction ou le remodelage de leurs axones de sorte qu’ils ne se projetteront finalement que dans le CA droit.
|
La voie de la nétrine contrôle la mémoire à long terme
Quel est le rôle de la voie de la nétrine et celui des neurones H d’un point de vue fonctionnel et cognitif ? Les mouches de génotype sauvage chez lesquelles la projection axonale des neurones H est symétrique ont des défauts de mémoire à long terme. Nous avons donc évalué la performance de mutants dans plusieurs tests de mémoire, utilisant deux modèles différents. Dans un premier test, dit de conditionnement olfactif aversif, une odeur aversive est associée à un choc électrique. Après conditionnement, les drosophiles mutantes pour le gène
unc-5
ont été testées pour leur mémoire à court terme et à long terme. L’indice de performance de ces mouches pour la mémoire à court terme était identique à celui des drosophiles témoins, mais elles présentaient un défaut de mémoire à long terme similaire à celui des rares mouches de génotype sauvage chez lesquelles la projection axonale des neurones H est symétrique. Un autre test d’évaluation de la mémoire, dit test de suppression de parade nuptiale, qui teste la capacité de mouches mâles sans expérience nuptiale à mémoriser leur rejet par des femelles déjà accouplées, a confirmé le résultat du test précédent, à savoir une perte de mémoire à long terme sans atteinte de la mémoire à court terme chez les mutants
unc-5
.
|
Nous avons montré que la voie de signalisation de la nétrine B, impliquée dans le guidage axonal, contrôle l’asymétrie de projection axonale des neurones H du cerveau de la mouche drosophile grâce à l’activité unilatérale de la nétrine, qui est restreinte à l’hémisphère cérébral droit. Les défauts de la mémoire à long terme constatés chez des drosophiles mutantes pour cette voie de signalisation, qui ont perdu cette asymétrie de projection axonale, indiquent que l’asymétrie de circuits neuronaux est nécessaire pour certaines fonctions cognitives dans cette espèce.
L’existence de nombreux outils génétiques permettant diverses approches expérimentales chez la drosophile, mais également la récente publication de plusieurs connectomes
3
du cerveau adulte, font de cette mouche un modèle intégré présentant de nombreux avantages pour tenter d’élucider les fondements de la latéralité du cerveau. Quels sont les gènes et les mécanismes contrôlant l’asymétrie du système nerveux ? Ont-ils été conservés au cours de l’évolution des espèces ? Existe-t-il d’autres asymétries cérébrales chez la mouche, et sont-elles contrôlées par les mêmes gènes ? Quelles sont les fonctions cognitives fondées sur ces asymétries, et quel avantage évolutif procurent-elles ? Quels sont les mécanismes conduisant à une minorité de mouches dépourvues de ces asymétries au sein d’une population ? Autant de questions auxquelles de futurs travaux de recherche devront s’efforcer de répondre.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Broca
PP
.
Perte de la parole, ramollissement chronique et destruction partielle du lobe antérieur gauche du cerveau.
.
Bulletin de la Société anthropologique
.
1861;
;
2
:
:235.
–
8
.
2.
McManus
IC
,
Davison
A
,
Armour
JAL
.
The evolution of human handedness.
.
Ann N Y Acad Sci
.
2013;
;
1288
:
:48.
–
58
.
3.
Markou
P
,
Ahtam
B
,
Papadatou-Pastou
M
.
Elevated levels of atypical handedness in autism : meta-analyses.
.
Neuropsychol Rev
.
2017;
;
27
:
:258.
–
283
.
4.
Rogers
LJ
.
Light experience and asymmetry of brain function in chickens.
.
Nature
.
1982;
;
297
:
:223.
–
225
.
5.
Concha
ML
,
Burdine
RD
,
Russell
C
,
et al.
A nodal signaling pathway regulates the laterality of neuroanatomical asymmetries in the zebrafish forebrain.
.
Neuron
.
2000;
;
28
:
:399.
–
409
.
6.
Poole
RJ
,
Hobert
O
.
Early embryonic programming of neuronal left/right asymmetry in C. elegans.
.
Curr Biol
.
2006;
;
16
:
(2)
:279.
–
292
.
7.
Spéder
P
,
Ádám
G
,
Noselli
S
.
Type ID unconventional myosin controls left – right asymmetry in Drosophila.
.
Nature
.
2006;
;
440
:
:803.
–
807
.
8.
Lebreton
G
,
Géminard
C
,
Lapraz
F
,
et al.
Molecular to organismal chirality is induced by the conserved myosin 1D.
.
Science
.
2018;
;
362
:
:949.
–
952
.
9.
Wolff
T
,
Rubin
GM
.
Neuroarchitecture of the Drosophila central complex : A catalog of nodulus and asymmetrical body neurons and a revision of the protocerebral bridge catalog.
.
J Comp Neurol
.
2018;
;
526
:
(2)
:585.
–
611
.
10.
Lapraz
F
,
Boutres
C
,
Fixary-Schuster
C
,
et al
.
Asymmetric activity of netrin B controls laterality of the Drosophila brain.
.
Nat Comm
.
2023;
;
14
:
:1052.
.
|



