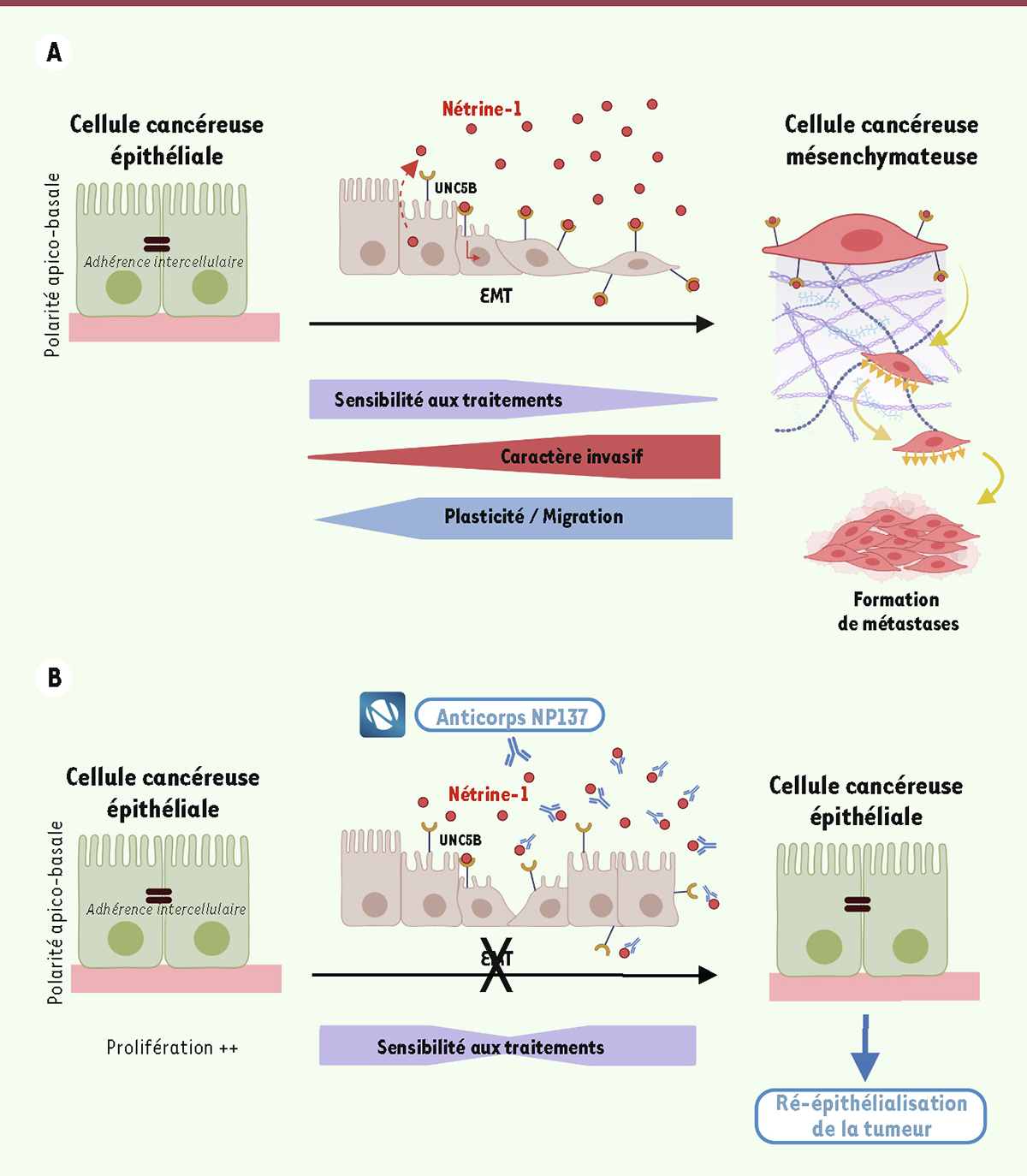
La transition épithélio-mésenchymateuse est un processus dynamique et réversible par lequel les cellules passent d’un état épithélial d’adhérence intercellulaire, à un état mésenchymateux, de plus grande mobilité, caractérisé par une perte de la polarité cellulaire et par une modification de l’organisation du cytosquelette ( Figure 1A ), leur permettant de migrer vers un site distant, mais également d’acquérir une grande plasticité, et ainsi de mieux s’adapter à leur environnement [ 1 ]. Cette transition joue un rôle important au cours du développement embryonnaire car elle permet à des cellules initialement épithéliales de migrer et coloniser différents tissus distants. Elle est physiologiquement peu active à l’âge adulte, mais peut être réactivée en conditions inflammatoires, notamment pour la régénération tissulaire à la suite d’une blessure. Par ailleurs, une transition épithélio-mésenchymateuse inappropriée est associée à certaines situations pathologiques, notamment à la fibrose, ou encore à l’invasion tumorale associée à la formation de métastases. En effet, la transition épithélio-mésenchymateuse permet aux cellules cancéreuses de se détacher de la tumeur primaire, de migrer vers d’autres organes et d’y former des métastases souvent incontrôlables, un processus responsable de la plupart des échecs de traitements anti-cancéreux [ 2 ]. La transition épithélio-mésenchymateuse suscite un intérêt croissant dans la recherche cancérologique également en raison de son implication potentielle dans la récidive du cancer, car les cellules tumorales qui subissent cette transition deviennent plus résistantes aux traitements conventionnels tels que la chimiothérapie et la radiothérapie, du fait par exemple de leur faible activité mitotique et des changements d’activation de certaines voies de signalisation, leur conférant une grande plasticité ( Figure 1A ).
| Figure 1.
Transition épithélio-mésenchymateuse des cellules cancéreuses et ciblage thérapeutique de la nétrine-1. A.
Représentation schématique du processus de transition épithélio-mésenchymateuse (EMT) et des principaux changements qui y sont associés.
B.
Blocage de l’interaction entre la nétrine-1 et son récepteur UNC5B par l’anticorps NP137, inhibant la transition épithélio-mésenchymateuse des cellules cancéreuses à des stades initiaux, ce qui permet la réépithélialisation de la tumeur.
|
Quelques approches thérapeutiques ciblant la transition épithélio-mésenchymateuse dans le cancer commencent à émerger. En effet, certains inhibiteurs des voies de signalisation impliquées dans cette transition, telles que la voie de la cytokine TGF-β ( transforming growth factor β), ou le ciblage de molécules d’adhérence cellulaire sont en cours de développement, mais cibler ces molécules aux effets pléiotropiques s’avère particulièrement compliqué du point de vue médical. D’autres approches ciblant des facteurs de transcription spécifiques de la transition épithélio-mésenchymateuse, comme ZEB ( zinc finger E-box-binding homeobox ), snail et twist, sont également à l’étude, mais la localisation de ces protéines dans le noyau cellulaire constitue un obstacle difficile à surmonter. Deux articles publiés en août 2023 ont rapporté les résultats de travaux de recherche visant à inhiber la transition épithélio-mésenchymateuse de cellules cancéreuses en ciblant la protéine nétrine-1, dans un modèle murin de cancer de la peau [ 3 ] et dans le cancer de l’endomètre touchant les femmes [ 4 ].
La nétrine-1 est une protéine sécrétée, d’abord découverte pour son rôle de guidage de la croissance axonale des neurones au cours du développement embryonnaire [ 5 ]. Elle a vraisemblablement un rôle global de guidage des cellules, lors de leur migration et de leur assemblage, au cours du développement des organes à partir de systèmes « branchés » (i.e., composés de multiples connexions et ramifications) comme le système nerveux, le poumon, le rein, ou le système vasculaire [ 6 ]. La nétrine-1, dont l’expression est très souvent éteinte dans les tissus matures, est fortement réexprimée dans la plupart des cancers, et particulièrement dans les cancers métastatiques [ 7 , 8 ], ce qui en fait une cible thérapeutique intéressante [ 9 ] ( → ).
→ Voir la Synthèse de M. Bellina et A. Bernet, m/s n° 4, avril 2022, page 351
En effet, on peut supposer que la nétrine-1 agit également comme une molécule de guidage des cellules tumorales, favorisant leur migration et l’invasion des tissus environnants, bien que les mécanismes soient encore peu documentés.
La nétrine-1 se lie au récepteur à dépendance 1 UNC5B ( Unc-5 netrin receptor B ). Nous avons montré que lorsqu’on empêche la nétrine-1 de se lier à ce récepteur, celui-ci active une voie de signalisation qui induit la mort de la cellule par apoptose [ 10 ]. Cette découverte a ouvert une perspective thérapeutique pour les cancers surexprimant la nétrine-1, et a conduit à la mise au point d’un anticorps monoclonal humanisé, NP137, dirigé contre cette protéine [ 9 , 11 ].
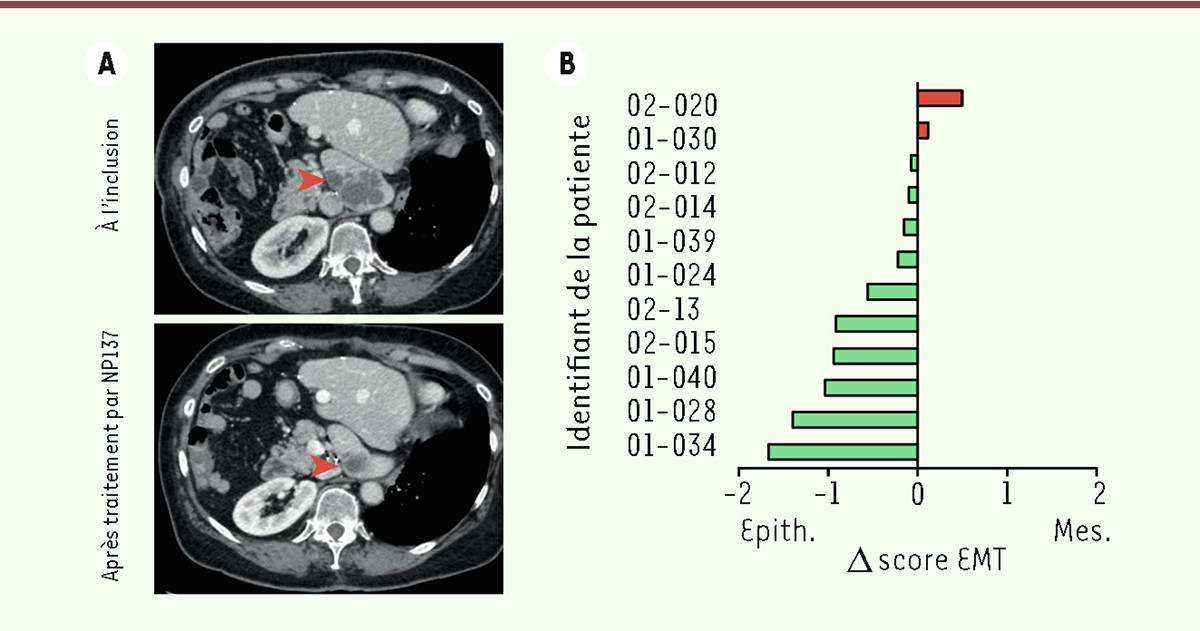
L’implication de la nétrine-1 dans la transition épithélio-mésenchymateuse, quant à elle, a été récemment mise en évidence dans un modèle murin de carcinome épidermoïde de la peau. Dans ce modèle où apparaît spontanément une transition épithélio-mésenchymateuse associée à des métastases pulmonaires, la nétrine-1 est l’une des protéines les plus exprimées lors du déclenchement de cette transition, parallèlement à l’expression de son récepteur UNC5B ( Figure 1A ) [ 4 ]. De plus, dans un modèle murin de cancer de l’endomètre, l’anticorps NP137 dirigé contre la nétrine-1 inhibe la transition épithélio-mésenchymateuse ( Figure 1B ) [ 3 ]. Dans un essai clinique de phase I portant sur le cancer de l’endomètre ( ClinicalTrials. gov : NCT02977195 ), des signes d’efficacité thérapeutique de cet anticorps, sans aucun effet toxique, ont été observés chez les participantes [ 4 ]. Par ailleurs, l’analyse des biopsies de la tumeur chez des femmes atteintes de ce cancer avant et après deux cycles de traitement avec l’anticorps NP137 a montré que les tumeurs, non seulement avaient régressé ( Figure 2A ), mais également avaient perdu leur caractère mésenchymateux au profit d’un caractère plus épithélial ( Figure 2B ) [ 4 ]. De plus, comme attendu lorsque les tumeurs sont plus épithéliales, nous avons constaté, dans chacun des modèles murins traités par NP137, une efficacité augmentée de la chimiothérapie en combinaison avec cet anticorps [ 3 , 4 ], indiquant une potentielle synergie des deux traitements.
| Figure 2.
Réponse clinique au traitement par l’anticorps NP137 ciblant la nétrine-1 et effet sur la transition épithélio-mésenchymateuse dans les cancers de l’endomètre. A.
Images de tomodensitométrie abdominale d’une patiente présentant des métastases au foie (flèche rouge), à l’inclusion (en haut) et après trois cycles de traitement par NP137 (en bas).
B.
Représentation graphique de l’évolution du score de transition épithélio-mésenchymateuse (score EMT) chez 12 patientes atteintes d’un cancer de l’endomètre après trois cycles de traitement par NP137 par rapport à l’inclusion. Δ , 0 indique une évolution vers un phénotype épithélial (Epith., en vert), et Δ . 0 une évolution vers un phénotype mésenchymateux (Mes., en rouge).
|
Les résultats de ces travaux de recherche montrent pour la première fois, dans des modèles murins et directement chez l’homme, que la nétrine-1 est impliquée dans la transition épithélio-mésenchymateuse des cellules cancéreuses. Celle-ci étant étroitement liée à l’inflammation, l’angiogenèse et l’immunité, nous avons également étudié les changements induits par le traitement avec l’anticorps anti-nétrine-1 sur le microenvironnement des tumeurs. Nous avons constaté une diminution de l’hypoxie, de l’angiogenèse et de la réponse inflammatoire, dont il reste à explorer les mécanismes. En effet, même si cette nouvelle thérapie semble prometteuse et que son efficacité est aujourd’hui testée médicalement, en combinaison avec les traitements conventionnels et contre différents types de cancers, il importe d’en explorer tous les effets afin d’être en mesure de déterminer avec précision quels patients pourront en bénéficier.