© L. Castellano
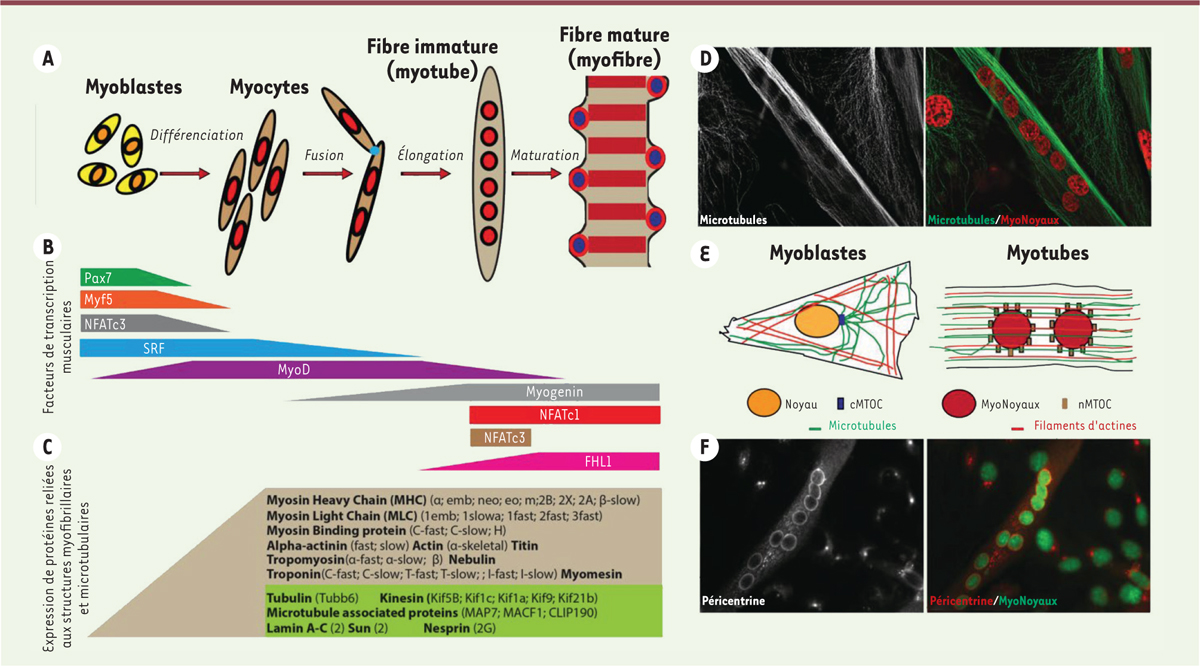
Les muscles striés squelettiques sont des cellules géantes résultant de la fusion de cellules progénitrices spécialisées appelées myoblastes. Ces cellules musculaires, aussi appelées fibres musculaires (ou myofibres) contiennent par conséquent des centaines de noyaux qui ont la particularité d’être régulièrement espacés tout le long de la fibre musculaire et positionnés à la périphérie de celle-ci, en conditions physiologiques ( Figure 1A ). Certains noyaux ne suivent pas cette règle et s’agrègent par petits groupes dans des zones spécifiques comme la jonction neuromusculaire et la jonction myotendineuse [ 1 ]. Le processus de différenciation musculaire requiert l’expression successive de facteurs de transcription spécifiques appelés facteurs de régulation myogéniques (ou MRFs). Ceux-ci contrôlent l’expression de protéines exclusivement associées à la myofibrillogénèse et permettent la maturation des fibres en cellules contractiles ( Figure 1B-C ). La distribution régulièrement espacée des noyaux et leur positionnement en périphérie façonnent des domaines nucléaires dans la fibre musculaire. Ceux-ci sont définis comme des territoires théoriques contrôlés transcriptionnellement par chaque noyau et garantissant une intégrité fonctionnelle et coordonnée tout le long de la myofibre [ 2 ]. Des études ont démontré que l’altération de la localisation des noyaux dans les fibres musculaires est associée à une mauvaise fonctionnalité de ces dernières, suggérant que des déplacements aberrants et/ou le changement de forme des noyaux au sein de la fibre musculaire pourraient contribuer à une dégradation progressive de la fonction musculaire [ 2 ]. On sait désormais que les forces mécaniques internes et externes appliquées aux cellules contribuent à des changements à la fois de la structure et de la composition de l’enveloppe nucléaire et par conséquent contrôlent l’organisation de la chromatine et l’expression génique [ 3 , 4 ]. Trois réseaux de cytosquelette ont été identifiés dans les cellules comme contributeurs à cette mécano-transduction : les filaments d’actine, les filaments intermédiaires et les microtubules. Parmi ceux-ci, le réseau microtubulaire apparaît comme un acteur clé dans la régulation de cet équilibre des forces à l’intérieur de la fibre musculaire. Dans les premières étapes du développement des myofibres, les microtubules (MTs) sont des structures essentielles à la formation des domaines nucléaires. Elles servent de guide pour la polarisation des cellules et de socle pour la répartition des noyaux dans les fibres musculaires, ceci en partie grâce à la contribution de nombreux moteurs moléculaires (dynéines et kinésines) et de protéines associées aux microtubules (MAPs) (MAP7, Clip190…) ( Figure 1C ) [ 5 ].
| Figure 1.
Schéma simplifié de la formation d’une myofibre et de l’organisation du réseau microtubulaire au cours de la différenciation musculaire. A/B/C.
Représentation schématique des étapes de la formation d’une fibre musculaire
(A)
accompagnée des vagues d’activation successives des facteurs de régulation myogénique
(B)
ainsi que des protéines de l’appareil contractile et protéines associées au réseau microtubulaire
(C). D.
Immunofluorescence représentant l’organisation du réseau microtubulaire dans les fibres musculaires immatures. Les microtubules sont représentés en vert et les noyaux en rouge sur le panel de droite. E.Représentation schématique de l’organisation du réseau microtubulaire dans des cellules mononucléées non-différenciées (gauche) et dans des fibres musculaires immatures (droite).
F.
Exemple de localisation de la péricentrine autour de l’enveloppe nucléaire dans des fibres musculaires immatures. La péricentrine est représentée en rouge et les noyaux en vert.
|
Les MTs sont présents dans toutes les cellules eucaryotes, formant une structure dynamique en perpétuel remodelage. Les MTs sont composés d’hétérodimères de tubuline-α et -β qui s’associent longitudinalement en une structure appelée protofilament. Ils s’agencent ensuite latéralement pour former un tube creux de 25 nm de diamètre [ 6 ]. Les MTs sont des structures intrinsèquement dynamiques pouvant s’assembler ou se désassembler dans la cellule. Leur dynamique peut être régulée par (1) leur composition (différentes isoformes sont possibles), (2) leurs modifications post-traductionnelles (tyrosination, acétylation…) et (3) leurs interacteurs dans la cellule, comme les MAPs ou les moteurs moléculaires ( Figure 1C ) [ 7 ]. Les MTs sont essentiels pour le bon positionnement des organites dans la cellule, pour le transport intracellulaire ou encore pour la formation du fuseau mitotique au cours de la division cellulaire, l’ensemble contribuant au bon fonctionnement biologique des cellules [ 8 , 9 ]. Le réseau microtubulaire assure aussi l’organisation des noyaux dans les fibres musculaires en développement [ 10 – 13 ]. En effet, au cours de la différenciation des cellules musculaires, l’architecture du réseau microtubulaire est totalement remaniée, structurant un réseau antiparallèle entre chaque noyau dans les myotubes ( Figure 1D ) et aboutissant dans les fibres musculaires matures à la formation d’un réseau tridimensionnel [ 14 ]. Ce remaniement est rendu possible par la réorganisation du centre de nucléation des microtubules au cours de la myogenèse. Dans les cellules mononucléées non différenciées, les MTs émanent principalement de façon radiale dans le cytoplasme, à partir du centrosome, juxtaposé au noyau. Dans les fibres musculaires en formation, le centrosome n’existe plus et une partie de ses composants se retrouvent libérés dans le cytoplasme. L’expression spécifique de protéines du complexe LINC ( LInker of Nucleoskeleton and Cytoskeleton ), telle que la nesprine-2, au niveau de l’enveloppe nucléaire, permet la relocalisation d’autres acteurs comme la péricentrine au niveau de la membrane des noyaux des fibres musculaires, formant ainsi un centre de nucléation des MTs nucléaires (nMTOC) ( Figure 1E-F ). Cette nouvelle organisation permet aux MTs de relocaliser en zone périnucléaire de nombreuses protéines pour former un grillage protecteur autour des noyaux périphériques [ 15 ]. Ce nouvel équilibre de forces mécaniques ainsi appliquées sur l’enveloppe nucléaire dans les fibres musculaires matures permet le maintien de l’intégrité transcriptionnelle de celles-ci.
De nombreuses myopathies sont associées à une dérégulation à la fois de l’organisation des MTs et à une altération du positionnement nucléaire.
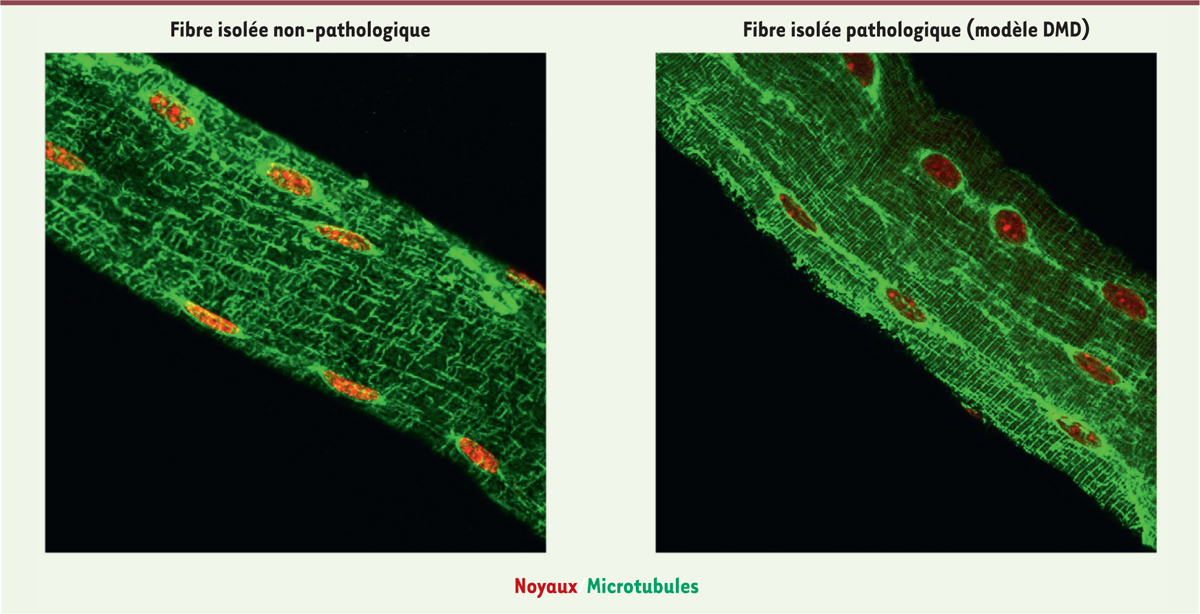
La dystrophie musculaire de Duchenne (DMD) est une maladie génétique causée par la perte de l’expression d’une protéine associée aux MTs, la dystrophine, conduisant à une forte perturbation de l’organisation du réseau des MTs [ 16 , 17 ] ( Figure 2 ). La dystrophine contribue au maintien de l’architecture musculaire en participant au complexe transmembranaire reliant le cytosquelette à l’environnement extracellulaire [ 18 ]. La surexpression d’un isotype spécifique de la tubuline-β (Tubb6) participe également à la désorganisation du réseau microtubulaire dans la DMD [ 19 ].
| Figure 2.
Comparaison du réseau microtubulaire en condition physiologique et pathologique.
Immunofluorescence sur fibres musculaires isolées, réalisées sur le
Tibialis Anterior
de souris contrôle (condition non-pathologique, gauche) ou de souris modèle de la myopathie de Duchenne (mdx, condition pathologique, droite). Les noyaux sont représentés en rouge et les MTs en vert.
|
L’absence de facteurs d’ancrage du réseau microtubulaire à d’autres cytosquelettes, tel que la protéine MACF1, conduit à des pathologies neuromusculaires [ 20 ]. En absence de MACF1, une altération du réseau microtubulaire le long de la fibre musculaire et au niveau de la jonction neuromusculaire (JNM) est observée. Ce phénotype s’accompagne d’une internalisation des noyaux au sein de la fibre musculaire et d’une diminution du recrutement de ceux-ci au niveau de la JNM [ 13 ].
Certaines pathologies neuromusculaires sont également associées à un défaut de modifications post-traductionnelles de la tubuline. En effet, la stabilisation des MTs est en partie rendue possible grâce à son acétylation et est nécessaire pour garantir l’intégrité fonctionnelle des JNMs [ 21 ]. L’intégrité fonctionnelle du tissu cardiaque peut également être affectée par une désorganisation du réseau microtubulaire liée à une connexion entre la dynamique des MTs et leur tyrosination [ 22 ].
La sarcopénie est une pathologie liée à l’âge, elle se définit par une baisse progressive et généralisée de la masse musculaire, de la force et de la performance physique au cours du vieillissement. L’accumulation de ces facteurs entraîne des changements de dynamique des fibres musculaires. En effet, les MTs sont plus rigides et plus stables, et le trafic des organelles dans la cellule est perturbé. De façon remarquable, les noyaux ne sont plus localisés à la périphérie des fibres musculaires mais ont tendance à être internalisés, le mécanisme de mécano-transduction étant également modifié. Par conséquent, l’homéostasie cellulaire en général est affectée [ 23 ].
D’autres pathologies se caractérisent par une désorganisation générale de la fibre musculaire, avec un positionnement anormal d’organelles et une centralisation de la localisation des noyaux, qui ne sont pas associées à un processus de régénération musculaire [ 24 , 25 ]. Ces pathologies sont appelées myopathies centronucléaires (CNMs). La faiblesse musculaire est une caractéristique commune à tous les patients mais leur sévérité est très variable [ 26 ]. Le lien entre l’altération du réseau microtubulaire et les phénotypes cellulaires observés dans les CNMs ne sont pas parfaitement établis. Un des gènes impliqués dans les CNMs est celui codant la dynamine 2 (DNM2), qui est une MAP [ 27 ]. Compte tenu de l’importance des MAPs dans la dynamique du réseau microtubulaire, il est envisageable que cette protéine puisse contrôler localement l’architecture des MTs, par exemple, en interférant avec la fonction du centre de nucléation des microtubules dans les fibres musculaires.
Compte tenu de l’importance des MTs dans de nombreux processus cellulaires et notamment dans le maintien de l’homéostasie du muscle squelettique, comprendre comment les MTs sont régulés et leur rôle est un enjeu capital dans la compréhension des pathologies musculaires. La compréhension détaillée de ce réseau dans les myopathies pourrait identifier les MTs et/ou certains interacteurs, comme cibles thérapeutiques communes à ces pathologies. Certaines études ont déjà montré leur efficacité. En effet, la régulation pharmacologique de HDAC6 permet d’améliorer le phénotype musculaire du modèle murin de la DMD [ 28 ].