| |
| Med Sci (Paris). 39: 32–36. doi: 10.1051/medsci/2023134.Une cible thérapeutique prometteuse dans la myopathie myotubulaire Marie Goret,1 Xènia Massana-Muñoz,1 Vasugi Nattarayan,1 David Reiss,1 and Jocelyn Laporte1* 1Institut de Génétique et de Biologie Moléculaire et Cellulaire (IGBMC), INSERM U1258, CNRS UMR7104, Université de Strasbourg
,
Illkirch
,
France |
© M. Goret
La myopathie myotubulaire liée à l’X (XLCNM) est une maladie congénitale rare affectant principalement les muscles squelettiques. Elle est causée par des mutations dans le gène
MTM1
codant une protéine appelée myotubularine [
1
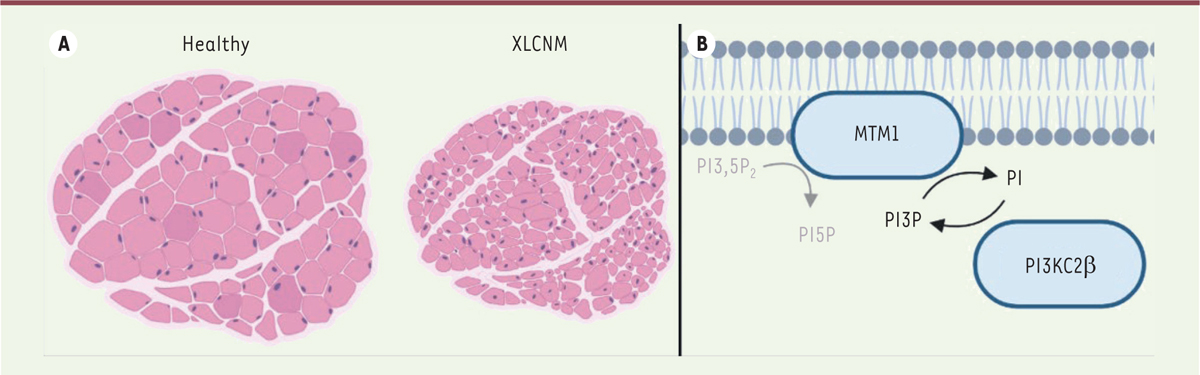
]. Cette protéine est requise pour une bonne organisation et pour le fonctionnement des fibres musculaires et sa déficience entraîne une faiblesse musculaire généralisée et une hypotonie. Les symptômes varient d’un patient à l’autre mais comprennent souvent une faiblesse musculaire précoce et sévère, des difficultés respiratoires et une dysphagie. Au niveau cellulaire, la myopathie myotubulaire est caractérisée par une altération de la structure et de la fonction des cellules musculaires avec notamment une hypotrophie des fibres et une centralisation anormale des noyaux (
Figure 1A
). Au niveau moléculaire, la myotubularine est une phosphatase déphosphorylant certains lipides, notamment le phosphoinositide PtdIns3
P
(
Figure 1B
). Les phosphoinositides sont des phospholipides impliqués dans la transduction des signaux et le trafic membranaire [
2
]. Cette myopathie est liée à une perte de myotubularine et à une augmentation des niveaux de PtdIns3
P
[
3
]. Il n’existe actuellement aucun traitement curatif. Récemment, des études [
4
,
5
] ont montré que la perte totale de la PtdIns-3-kinase PI3KC2β, enzyme catalysant la réaction opposée à la myotubularine (
Figure 1B
) et acteur clé du trafic endosomal et de la signalisation mTORC1 [
6
], améliore le phénotype d’un modèle de souris de myopathie myotubulaire. Cependant, il reste à démontrer s’il est nécessaire ou suffisant de cibler l’activité kinase de PI3KC2β pour obtenir un effet thérapeutique.
 | Figure 1.
Caractéristiques histologiques et implications moléculaires liées à une perte de myotubularine. A.
Illustration d’un marquage hématoxyline-éosine sur section musculaire saine (à gauche) et XLCNM (à droite), mettant en évidence l’hypotrophie des fibres dans le cas XLCNM ainsi que la présence de noyaux centraux.
B.
Illustration de la fonction cellulaire de la myotubularine. MTM1 déphosphoryle des phosphoinositides telle que PtdIns3P (figure créée avec BioRender.com).
|
|
L’inactivation de la kinase PI3KC2β dans un modèle murin de myopathie myotubulaire
Notre étude s’intéresse à la nécessité, ou non, de cibler l’activité kinase de PI3KC2β pour améliorer le phénotype des souris mutantes. Pour cela, nous avons inhibé l’activité kinase de PI3KC2β tout en maintenant le niveau normal d’expression de cette protéine via une mutation ponctuelle du site actif, dans les souris modèles de la myopathie myotubulaire associée à la perte du gène
Mtm1
. Pour générer ces animaux, nous avons croisé une souris présentant une kinase-inactive (
Pik3c2b
D1212A
) avec une souris présentant un phénotype proche de la maladie, la souris
Mtm1
knock-out (
Mtm1
-/y
) afin d’obtenir des souris doublement mutantes. Les descendants
Mtm1
-/y
Pik3c2b
D1212A/D1212A
ont fait l’objet d’un phénotypage approfondi de la fonction et de la structure musculaires à l’âge de cinq semaines.
|
L’inhibition spécifique de l’activité kinase de PI3KC2β prolonge la survie et rétablit la force
Nous avons généré et étudié six groupes de souris : un groupe de souris sauvages (WT/WT), un groupe avec une inactivation partielle (mutation hétérozygote) ou totale (mutation homozyote) de
Pi3kc2b
pour vérifier l’absence d’effets secondaires majeurs (WT/HE et WT/HO), un groupe malade
Mtm1
-/y
(KO/WT) et un groupe
Mtm1
-/y
combiné avec une inactivation partielle (KO/HE) ou totale (KO/HO) de
Pi3kc2b
afin d’évaluer le potentiel thérapeutique de cette inactivation.
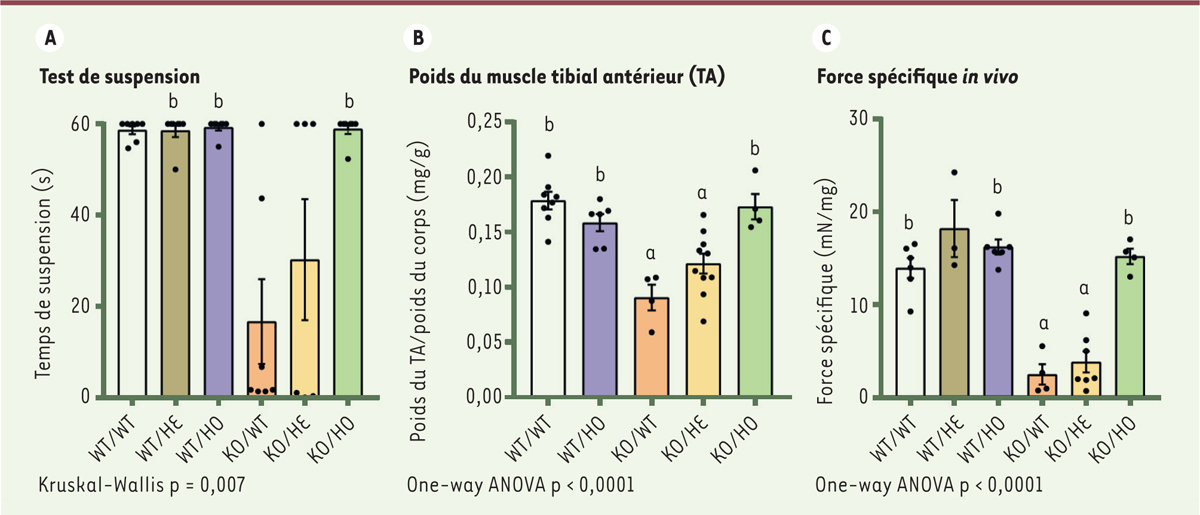
Comme précédemment montré, les souris KO/WT présentaient les principaux symptômes de la maladie, en l’occurrence une myopathie progressive apparaissant à partir de trois semaines et menant au décès avant douze semaines, avec une survie moyenne de sept semaines. L’inactivation totale de la kinase a permis une survie des animaux KO/HO jusqu’à la fin de l’étude, soit 16 semaines. L’inactivation partielle de la kinase a conduit à la survie de 43 % des animaux KO/HE jusqu’à seize semaines. Les souris KO/HO présentaient un comportement similaire à celui des WT/WT. Leur fonction motrice a été testée en évaluant la capacité de l’animal à se suspendre à une grille à l’âge de quatre semaines. Alors que les souris KO/WT avaient des performances réduites (temps de suspension de 16 secondes), les souris KO/HE atteignaient 30 secondes et les souris KO/HO atteignaient le temps maximum testé de 60 secondes, comme le groupe WT/WT (
Figure 2A
).
 | Figure 2.
L’inhibition de l’activité kinase de PI3KC2b prévient la faiblesse musculaire des souris Mtm1
-/y
. A.
Test de suspension à quatre semaines. La durée de suspension des souris à une grille inversée est mesurée, temps limite = 60s (6 ≤ n ≤ 7).
B.
Poids du muscle Tibial Anterieur (TA) normalisé au poids des souris à cinq semaines (4 ≤ n ≤ 10).
C.
Mesure de la force musculaire développée par le TA, normalisée au poids du muscle (3 ≤ n ≤ 7). a : < 0,05 vs WT/WT ; b : p < 0,05 vs KO/WT.
|
Les souris KO/HO présentaient un poids corporel similaire à celui des contrôles, de 28 à 30 grammes, alors que les souris KO/WT et KO/HE ne pesaient pas plus de 15 g. La forte diminution du poids corporel chez les souris KO/WT et KO/HE est principalement due à une atrophie musculaire généralisée. Le poids de plusieurs muscles, comme le tibial antérieur (TA), était diminué chez les souris KO/WT et a été totalement rétabli chez les souris KO/HO (
Figure 2B
). La force spécifique du muscle tibial isolé est fortement diminuée chez les animaux KO/WT et KO/HE et normalisée chez les souris KO/HO (
Figure 2C
). Globalement, l’inhibition totale de l’activité kinase de PI3KC2β prolongeait la survie et normalisait l’atrophie et la force musculaire des souris KO/WT atteintes de myopathie myotubulaire.
|
L’inhibition spécifique de PI3KC2β prévient les défauts histologiques et ultra-structuraux des fibres musculaires
L’inhibition de l’activité kinase de PI3KC2β améliorant l’atrophie et la faiblesse musculaire des souris
Mtm1
-/y
, nous avons étudié ces aspects à l’échelle des myofibres. A cinq semaines de vie, les souris
Mtm1
-/y
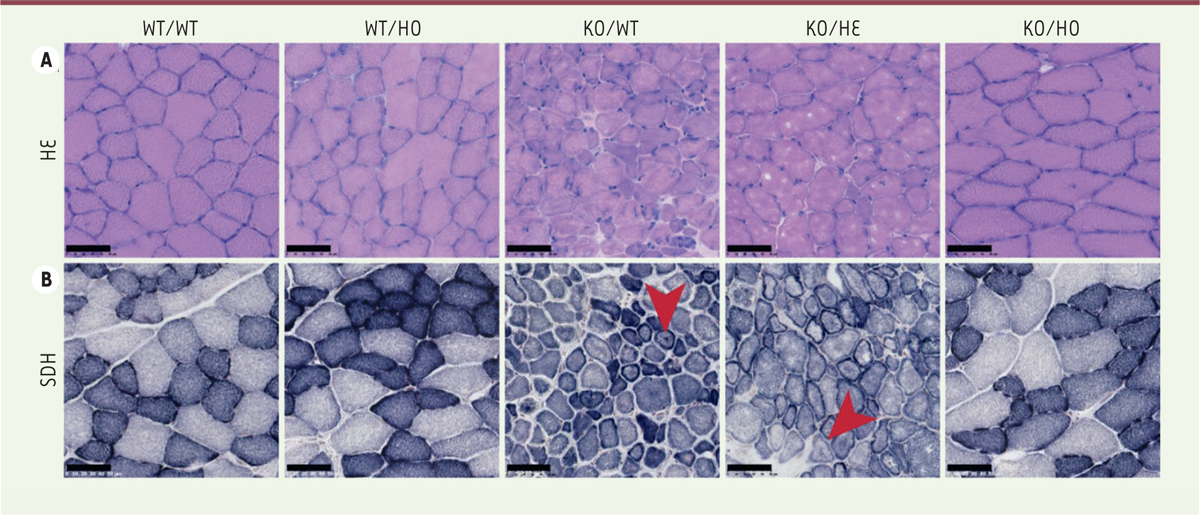
présentaient des fibres de taille réduite par rapport aux contrôles (
Figure 3A
) ainsi qu’une accumulation anormale de coloration oxydative (
Figure 3B
), deux caractéristiques histopathologiques similaires à celles observées chez les patients atteints de XLCNM.
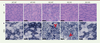 | Figure 3.
L’inhibition de l’activité kinase de PI3KC2b prévient les défauts histopathologiques chez la souris Mtm1-/y. A.
Coloration hématoxyline-éosine de coupes musculaires de Tibial Antérieur (TA) à 5 semaines.
B.
Coloration succinate déhydrogénase sur coupes musculaires de TA à 5 semaines. Les myofibres des animaux Mtm1
-/y
présentaient une hypotrophie ainsi qu’une accumulation anormale du marquage SDH (flèches), défauts prévenus par l’inactivation totale de l’activité kinase de PI3KC2β.
|
Chez les animaux KO/HO, la coloration hématoxyline-éosine (HE) a révélé un aspect et un diamètre normal des myofibres (
Figure 3A
). L’inactivation de la kinase a également permis de prévenir les défauts d’activité oxydative (
Figure 3B
). Le pourcentage de fibres présentant une accumulation anormale de la coloration de la succinate déshydrogénase (SDH) des mitochondries est passé de 32,4 % chez les KO/WT à 2,3 % chez les KO/HO, contre 0 % chez les WT/WT, reflétant une correction du positionnement des mitochondries. Ces colorations ont également été réalisées chez des souris plus âgées, à seize semaines de vie. Alors qu’aucune souris
Mtm1
-/y
ne survit jusqu’à seize semaines, les KO/HO présentaient de légers défauts histologiques notamment une diminution du nombre de fibres à large diamètre et une accumulation centrale de coloration oxydative SDH dans certaines fibres (non montré). Ainsi, l’inactivation homozygote de la kinase PI3KC2β a permis de retarder l’apparition du phénotype histopathologique chez les souris
Mtm1
-/y
.
L’inhibition de l’activité kinase de PI3KC2β ayant permis une forte amélioration de l’histologie musculaire, la microscopie électronique a été utilisée pour évaluer de façon plus détaillée l’organisation intracellulaire des myofibres (non montré). L’analyse ultrastructurale a révélé une forte désorganisation interne des sarcomères (sous-unités musculaires) chez les souris
Mtm1
-/y
avec notamment un décalage des lignes Z et une disparition des bandes A et I. L’inactivation partielle de la kinase PI3KC2β (KO/HE) a permis une amélioration de la structure, avec cependant une persistance de défauts d’alignements et une augmentation de l’espace inter-myofibrillaire. L’organisation générale était normale chez les souris KO/HO. De façon similaire, les triades, des structures importantes pour le processus d’excitation/contraction présentaient des défauts chez les souris
Mtm1
-/y
qui n’étaient plus présents chez les KO/HO. Ainsi, l’inactivation homozygote de la kinase PI3KC2β a permis de prévenir la désorganisation interne des sarcomères et des triades, alors que l’inactivation hétérozygote a permis une amélioration partielle.
|
Une amélioration phénotypique corrélée à une normalisation des niveaux de PtdIns3P, de la localisation cellulaire de l’intégrine β1, et de l’activité de mTORC1
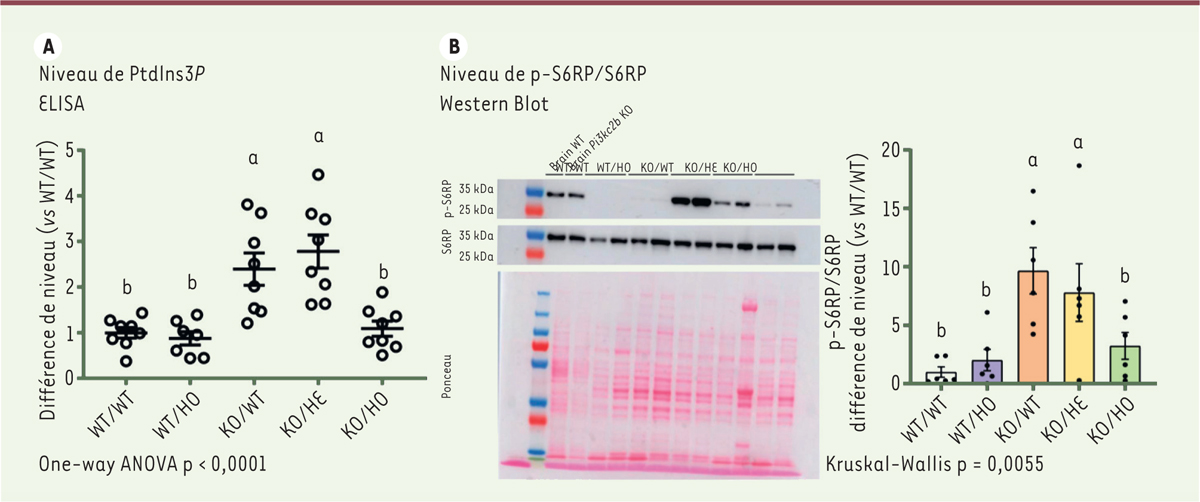
PI3KC2β et MTM1 étant impliquées respectivement dans la phosphorylation/ déphosphorylation du phosphoinositide PtdIns3
P,
son niveau a été mesuré dans le muscle par méthode ELISA. La myopathie myotubulaire est liée à une augmentation de 2,5 fois du niveau de PtdIns3
P
dans les muscles de souris KO/WT par rapport aux contrôles WT/WT (
Figure 4A
). Le niveau de PtdIns3
P
normalisé chez les souris KO/HO suggère que le rééquilibrage du niveau de ce lipide est à la base des améliorations obtenues dans le modèle de myopathie.
 | Figure 4.
L’inhibition de l’activité kinase de PI3KC2b normalise les niveaux de PtdIns3P et l’activité de la voie mTORC1 chez les souris Mtm1-/y. A.
Quantification des niveaux de PtdIns3P dans le muscle gastrocnémien à 5 semaines par ELISA (7 ≤ n ≤ 8).
B.
Western blot d’extrait de muscle Tibialis Antérieur et de cerveau, marqué avec des anticorps anti-p-S6RP et anti-S6RP, chacun normalisé par rapport à la coloration au ponceau et quantifié en tant que ratio forme phosphorylée/forme totale (n = 6). a : < 0,05 vs WT/WT ; b : p < s0,05 vs KO/WT.
|
Le PtdIns3
P
régule le trafic membranaire et la myopathie myotubulaire est associée à des défauts du trafic membranaire. L’intégrine β1 est une protéine transmembranaire liant le cytosquelette de la cellule à la matrice extracellulaire. Les myofibres
Mtm1
-/y
ont montré une accumulation intracellulaire anormale d’intégrine β1. Ces défauts de localisation peuvent expliquer les défauts observés en histologie avec la présence de petites fibres rondes et l’augmentation de l’espace inter-fibres. La diminution du recyclage de l’intégrine β1 à la membrane cellulaire semble indiquer une perturbation du recyclage cellulaire. Chez la drosophile, les orthologues, c’est-à-dire les équivalents de PI3KC2β et MTM1, contrôlent le recyclage de l’intégrine β1 dépendamment des phosphoinositides [
4
]. Les défauts de localisation de cette protéine étaient absents chez les animaux KO/HO (non montré).
PtdIns3
P
et PI3KC2β régulant l’autophagie [
6
,
7
], nous avons évalué l’activité de la voie mTORC1 par Western blot en mesurant la phosphorylation (et donc l’activation) de la protéine S6RP, un acteur de la voie situé en aval de mTORC1. La protéine S6RP était davantage phosphorylée, donc davantage activée, chez les souris
Mtm1
-/y
que chez les contrôles WT/WT (
Figure 4B
). L’amélioration de la myopathie était corrélée à une normalisation de l’activité de mTORC1 chez les animaux KO/HO. Ces résultats suggèrent que la prévention du phénotype pathologique est obtenue par normalisation de la voie mTORC1 et du trafic des intégrines, médiée par PtdIns3
P
.
|
Cette étude démontre que la suppression de l’activité kinase de PI3KC2β permet de prévenir les déficiences motrices, l’atrophie et la faiblesse musculaires ainsi que les anomalies histologiques et ultra-structurales caractérisant la myopathie myotubulaire. Cet effet est corrélé à la normalisation du niveau de PtdIns3
P
dans le muscle, elle-même corrélée à une normalisation de l’activité de la voie mTOR, une voie impliquée dans de nombreux processus cellulaires. Nous émettons l’hypothèse que l’inhibition de l’activité de la kinase PI3KC2β normalise l’homéostasie du PtdIns3
P
, l’activité de mTORC1 et le trafic de l’intégrine β1 conduisant à l’amélioration des différents défauts cellulaires ainsi que de la structure et de la fonction musculaires.
De plus, une inactivation partielle de la kinase PI3KC2β n’a permis qu’une amélioration partielle du phénotype des souris, mettant en évidence un effet dose-dépendant. Les résultats suggèrent qu’un traitement médicamenteux permettant une inhibition de 50 % de l’activité pourrait déjà apporter une certaine amélioration et qu’une inhibition plus forte de l’activité de la kinase PI3KC2β sera nécessaire pour atteindre un effet thérapeutique optimal. De plus, l’inhibition de l’activité kinase a montré une absence de toxicité dans les tests étudiés chez les animaux contrôles. En conclusion, ces résultats soutiennent le développement d’inhibiteurs spécifiques de l’activité kinase de PI3KC2β comme cibles thérapeutiques de la myopathie myotubulaire. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. Ces travaux ont déjà fait l’objet d’une publication en langue anglaise [
8
].
|
Ce travail a été soutenu par les financements suivants : ANR-10-LABX-0030-INRT, ANR-10-IDEX-0002-02, réseau Marie Skłodowska-Curie n°675392 (VN), ANR-17-RAR3-0006, ERARE17-152.
|
1.
Jungbluth
H
,
Wallgren-Pettersson
C
,
Laporte
J
.
Centronuclear (myotubular) myopathy.
.
Orphanet J Rare Dis
.
2008;
;
3
:
:26.
.
2.
Hammond
GR
,
Burke
JE
.
Novel roles of phosphoinositides in signaling, lipid transport, and disease.
.
Curr Opin Cell Biol
.
2020;
;
63
:
:57.
–
67
.
3.
Dowling
JJ
,
Vreede
AP
,
Low
SE
,
et al.
Loss of myotubularin function results in t-tubule disorganization in zebrafish and human myotubular myopathy.
.
PLoS Genet
.
2009
;
:5.
.
4.
Ribeiro
I
,
Yuan
L
,
Tanentzapf
G
,
et al.
Phosphoinositide regulation of integrin trafficking required for muscle attachment and maintenance.
.
PLoS Genet
.
2011
;
:7.
.
5.
Sabha
N
,
Volpatti
JR
,
Gonorazky
H
,
et al.
PIK3C2B inhibition improves function and prolongs survival in myotubular myopathy animal models.
.
J Clin Invest
.
2016;
;
126
:
:3613.
–
3625
.
6.
Marat
AL
,
Wallroth
A
,
Lo
WT
,
et al.
mTORC1 activity repression by late endosomal phosphatidylinositol 3,4-bisphosphate.
.
Science
.
2017;
;
356
:
:968.
–
972
.
7.
Devereaux
K
,
Dall’Armi
C
,
Alcazar-Roman
A
,
et al.
Regulation of mammalian autophagy by class II and III PI 3-Kinases through PI3P synthesis.
.
PLoS One
.
2013
;
:8.
.
8.
Massana-Muñoz
X
,
Goret
M
,
Nattarayan
V
et al.
Inactivating the lipid kinase activity of PI3KC2β is sufficient to rescue myotubular myopathy in mice.
.
JCI Insight
.
2023;
;
8
:
:e15193.
.
|