© D. Cicciarello et I. Scionti
Pour préserver un métabolisme énergétique correct et équilibré, toutes les cellules eucaryotes stockent des lipides neutres dans des organites spécifiques appelés gouttelettes lipidiques (GL).
Les GL sont des structures intracellulaires hautement dynamiques, au centre du métabolisme des acides gras (AG) dans les cellules, impliquées dans plusieurs fonctions telles que le stockage des lipides et la synthèse des membranes [ 1 ]. Morphologiquement, les GL sont composées d’un noyau central neutre, qui contient principalement du triacylglycérol (TAG) ou des esters de stérol (SE), entouré d’une monocouche de phospholipides elle-même entourée d’une variété de protéines, principalement des périlipines (PLINS) 1-5, qui parsèment la surface des GL. Les GL ne se limitent pas au stockage de l’énergie, elles jouent d’autres rôles pour assurer le bon fonctionnement des cellules en cas de stress. Il est connu que, malgré leur rôle dans les fonctions cellulaires essentielles, une distribution ou un métabolisme incorrect des lipides peut entraîner des concentrations anormales de lipides qui pourraient devenir toxiques en raison de leur solubilité limitée et de leur nature hydrophile/hydrophobe. Ainsi, le stockage des AG libres vise à réguler leur accumulation excessive dans les cellules afin de prévenir le stress du réticulum endoplasmique, la toxicité des lipides, le stress oxydatif et le dysfonctionnement des mitochondries qui pourraient conduire à la mort cellulaire [ 2 ]. De plus, grâce aux progrès récents réalisés dans le domaine de l'imagerie, dans la technologie omique des lipides et de la protéomique, il a été montré que les GL possèdent une plasticité remarquable, régulant leur équilibre biogénèse/catabolisme afin de répondre rapidement aux demandes énergétiques et métaboliques des cellules.
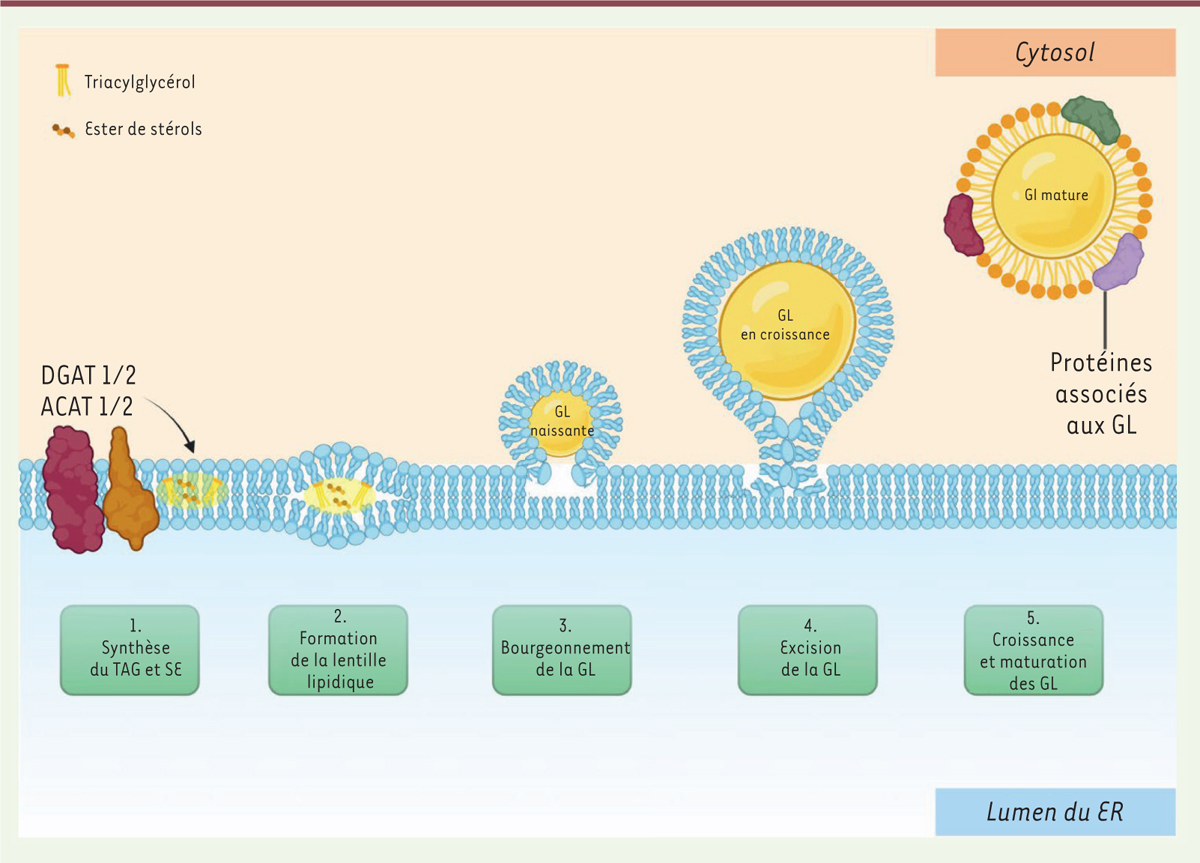
La biogenèse des GL ( Figure 1 ) a lieu dans le réticulum endoplasmique (RE) et comprend trois phases principales :
| Figure 1.
Biogenèse des gouttelettes lipidiques.
La biogenèse des LD commence par la synthèse de lipides neutres (TAG et SE) qui sont libérés entre les feuillets de la bicouche phospholipidique du RE. Les lipides neutres forment une lentille d’huile, qui bourgeonne ensuite vers le cytosol pour former un LD mature recouvert d’une monocouche de phospholipides (d’après [
3
]).
|
En premier lieu, la synthèse des lipides neutres et formation du cristallin : l’estérification des AG en glycérol ou en stérol produit respectivement des TAG et des SE, qui sont dispersés entre les feuillets internes et externes de la bicouche du RE. Les enzymes responsables de cette réaction sont les acyl-CoA:cholestérol O-acyltransférases (ACAT1 et ACAT2) pour produire le SE et les diacylglycérol acyltransférases 1 et 2 (DGAT1 et DGAT2) pour former le TAG. Dès que la concentration en lipides neutres augmente, ils se détachent du RE pour former les premiers intermédiaires GL.
Survient ensuite le bourgeonnement des GL : une fois que la lentille GL s’est développée, elle se détache de la membrane du RE. Ce processus est facilité par le recrutement sur la structure du cristallin de facteurs spécifiques de biogenèse des GL qui permettront la naissance et la croissance successive des GL.
Enfin, ont lieu la croissance et la maturation des GL : après leur formation, les GL se développent et maturent pour remplir leurs fonctions en tant qu’organites fonctionnels. Leur expansion est réalisée de différentes manières, telles que la fusion de gouttelettes à gouttelettes ou le transfert de TAG sur la surface de la GL.
D’autre part, les GL peuvent être catabolisées en AG libres pour l’apport d’énergie et la synthèse membranaire par deux mécanismes différents : la lipolyse ou la lipophagie. La lipolyse des GL permet la libération d’AG libres dans le cytoplasme pour permettre leur mobilisation vers les mitochondries afin de générer de l’ATP. Cette réaction est médiée par l’action concertée de trois lipases principales situées sur la membrane des GL : la triglycéride lipase adipeuse (ATGL) ou desnutrine, la lipase sensible aux hormones (HSL) et la monoacylglycérol lipase (MAGL). La lipolyse de la GL est finement régulée par deux capteurs d’énergie, la protéine kinase dépendante de l’AMP cyclique (PKA) [ 4 ] et la protéine kinase activée par l’AMP (AMPK) [ 5 ]. La PKA et l’AMPK sont respectivement activées lorsque les niveaux d’AMPc/ATP ou le rapport AMP/ATP augmentent dans les cellules. En effet, des niveaux élevés d’AMPc activent la PKA qui, à son tour, phosphoryle les deux enzymes lipolytiques primaires, l'ATGL et l'HSL, une telle modification post-traductionnelle étant essentielle pour initier la voie de la lipolyse. Inversement, des études ont montré qu'à l'état basal, l’AMPK active la lipolyse en phosphorylant l’enzyme limitant la vitesse de la lipolyse, la desnutrine/ATGL [ 6 ]. Ainsi, cette modification favorise le bon déroulement de la lipolyse basale et stimule l’oxydation des acides gras.
La lipophagie des GL est un mécanisme non canonique de lipolyse des GL dans lequel elles sont englouties par les lipo-autophagosomes et transportées vers les lysosomes, où le TAG et d’autres lipides subissent une lipolyse acide par la lipase acide lysosomale (LAL). Des études ont notamment montré que la GL est séquestrée par l’autophagosome par l’intermédiaire des protéines 1A et 1B associées aux microtubules, la chaîne légère 3 (LC3), marqueurs de l’autophagie. En effet, la protéine LC3 interagit avec l’ATGL à travers sa région d’interaction LC3 (LIR) et réduit la localisation de l’ATGL à la surface de la GL. Ce processus permet l’intégration de la GL dans un lipo-autophagosome et sa translocation vers le lysosome pour être finalement détruite [ 1 ].
Depuis la découverte du rôle crucial des GL dans les fonctions métaboliques cellulaires, plusieurs études ont mis en évidence un lien entre le métabolisme des GL et le comportement des cellules souches [ 7 ]. Les cellules souches adultes ont besoin de différents métabolites, tels que les lipides ou les acides aminés, pour effectuer toutes les réactions nécessaires à leur vie. Parmi les différents types de cellules souches, les cellules souches du muscle squelettique adulte (CSM) sont des cellules souches résidant dans les tissus et responsables de la croissance et de la régénération du muscle squelettique. Dans les conditions physiologiques, les CSM sont localisées entre la lame basale et la myofibre à l'état quiescent. En cas de lésion, les CSM s’activent, prolifèrent et s’engagent dans la différenciation myogénique pour former de nouvelles myofibres et réparer les dommages induits. Dans le même temps, un sous-ensemble de CSM échappe au processus de différenciation pour s’auto-renouveler et recharger le réservoir de cellules souches qui seront utiles en cas de lésions futures. Comme tous les autres types de cellules, les CSM ont des besoins énergétiques différents au cours de leur croissance, de leur régénération et en fonction de leur état métabolique. Il a été démontré que les CSM quiescentes présentent une faible activité métabolique, reposant principalement sur l’oxydation des acides gras (FAO). Cependant, une fois que les CSM entrent dans le cycle cellulaire, elles subissent un changement métabolique, de la FAO à la glycolyse, appelé reprogrammation métabolique [ 8 ].
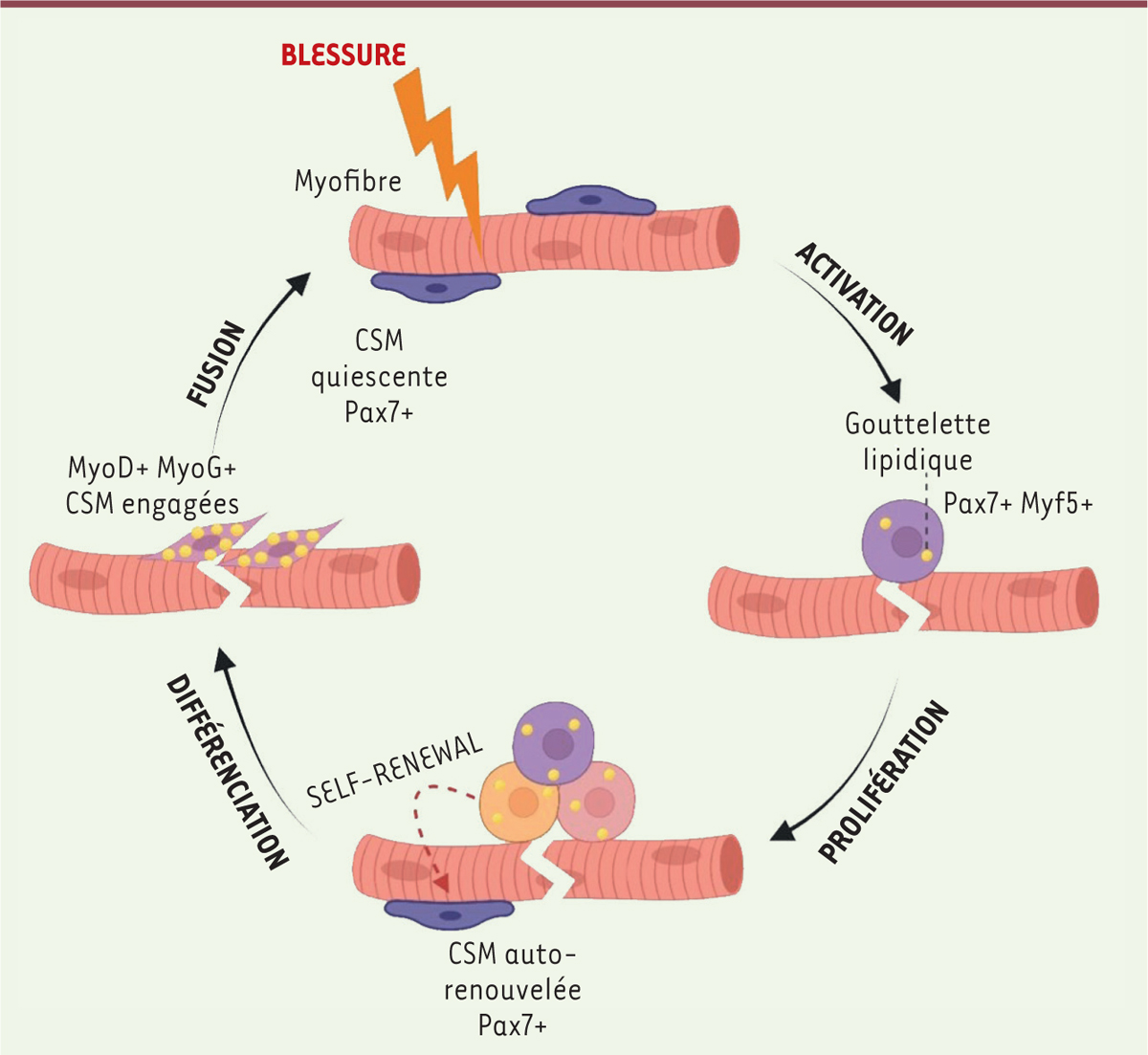
Récemment, une étude a montré pour la première fois que la dynamique et le renouvellement des GL modulent le destin des cellules souches musculaires en régulant l’équilibre engagement/auto-renouvellement. En particulier, cette étude met en évidence une dynamique contrôlée de la biogenèse et du catabolisme des GL au cours de la transition du destin des CSM [ 8 ]. En effet, dans des conditions physiologiques, les CSM quiescentes et auto-renouvelables sont caractérisées par un faible contenu en GL. Lors de l’activation des CSM, la concentration en GL est extrêmement importante pour déterminer le destin des cellules souches musculaires. En fait, dans les cellules souches musculaires nouvellement divisées, les GL sont inégalement distribuées dans les cellules sœurs présentant des destins cellulaires asymétriques, car la cellule GL Low (à faible contenu en GL) s’auto-renouvelle tandis que la cellule GL High (à fort contenu en GL) s’engage dans la différenciation. La teneur en GL atteint son niveau maximal lors de l’engagement des CSM dans la différenciation myogénique, et elles sont ensuite catabolisées pour produire l’énergie permettant aux myocytes de fusionner en myotubes multinucléés ( Figure 2 ).
| Figure 2.
Illustration de la dynamique et du renouvellement des gouttelettes lipidiques au cours de la régénération du muscle squelettique.
Après une lésion induite du muscle, les cellules souches musculaires s’activent et commencent à proliférer. C’est à ce moment précis que les GL sont biosynthétisées et atteignent leur concentration maximale dans les cellules souches musculaires engagées. Plus tard, les LD sont dégradées afin de générer de l’ATP pour permettre aux myocytes mononucléés de fusionner en myotubes multinucléés et de réparer le site lésé.
|
De plus, cette étude a montré que le blocage de la biogenèse des GL favorise le retour des CSM à un état dormant, tandis que l’inhibition de la lipolyse des GL entraîne un engagement et une différenciation prématurés des CSM, accompagnés d’un échec des événements de fusion. En effet, l’inhibition de la lipolyse dans les CSM entraîne une diminution globale de l’activité respiratoire des cellules et une accumulation d’espèces réactives de l’oxygène (ROS). Ainsi, toute perturbation du renouvellement des GL, telle qu’une accumulation anormale, peut perturber l’homéostasie du destin cellulaire [ 9 ]. Ces résultats mettent en évidence pour la première fois un processus finement contrôlé du métabolisme des GL contrôlant le destin des CSM. Cependant, on ne connait toujours pas quel est le régulateur en amont qui coordonne la biogenèse et le catabolisme des GL. Une meilleure compréhension des mécanismes moléculaires associés au renouvellement des GL et à la décision du destin des CSM permettra de comprendre comment l’homéostasie lipidique pourrait contribuer à l’homéostasie des CSM et à la régénération des muscles squelettiques. Par conséquent, le décryptage de la manière dont le renouvellement des lipides régule le devenir des CSM pourrait offrir des perspectives dans la compréhension de la régulation des CSM dans les conditions normales et pathologiques.