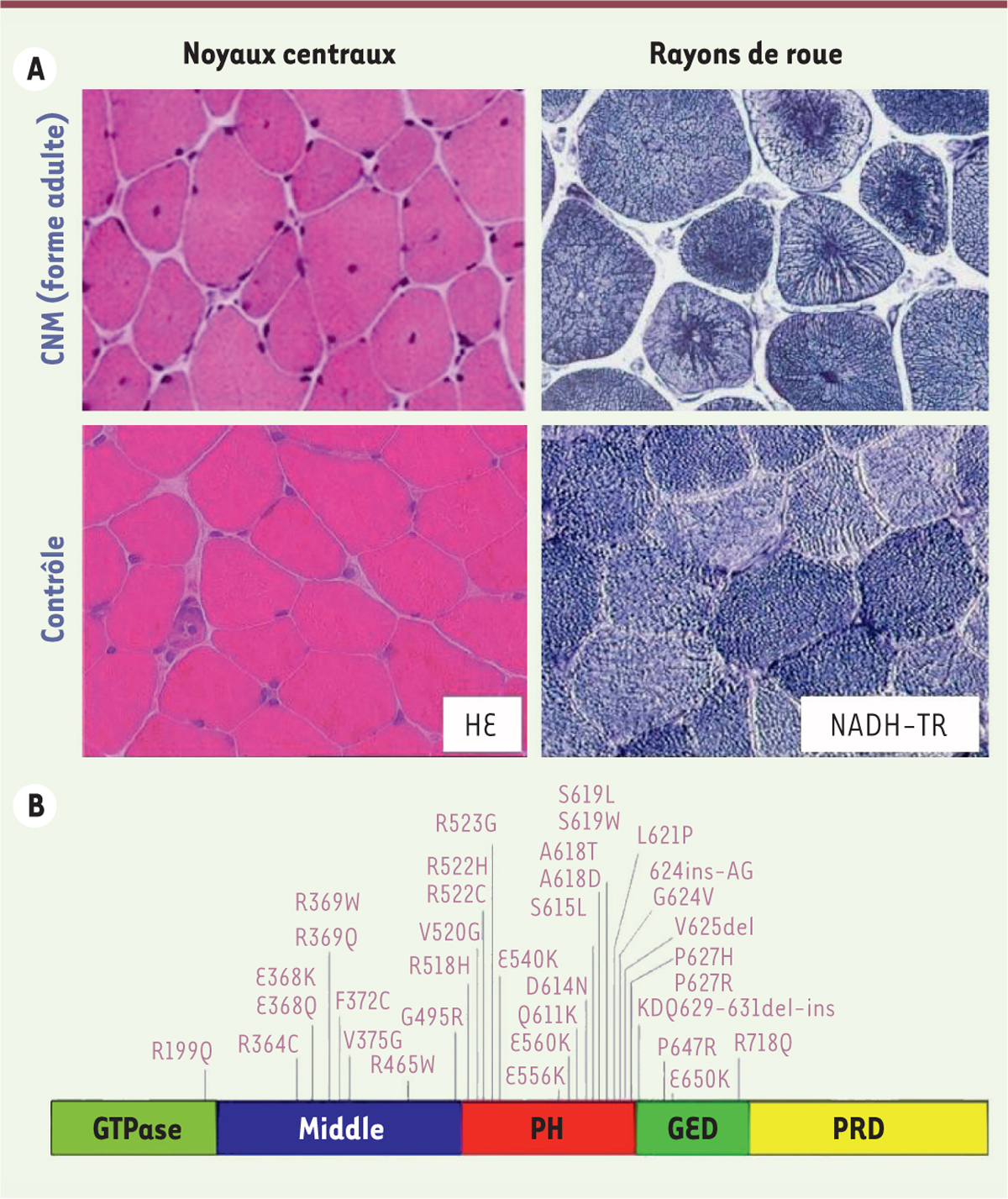
1.
Spiro
AJ
,
Shy
GM
,
Gonatas
NK
.
Myotubular myopathy. Persistence of fetal muscle in an adolescent boy.
.
Arch Neurol
.
1966;
;
14
:
:1.
–
14
.
2.
Laporte
J
,
Hu
LJ
,
Kretz
C
,
et al.
A gene mutated in X-linked myotubular myopathy defines a new putative tyrosine phosphatase family conserved in yeast.
.
Nat Genet
.
1996;
;
13
:
:175.
–
182
.
3.
Laporte
J
,
Bedez
F
,
Bolino
A
,
et al.
Myotubularins, a large disease-associated family of cooperating catalytically active and inactive phosphoinositides phosphatases.
.
Hum Mol Genet
.
2003;
;
12
(
(spécial n° 2)
) :
:R285.
–
92
.
4.
Nicot
AS
,
Toussaint
A
,
Tosch
V
,
et al.
Mutations in amphiphysin 2 (BIN1) disrupt interaction with dynamin 2 and cause autosomal recessive centronuclear myopathy.
.
Nat Genet
.
2007;
;
39
:
:1134.
–
1139
.
5.
Bohm
J
,
Biancalana
V
,
Malfatti
E
,
et al.
Adult-onset autosomal dominant centronuclear myopathy due to BIN1 mutations.
.
Brain
.
2014;
;
137
:
:3160.
–
3170
.
6.
Tosch
V
,
Rohde
HM
,
Tronchere
H
,
et al.
A novel PtdIns3P and PtdIns(3,5)P2 phosphatase with an inactivating variant in centronuclear myopathy.
.
Hum Mol Genet
.
2006;
;
15
:
:3098.
–
3106
.
7.
Bevilacqua
JA
,
Monnier
N
,
Bitoun
M
,
et al.
Recessive RYR1 mutations cause unusual congenital myopathy with prominent nuclear internalisation and large areas of myofibrillar disorganisation.
.
Neuropathol Appl Neurobiol
.
2011;
;
37
:
:271.
–
284
.
8.
Jungbluth
H
,
Zhou
H
,
Sewry
CA
,
et al.
Centronuclear myopathy due to a de novo dominant mutation in the skeletal muscle ryanodine receptor (RYR1) gene.
.
Neuromuscul Disord
.
2007;
;
17
:
:338.
–
345
.
9.
Agrawal
PB
,
Pierson
CR
,
Joshi
M
,
et al.
SPEG interacts with myotubularin, and its deficiency causes centronuclear myopathy with dilated cardiomyopathy.
.
Am J Hum Genet
.
2014;
;
95
:
:218.
–
226
.
10.
Ceyhan-Birsoy
O
,
Agrawal
PB
,
Hidalgo
C
,
et al.
Recessive truncating titin gene, TTN, mutations presenting as centronuclear myopathy.
.
Neurology
.
2013;
;
81
:
:1205.
–
1214
.
11.
Bohm
J
,
Biancalana
V
,
Dechene
ET
,
et al.
Mutation spectrum in the large GTPase dynamin 2, and genotype-phenotype correlation in autosomal dominant centronuclear myopathy.
.
Hum Mutat
.
2012;
;
33
:
:949.
–
959
.
12.
Bitoun
M
,
Maugenre
S
,
Jeannet
PY
,
et al.
Mutations in dynamin 2 cause dominant centronuclear myopathy.
.
Nat Genet
.
2005;
;
37
:
:1207.
–
1209
.
13.
Fischer
D
,
Herasse
M
,
Bitoun
M
,
et al.
Characterization of the muscle involvement in dynamin 2- related centronuclear myopathy.
.
Brain
.
2006;
;
129
:
:1463.
–
1469
.
14.
Hanisch
F
,
Muller
T
,
Dietz
A
,
et al.
Phenotype variability and histopathological findings in centronuclear myopathy due to DNM2 mutations.
.
J Neurol
.
2011;
;
258
:
:1085.
–
1090
.
15.
Bitoun
M
,
Bevilacqua
JA
,
Prudhon
B
,
et al.
Dynamin 2 mutations cause sporadic centronuclear myopathy with neonatal onset.
.
Ann Neurol
.
2007;
;
62
:
:666.
–
670
.
16.
Susman
RD
,
Quijano-Roy
S
,
Yang
N
,
et al.
Expanding the clinical, pathological and MRI phenotype of DNM2-related centronuclear myopathy.
.
Neuromuscul Disord
.
2010;
;
20
:
:229.
–
237
.
17.
Jungbluth
H
,
Cullup
T
,
Lillis
S
,
et al.
Centronuclear myopathy with cataracts due to a novel dynamin 2 (DNM2) mutation.
.
Neuromuscul Disord
.
2010;
;
20
:
:49.
–
52
.
18.
Melberg
A
,
Kretz
C
,
Kalimo
H
,
et al.
Adult course in dynamin 2 dominant centronuclear myopathy with neonatal onset.
.
Neuromuscul Disord
.
2010;
;
20
:
:53.
–
56
.
19.
Bitoun
M
,
Bevilacqua
JA
,
Eymard
B
,
et al.
A new centronuclear myopathy phenotype due to a novel dynamin 2 mutation.
.
Neurology
.
2009;
;
72
:
:93.
–
95
.
20.
Gómez-Oca
R
,
Cowling
BS
,
Laporte
J
.
Common pathogenic mechanisms in centronuclear and myotubular myopathies and latest treatment advances.
.
IJMS
.
2021;
;
22
:
:11377.
.
21.
Durieux
AC
,
Prudhon
B
,
Guicheney
P
,
et al.
Dynamin 2 and human diseases.
.
J Mol Med
.
2010;
;
88
:
:339.
–
350
.
22.
Zuchner
S
,
Noureddine
M
,
Kennerson
M
,
et al.
Mutations in the pleckstrin homology domain of dynamin 2 cause dominant intermediate Charcot-Marie-Tooth disease.
.
Nat Genet
.
2005;
;
37
:
:289.
–
294
.
23.
Sambuughin
N
,
Goldfarb
LG
,
Sivtseva
TM
,
et al.
Adult-onset autosomal dominant spastic paraplegia linked to a GTPase-effector domain mutation of dynamin 2.
.
BMC Neurol
.
2015;
;
15
:
:223.
.
24.
Koutsopoulos
OS
,
Kretz
C
,
Weller
CM
,
et al.
Dynamin 2 homozygous mutation in humans with a lethal congenital syndrome.
.
Eur J Hum Genet
.
2013;
;
21
:
:637.
–
642
.
25.
Echaniz-Laguna
A
,
Nicot
AS
,
Carre
S
,
et al.
Subtle central and peripheral nervous system abnormalities in a family with centronuclear myopathy and a novel dynamin 2 gene mutation.
.
Neuromuscul Disord
.
2007;
;
17
:
:955.
–
959
.
26.
Kierdaszuk
B
,
Berdynski
M
,
Karolczak
J
,
et al.
A novel mutation in the DNM2 gene impairs dynamin 2 localization in skeletal muscle of a patient with late onset centronuclear myopathy.
.
Neuromuscul Disord
.
2013;
;
23
:
:219.
–
228
.
27.
Cowling
BS
,
Chevremont
T
,
Prokic
I
,
et al.
Reducing dynamin 2 expression rescues X-linked centronuclear myopathy.
.
J Clin Invest
.
2014;
;
124
:
:1350.
–
1363
.
28.
Cowling
BS
,
Toussaint
A
,
Amoasii
L
,
et al.
Increased expression of wild-type or a centronuclear myopathy mutant of dynamin 2 in skeletal muscle of adult mice leads to structural defects and muscle weakness.
.
Am J Pathol
.
2011;
;
178
:
:2224.
–
2235
.
29.
Wang
L
,
Barylko
B
,
Byers
C
,
et al.
Dynamin 2 mutants linked to centronuclear myopathies form abnormally stable polymers.
.
J Biol Chem
.
2010;
;
285
:
:22753.
–
22757
.
30.
Kenniston
JA
,
Lemmon
MA
.
Dynamin GTPase regulation is altered by PH domain mutations found in centronuclear myopathy patients.
.
EMBO J
.
2010;
;
29
:
:3054.
–
3067
.
31.
James
NG
,
Digman
MA
,
Ross
JA
,
et al.
A mutation associated with centronuclear myopathy enhances the size and stability of dynamin 2 complexes in cells.
.
Biochim Biophys Acta
.
2014;
;
1840
:
:315.
–
321
.
32.
Faelber
K
,
Gao
S
,
Held
M
,
et al.
Oligomerization of dynamin superfamily proteins in health and disease.
.
Prog Mol Biol Transl Sci
.
2013;
;
117
:
:411.
–
443
.
33.
Durieux
AC
,
Vignaud
A
,
Prudhon
B
,
et al.
A centronuclear myopathy-dynamin 2 mutation impairs skeletal muscle structure and function in mice.
.
Hum Mol Genet
.
2010;
;
19
:
:4820.
–
4836
.
34.
Fraysse
B
,
Desaphy
JF
,
Rolland
JF
,
et al.
Fiber type-related changes in rat skeletal muscle calcium homeostasis during aging and restoration by growth hormone.
.
Neurobiol Dis
.
2006;
;
21
:
:372.
–
380
.
35.
Gibbs
EM
,
Clarke
NF
,
Rose
K
,
et al.
Neuromuscular junction abnormalities in DNM2-related centronuclear myopathy.
.
J Mol Med (Berl)
.
2013;
;
91
:
:727.
–
737
.
36.
Bragato
C
,
Gaudenzi
G
,
Blasevich
F
,
et al.
Zebrafish as a model to investigate Dynamin 2-related diseases.
.
Sci Rep
.
2016;
;
6
:
:20466.
.
37.
Kutchukian
C
,
Szentesi
P
,
Allard
B
,
et al.
Impaired excitation-contraction coupling in muscle fibres from the dynamin2(R465W) mouse model of centronuclear myopathy.
.
J Physiol
.
2017;
;
595
:
:7369.
–
7382
.
38.
Fongy
A
,
Falcone
S
,
Laine
J
,
et al.
Nuclear defects in skeletal muscle from a Dynamin 2-linked centronuclear myopathy mouse model.
.
Sci Rep
.
2019;
;
9
:
:1580.
.
39.
F Almeida
C
,
Bitoun
M
,
Vainzof
M
.
Satellite cells deficiency and defective regeneration in dynamin 2-related centronuclear myopathy.
.
FASEB J
.
2021;
;
35
:
:e21346.
.
40.
Durieux
AC
,
Vassilopoulos
S
,
Laine
J
,
et al.
A centronuclear myopathy - dynamin 2 mutation impairs autophagy in mice.
.
Traffic
.
2012;
;
13
:
:869.
–
879
.
41.
Puri
C
,
Manni
MM
,
Vicinanza
M
,
et al.
A DNM2 Centronuclear myopathy mutation reveals a link between recycling endosome scission and autophagy.
.
Dev Cell
.
2020;
;
53
:
:154.
–
68.e6
.
42.
Gonzalez-Jamett
AM
,
Baez-Matus
X
,
Olivares
MJ
,
et al.
Dynamin-2 mutations linked to Centronuclear Myopathy impair actin-dependent trafficking in muscle cells.
.
Sci Rep
.
2017;
;
7
:
:4580.
.
43.
Franck
A
,
Laine
J
,
Moulay
G
,
et al.
Clathrin plaques and associated actin anchor intermediate filaments in skeletal muscle.
.
Mol Biol Cell
.
2019;
;
30
:
:579.
–
590
.
44.
Romero
NB
,
Bitoun
M
.
Centronuclear myopathies.
.
Semin Pediatr Neurol
.
2011;
;
18
:
:250.
–
256
.
45.
Muñoz
XM
,
Kretz
C
,
Silva-Rojas
R
,
et al.
Physiological impact and disease reversion for the severe form of centronuclear myopathy linked to dynamin.
.
JCI Insight
.
2020;
;
5
:
:e137899.
.
46.
Zanoteli
E
,
Vergani
N
,
Campos
Y
,
et al.
Mitochondrial alterations in dynamin 2-related centronuclear myopathy.
.
Arq Neuropsiquiatr
.
2009;
;
67
:
:102.
–
104
.
47.
Bitoun
M
,
Durieux
AC
,
Prudhon
B
,
et al.
Dynamin 2 mutations associated with human diseases impair clathrin-mediated receptor endocytosis.
.
Hum Mutat
.
2009;
;
30
:
:1419.
–
1427
.
48.
Shevchuk
AI
,
Novak
P
,
Taylor
M
,
et al.
An alternative mechanism of clathrin-coated pit closure revealed by ion conductance microscopy.
.
J Cell Biol
.
2012;
;
197
:
:499.
–
508
.
49.
Sidiropoulos
PN
,
Miehe
M
,
Bock
T
,
et al.
Dynamin 2 mutations in Charcot-Marie-Tooth neuropathy highlight the importance of clathrin-mediated endocytosis in myelination.
.
Brain
.
2012;
;
135
:
:1395.
–
1411
.
50.
Liu
YW
,
Lukiyanchuk
V
,
Schmid
SL
.
Common membrane trafficking defects of disease-associated dynamin 2 mutations.
.
Traffic
.
2011;
;
12
:
:1620.
–
1633
.
51.
Trochet
D
,
Prudhon
B
,
Jollet
A
,
et al.
Reprogramming the Dynamin 2 mRNA by Spliceosome-mediated RNA Trans-splicing.
.
Mol Ther Nucleic Acids
.
2016;
;
5
:
:e362.
.
52.
Trochet
D
,
Prudhon
B
,
Beuvin
M
,
et al.
Allele-specific silencing therapy for Dynamin 2-related dominant centronuclear myopathy.
.
EMBO Mol Med
.
2018;
;
10
:
:239.
–
253
.
53.
Trochet
D
,
Prudhon
B
,
Mekzine
L
,
et al.
Benefits of therapy by dynamin-2-mutant-specific silencing are maintained with time in a mouse model of dominant centronuclear myopathy.
.
Mol Ther Nucleic Acids
.
2022;
;
27
:
:1179.
–
90
.
54.
Rabai
A
,
Reisser
L
,
Reina-San-Martin
B
,
et al.
Allele-Specific CRISPR/Cas9 Correction of a Heterozygous DNM2 Mutation rescues centronuclear myopathy cell phenotypes.
.
Mol Ther Nucleic Acids
.
2019;
;
16
:
:246.
–
256
.
55.
Buono
S
,
Ross
JA
,
Tasfaout
H
,
et al.
Reducing dynamin 2 (DNM2) rescues DNM2-related dominant centronuclear myopathy.
.
Proc Natl Acad Sci USA
.
2018;
;
115
:
:11066.
–
11071
.
56.
Lionello
VM
,
Kretz
C
,
Edelweiss
E
,
et al.
BIN1 modulation in vivo rescues dynamin-related myopathy.
.
Proc Natl Acad Sci USA
.
2022;
;
119
:
:e2109576119.
.
57.
Cowling
BS
,
Prokic
I
,
Tasfaout
H
,
et al.
Amphiphysin (BIN1) negatively regulates dynamin 2 for normal muscle maturation.
.
J Clin Invest
.
2017;
;
127
:
:4477.
–
4487
.
58.
Tasfaout
H
,
Buono
S
,
Guo
S
,
et al.
Antisense oligonucleotide-mediated Dnm2 knockdown prevents and reverts myotubular myopathy in mice.
.
Nat Commun
.
2017;
;
8
:
:15661.
.
59.
Tasfaout
H
,
Lionello
V
,
Kretz
CM
,
et al.
Single intramuscular injection of AAV-shRNA reduces DNM2 and prevents myotubular myopathy in mice.
.
Mol Ther
.
2018;
;
26
:
:1082.
–
1092
.
60.
Silva-Rojas
R
,
Nattarayan
V
,
Jaque-Fernandez
F
,
et al.
Mice with muscle-specific deletion of Bin1 recapitulate centronuclear myopathy and acute downregulation of dynamin 2 improves their phenotypes.
.
Mol Ther
.
2022;
;
30
:
:868.
–
80
.
61.
Li
Q
,
Lin
J
,
Widrick
JJ
,
et al.
Dynamin-2 reduction rescues the skeletal myopathy of SPEG-deficient mouse model.
.
JCI Insight
.
2022;
;
7
:
:e157336.
.
62.
Childers
MK
,
Joubert
R
,
Poulard
K
,
et al.
Gene therapy prolongs survival and restores function in murine and canine models of myotubular myopathy.
.
Sci Transl Med
.
2014;
;
6
:
:220ra10.
.
63.
Dudhal
S
,
Mekzine
L
,
Prudhon
B
,
et al.
Development of versatile allele-specific siRNAs able to silence all the dominant dynamin 2 mutations.
.
Mol Ther Nucleic Acids
.
2022;
;
29
:
:733.
–
48
.
64.
Cowling
BS
,
Prokic
I
,
Tasfaout
H
,
et al.
Amphiphysin (BIN1) negatively regulates dynamin 2 for normal muscle maturation.
.
J Clin Invest
.
2017;
;
127
:
:4477.
–
4487
.