| |
| Med Sci (Paris). 39(12): 945–952. doi: 10.1051/medsci/2023179.Des chauves-souris et des virus Entre contrôle de l’infection et tolérance immunitaire Juliette Perrot1* and Laurent Dacheux1**# 1Institut Pasteur, université Paris Cité, unité Lyssavirus, épidémiologie et neuropathologie
,
28 rue du docteur Roux
,
75724Paris Cedex 15 |
Vignette (© Etsy). Seuls mammifères capables de vol actif, les chauves-souris, ou chiroptères, représentent un ordre très divers au sein du règne animal, peuplant la quasi-totalité du globe. Elles ont des régimes alimentaires variés, consommant fruits, insectes, nectar de fleur, voire du sang. Elles jouent un rôle crucial dans les écosystèmes, en tant que pollinisatrices, agents de fertilisation et de dispersion de graines, et comme contrôleuses de populations d’insectes. Les chauves-souris sont plus particulièrement étudiées en raison de certains caractères qui leur sont uniques : l’écholocalisation et la magnétoréception, ou leur longévité très importante pour des mammifères de leur taille. L’une de leurs caractéristiques la plus intéressante reste néanmoins leur capacité à héberger de nombreux virus pouvant franchir la barrière d’espèce et ainsi être à l’origine d’émergences zoonotiques majeures. |
Les chauves-souris, un réservoir viral Les virus de chauves-souris
Depuis la découverte du virus de la rage chez ces animaux au début du
xx
e
siècle, les chauves-souris ont été associées à de nombreuses épidémies et pandémies, comme celles causées par les coronavirus SARS-CoV (
severe acute respiratory syndrome-coronavirus)
[
1
] et MERS-CoV (
Middle East respiratory syndrome-related coronavirus)
[
2
], et, plus récemment, à la pandémie de COVID-19 (
coronavirus disease 2019)
due au SARS-CoV-2 [
3
]. Au fil des années, diverses études ont été conduites afin de découvrir de nouveaux virus portés par les chiroptères [
4
]. Avec l’avènement des techniques de séquençage dites de nouvelle génération, des clades entiers de virus et de séquences virales ont été identifiés chez différentes espèces [
5
], si bien qu’elles sont souvent considérées comme l’ordre de mammifères hébergeant le plus de virus zoonotiques [
6
]. Bien que cette revendication puisse actuellement être questionnée, notamment en raison des techniques utilisées pour découvrir ces virus [
7
], les chiroptères restent un réservoir viral important et un modèle pertinent pour l’étude des interactions hôtes/pathogènes et des mécanismes d’émergence virale associés.
Parmi plus de 4 000 virus découverts chez les chauves-souris, certains appartiennent à des familles importantes pour la santé humaine et animale, comme les filovirus, avec le virus Marburg [
8
], les hénipavirus, avec les virus Hendra [
9
] et Nipah [
10
], les coronavirus [
11
], ou encore les lyssavirus [
12
] (
Tableau I
). Les chauves-souris sont d’ailleurs considérées comme leur réservoir naturel, c’est-à-dire une population dans laquelle un virus est maintenu et est occasionnellement transmis à une autre espèce [
13
].
Tableau I.
| Famille virale |
Principaux virus d’intérêt |
Principales familles de chauves-souris concernées |
|
Coronaviridae
|
Alphacoronavirus Betacoronavirus |
Hipposideridae Miniopteridae Rhinolophidae Vespertilionidae
|
|
|
Filoviridae
|
Bombali virus Ebola virus* Lloviu virus Marburg virus |
Pteropodidae
|
|
|
Paramyxoviridae
|
Hendra virus Nipah virus Menangle virus |
Pteropodidae
|
|
|
Rhabdoviridae
|
Lyssavirus |
Vespertilionidae Emballonuridae Molossidae Nycteridae Phyllostomidae Pteropodidae
|
Description des principaux virus d’importance zoonotique retrouvés chez les chauves-souris
(d’après [
4
,
11
,
12
]). * Le virus Ebola n’a pas encore été isolé à partir de chauves-souris à ce jour.
|
Cependant, la capture et la réalisation de tests sur ces animaux étant peu aisées, il est difficile de déterminer avec certitude leur statut de réservoir pour un virus donné. La présence d’ARN viraux ou d’anticorps spécifiques dans le sang indiquent néanmoins que certains individus ont pu être infectés ou en contact avec le virus considéré. En recoupant ces informations avec des données épidémiologiques et écologiques, comme les données de prévalence et de distribution géographique, il est possible d’en déduire le rôle des chauves-souris en tant que réservoir naturel, vecteur ou seulement espèce sensible. Des mécanismes complexes d’émergence
L’étude du virome des chauves-souris est une façon de déterminer la diversité virale présente chez ces animaux, et d’identifier les virus qui pourraient plus spécifiquement leur être associés en tant que réservoirs. Des lignées virales, considérées comme ancestrales, et à partir desquelles des virus adaptés à l’homme sont apparus, circulent chez les chauves-souris. Cependant, les étapes conduisant à l’émergence de ces virus restent souvent inconnues. C’est notamment le cas pour le SARS-CoV-2, pour lequel l’hypothèse d’une émergence à partir des chauves-souris a été avancée dès le début de la pandémie de COVID-19 [
3
]. D’une façon générale, les coronavirus représentent environ 30 % des séquences virales identifiées chez les chauves-souris [
11
], et leur transmission vers l’espèce humaine,
via
des hôtes intermédiaires (comme par exemple la civette pour le SARS-CoV ou les camélidés pour le MERS-CoV), a été établie. De nombreux coronavirus apparentés au SARS-CoV (que l’on nomme coronavirus SARS-
like
) ont été identifiés chez les chiroptères depuis la première épidémie de SARS en 2003. Le génome de l’un de ces virus, le RaTG13, isolé dans des chauves-souris
Rhinolophus affinis
en République Populaire de Chine, présente 96 % d’identité nucléotidique avec le SARS-CoV-2 [
3
]. Cependant, cette divergence génétique entre les deux virus, même faible (4 %), laisse suggérer plusieurs années d’évolution les séparant. Aussi, le virus RaTG13 ne peut se lier aux cellules humaines, son domaine de liaison au récepteur (ou RBD pour
receptor-binding domain
) ne lui permettant pas de reconnaître les cellules humaines, contrairement à celui qu’exprime le SARS-CoV-2 [
3
]. De même, le SARS-CoV-2 n’a jamais été détecté chez les chauves-souris, et
in vitro
, il n’infecte pas des cellules primaires de chauves-souris des genres
Rhinolophus
et
Myotis
[
14
]. Ainsi, malgré la présence d’un virus très proche du SARS-CoV-2 chez des chauves-souris, des informations manquent encore pour déterminer si ces animaux en sont réellement le réservoir, et définir les circonstances de son émergence [
15
,
16
] (
→
).
(→) Voir la Synthèse de E. Sallard
et al
.,
m/s
n° 8-9, août-septembre 2020, page 783, et le Repères de R. Frutos
et al
.,
m/s
n° 6-7, juin-juillet 2022, page 600
L’étau se resserre néanmoins autour de ces animaux, avec la découverte récente de coronavirus SARS-
like
qui circulent chez des chauves-souris du genre
Rhinolophus
au Laos, et qui sont capables,
in vitro
, d’infecter des cellules humaines en utilisant le récepteur ACE2 (l’enzyme de conversion de l’angiotensine 2), nécessaire à l’entrée du virus SARS-CoV‑2 [
17
].
Un réservoir viral asymptomatique
Malgré les questions qui subsistent sur leur statut de réservoir viral, les chauves-souris restent très étudiées car elles sont généralement infectées de manière asymptomatique par des virus pouvant être à l’origine de maladies très graves chez d’autres mammifères. Ainsi, différentes espèces de chauves-souris ne présentent aucun symptôme lorsqu’elles sont exposées aux virus Nipah, Hendra, Marburg [
18
] et Ebola [
19
] (
→
).
(→) Voir la Dernière heure de E. Leroy
et al
.,
m/s
n° 1, janvier 2006, page 78
Elles peuvent également survivre aux infections par des lyssavirus [
20
]. En revanche, d’autres agents pathogènes peuvent causer des maladies chez les chauves-souris : les virus Tacaribe et Lloviu, certaines bactéries et le champignon
Geomyces destructans
, responsable du syndrome du nez blanc, qui menace les chauves-souris d’Amérique du Nord [
21
].
En 2015, Brooks et Dobson ont émis l’hypothèse que les chauves-souris seraient particulièrement adaptées aux infections par des agents pathogènes intracellulaires, tels les virus, contrairement aux agents extracellulaires, comme les bactéries ou les champignons vis-à-vis desquels elles sont sensibles [
21
]. Ces adaptations seraient liées à leur système immunitaire inné, qui a été particulièrement étudié au cours des dernières années. Il semblerait en effet que les chauves-souris aient la capacité de mettre en place une réponse antivirale plus rapide et plus robuste que les autres mammifères, tout en la contrôlant afin de limiter les conséquences de l’inflammation à la suite d’une infection. Ces adaptations sont probablement le fruit d’une longue coévolution entre chauves-souris et agents pathogènes, et de la physiologie unique de ces mammifères [
18
].
|
Une réaction immunitaire équilibrée Augmentation des défenses antivirales Une réponse interféron plus robuste L’une des hypothèses permettant d’expliquer le caractère asymptomatique des infections chez les chauves-souris concerne leurs défenses antivirales : elles sont supposées être plus rapides et plus efficaces que chez les autres mammifères. Cette caractéristique se manifeste notamment par des adaptations de la cascade de signalisation impliquant les interférons (IFN).
Lors de son entrée dans la cellule, un virus est reconnu par différents senseurs extra- et intracellulaires, les PRR (
pattern recognition receptors
). Ces senseurs, ou récepteurs, activent différentes voies de signalisation qui convergent vers des facteurs de transcription, entraînant la production d’IFN et de cytokines pro-inflammatoires. La liaison des IFN ainsi sécrétés aux cellules voisines est à l’origine d’un état antiviral en induisant l’expression d’un groupe de gènes cibles, les ISG (
interferon-stimulated genes
). La voie de signalisation des IFN a été décrite chez les chauves-souris et il semble que son fonctionnement soit similaire à celui des autres mammifères, mais certaines adaptations notables ont été découvertes (
Figure 1
).
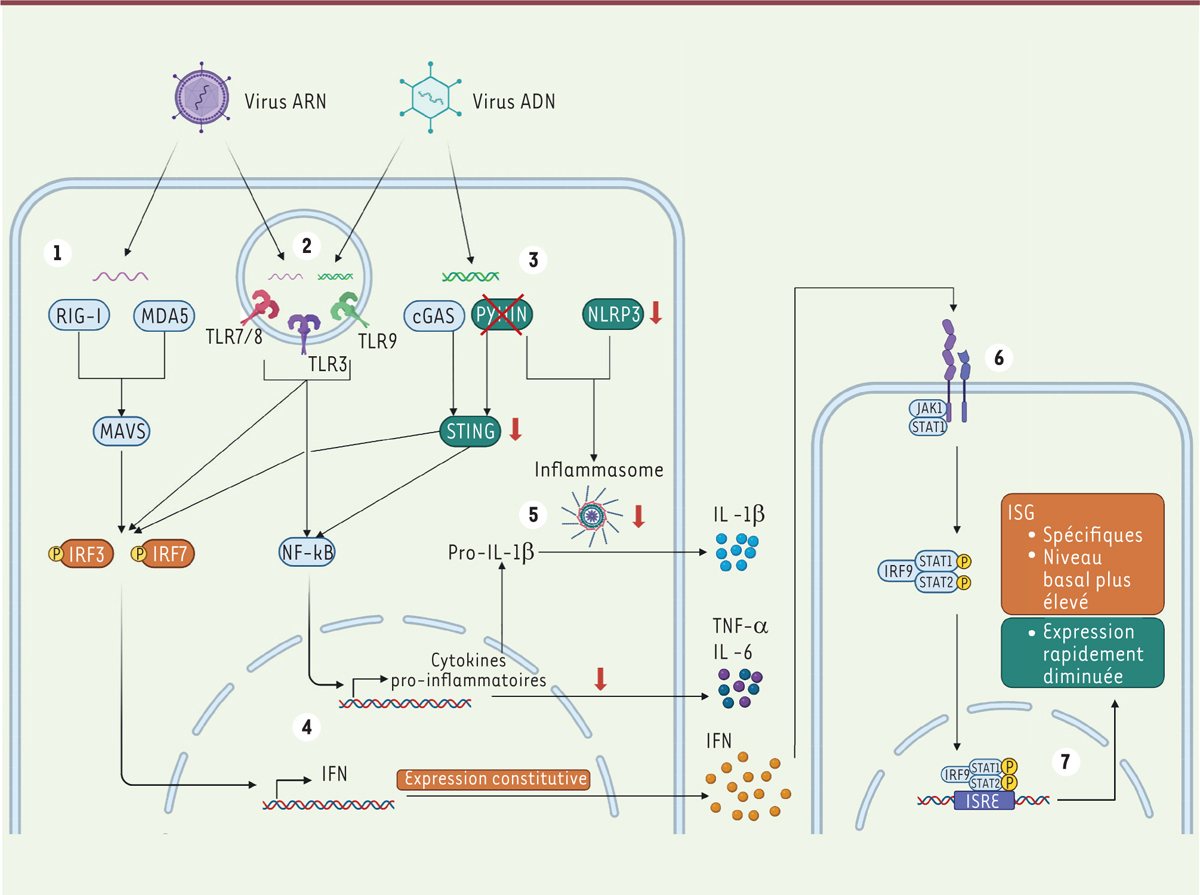
 | Figure 1.
Réponse immunitaire innée des chauves-souris.
Lors de l’infection d’une cellule par un virus, les acides nucléiques viraux sont reconnus par des senseurs intracellulaires, les PRR. Les ARN viraux présents dans le cytoplasme sont reconnus par RIG-I et MDA5 (1), qui activent les facteurs de transcription IRF3 et IRF7
via
la protéine MAVS. Les ARN viraux présents dans les endosomes sont détectés par les TLR 3, 7 et 8 (2), qui activent également les facteurs de transcription IRF3 et 7, ainsi que NF-kB. Dans les endosomes, les ADN viraux sont reconnus par TLR 9 (2) et par différents senseurs dans le cytoplasme, notamment cGAS et les protéines de la famille PYHIN (3), qui activent la protéine STING. La détection des ADN viraux active également les facteurs de transcription IRF et NF-kB. Ils sont transloqués dans le noyau et permettent l’expression et la sécrétion d’interféron de type I et de cytokines pro-inflammatoires (4). Certains senseurs, comme NLRP3, activent le complexe de l’inflammasome en réponse à différents signaux de danger, ce qui permet le clivage et la sécrétion d’IL-1b (5). L’IFN de type I sécrété agit de manière autocrine ou paracrine en se fixant à des récepteurs membranaires (6), entraînant l’activation de la voie de signalisation JAK-STAT qui aboutit à l’expression des ISG (7). Les adaptations permettant une augmentation de la réponse antivirale chez les chauves-souris sont indiquées en orange. Chez
P. alecto
, IRF7 est exprimé dans tous les organes, et un résidu présent dans la protéine IRF3 augmente son activité antivirale. Une expression constitutive de l’IFN-a a été observée chez certaines espèces. Le niveau basal d’expression des ISG est plus élevé chez les chauves-souris que chez les autres mammifères, et certains ISG leur sont spécifiques. Les adaptations permettant une réduction de la réponse inflammatoire sont indiquées en vert et par des flèches rouges. Les gènes de la famille PYHIN sont absents des génomes de chauves-souris, et l’activité du senseur NLRP3 est réduite, ce qui entraîne une diminution de l’activité de l’inflammasome. La protéine STING présente également une activité réduite, et les cytokines pro-inflammatoires sont moins exprimées que chez les autres mammifères. Malgré l’expression des ISG à la suite d’une infection, celle-là est rapidement diminuée afin d’éviter les dégâts associés à une inflammation prolongée. RIG-I :
retinoic acid-inducible gene I
; MDA5 :
melanoma differentiation-associated gene 5
; MAVS :
mitochondrial antiviral-signaling protein
; IRF3 :
interferon regulatory factor 3
; IRF7:
interferon regulatory factor 7
; IRF9 :
interferon regulatory factor 9
; IFN : interféron ; TLR :
Toll-like receptor
; NF-kB :
nuclear factor-kappa B
; IL-1b : interleukine 1 bêta ; cGAS : GMP-AMP cyclique synthase ; PYHIN :
pyrin and hematopoietic interferon-inducible nuclear domain-containing protein
; STING :
stimulator of interferon genes
; NLRP3 :
nucleotide-binding domain leucin-rich repeat and pyrin-containing receptor 3
; JAK : Janus kinase ; STAT1/2 :
signal transducers and activators of transcription
; TNF-a :
tumor necrosis factor alpha
; ISRE :
interferon-sensitive response element
; P : groupement phosphate ; ISG :
interferon-stimulated genes
(figure créée sur BioRender.com).
|
Des études génomiques réalisées sur différentes espèces ont en effet montré des modifications du locus des IFN de type I
1
, avec des différences inter-espèces importantes. Bien que le locus de l’IFN-a soit réduit chez
Pteropus alecto
, l’expression de la protéine est constitutive [
22
]. Observés également chez
Cynopterus brachyotis
[
22
], ces résultats n’ont pas pu être reproduits chez
Rousettus aegypticus
[
23
], ni chez
Myotis daubentonii
[
24
], laissant supposer l’existence d’une variabilité inter-espèces.
Cette adaptation pourrait être associée à des différences d’expression des facteurs de transcription IRF (
interferon regulatory factor
), qui régulent la production des IFN de type I. Par exemple, contrairement à ce qui est observé chez les autres mammifères, chez
P. alecto
, IRF7 est exprimé dans tous les organes [
25
], ce qui pourrait permettre une réponse interféron plus rapide et plus importante en cas d’infection. Chez sept espèces de chauves-souris, un résidu sérine, associé à une augmentation des réponses antivirales, est positivement sélectionné dans les séquences d’IRF3 [
26
].
Ces animaux présentent également un répertoire plus diversifié des IFN de type I que les autres mammifères. Le locus des IFN-w contient 22 gènes chez
R. aegypticus
, alors qu’il n’en contient qu’un seul chez l’homme [
23
]. L’IFN-w présente une activité antivirale contre le virus de la stomatite vésiculaire chez
R. aegypticus
[
23
] et contre les lyssavirus dans des cellules d’une autre espèce,
Eptesicus serotinus
[
27
]. L’augmentation du nombre de gènes codant l’IFN-w conduirait ainsi à une réponse plus spécifique à l’infection par certains virus, par exemple en induisant l’expression d’un groupe d’ISG particuliers.
Chez
P. alecto
, la majorité des ISG est conservée par rapport à ceux exprimés par les autres mammifères, mais leur niveau basal d’activation est plus élevé [
28
,
29
]. Cette caractéristique est aussi observée dans les cellules de
Myotis lucifugus
[
28
]. Pour l’espèce
P. alecto
, ce phénomène serait lié à la production constitutive d’IFN-a, induisant alors un état antiviral permanent dans les cellules, et donc une réponse plus rapide en cas d’infection.
En plus des ISG conservés entre espèces, les chauves-souris présentent également des ISG qui leur sont spécifiques et dont l’expression n’est pas activée chez d’autres mammifères, comme, par exemple, le gène codant l’endoribonucléase L (RNAse L), une endonucléase clivant les ARN simple brin [
28
,
29
]. Cette différence pourrait être due à une plus longue coévolution avec certains virus permettant aux espèces de chauves-souris qui les hébergent de développer des réponses plus spécifiques.
Un exemple de facteur de restriction soumis à une sélection positive chez les chauves-souris : PKR
L’étude des génomes et des transcriptomes de différentes espèces de chauves-souris a révélé que la majorité des gènes soumis à une sélection positive sont en lien avec le système immunitaire. Parmi ces gènes, on retrouve différents effecteurs antiviraux, comme PKR (
protein kinase R
), un senseur et facteur de restriction à large spectre, actif sur des familles de virus à génome ADN et ARN. PKR reconnaît l’ARN sous forme double brin et entraîne l’inhibition de la traduction coiffe-dépendante et l’arrêt du cycle viral.
L’étude des séquences de PKR de 33 espèces de chauves-souris représentatives de deux sous-ordres a révélé des signatures de sélection positive
,
et la présence de mutations/domaines d’hypermutation qui confèrent aux orthologues de PKR différentes capacités d’échappement aux protéines antagonistes des poxvirus [
30
]. Des duplications de gènes ont également permis l’expansion du locus de PKR chez les chauves-souris du genre
Myotis
. Alors que le locus PKR des autres mammifères est très conservé et ne contient qu’une seule copie du gène, différentes espèces de
Myotis
en expriment au moins deux. Les paralogues sont fonctionnels, mais de multiples mutations et insertions/délétions leur confèrent une susceptibilité différente aux antagonistes de différentes familles virales. Ces observations suggèrent que les évènements de duplication de PKR seraient le résultat des interactions passées avec ces familles, qui auraient façonné la façon dont les chauves-souris luttent contre les virus actuels, en restant asymptomatiques.
Une tolérance aux infections virales
Une nouvelle hypothèse a été récemment émise afin d’expliquer ce statut de réservoir asymptomatique des chauves-souris : différentes adaptations leur permettraient de limiter l’inflammation causée par les infections virales, et ainsi d’éviter de développer une maladie [
18
,
31
].
Malgré une augmentation rapide induite par une infection, l’expression des ISG diminue rapidement dans des cellules de
P. alecto
, contrairement à ce qui est observé dans des cellules humaines, ce qui limite l’inflammation excessive [
29
]. Dans le promoteur du gène codant le TNF-a (
tumor necrosis factor alpha
), un motif de liaison du facteur de transcription c-Rel est présent chez la chauve-souris. La liaison de c-Rel au promoteur inhibe la production de TNF-a, limitant là encore l’inflammation induite par l’infection [
32
].
La diminution de la production de cytokines pro-inflammatoires en réponse aux infections virales peut également être attribuée à une plus faible activité du senseur NLRP3 (
nucleotide-binding domain leucin-rich repeat and pyrin-containing receptor 3)
, qui active l’inflammasome (
Figure 2
). L’inflammasome est un complexe protéique composé d’un PRR, d’une protéine adaptatrice ASC (
apoptosis-associated speck-like protein containing a caspase recruitment domain)
et d’une protéine effectrice : la caspase-1. L’activation de certains PRR en réponse à un signal de danger entraîne l’agrégation de protéines adaptatrices ASC, qui forment des complexes dans le cytoplasme et recrutent la caspase-1. La caspase-1 clive la pro-IL-1β (interleukine 1 bêta) en IL-1β mature, qui est alors sécrétée, et clive la protéine GSDMD (
gasdermin D
), ce qui active la mort cellulaire par pyroptose. Comparée à son orthologue humain, l’activité de la protéine NLRP3 est diminuée chez
P. alecto
, ce qui réduit l’activation de l’inflammasome [
33
]. Le gène
ASC2,
qui ne possède pas de domaine de recrutement de la caspase-1 chez la chauve-souris, est fortement exprimé dans les cellules immunitaires de
P. alecto
et est un puissant inhibiteur de l’inflammasome [
34
]. En aval de la formation des complexes ASC, deux résidus de la caspase-1 sont sous sélection positive et diminuent sa capacité à cliver l’IL-1β et la GSDMD. L’étude de cette voie de signalisation chez deux espèces éloignées de chauve-souris (
Eonycteris spelaea
et
Myotis davidii
) a cependant révélé que leur caspase-1 conserve toute sa capacité enzymatique, mais que c’est le clivage de l’IL-1β qui est diminué en raison de la présence d’un résidu sérine adjacent au site de clivage dans la protéine des chauves-souris [
35
].
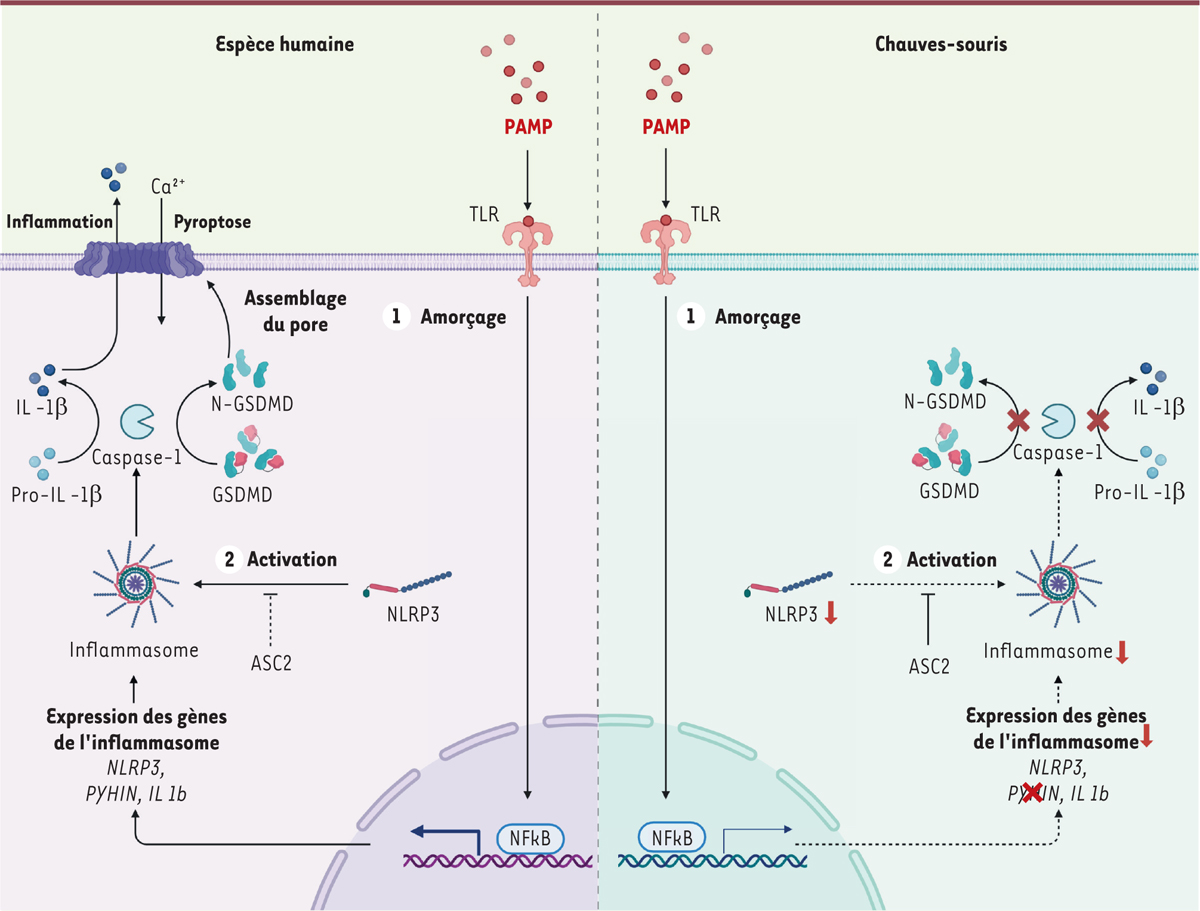
 | Figure 2.
Comparaison de la voie de l’inflammasome entre espèce humaine et chauves-souris.
La fixation d’un PAMP sur un PRR correspond au signal d’amorçage de la voie (1) et entraîne l’expression des gènes de l’inflammasome via le facteur de transcription NF-kB. Chez les chauves-souris (à droite), ces gènes sont moins exprimés et les senseurs d’ADN cytoplasmiques de la famille PYHIN sont absents du génome. Un deuxième signal d’activation (2) permet l’agrégation des protéines NLRP3 pour former le complexe de l’inflammasome. Chez les chauves-souris, l’activité de NLRP3 est plus faible que chez l’être humain, et la protéine ASC2 inhibe fortement l’activation de l’inflammasome. L’inhibition causée par la protéine ASC2 humaine est plus faible. Le complexe de l’inflammasome active la caspase 1, qui clive la pro-IL-1b en IL-1b mature, qui est sécrétée. La caspase-1 clive également la protéine GSDMD, qui forme un pore membranaire et entraîne la mort de la cellule par pyroptose. Chez les chauves-souris, l’activité de la caspase-1 est réduite, et la pro-IL-1b et GSDMD ne sont pas clivés, ce qui limite l’inflammation et empêche la mort cellulaire par pyroptose. PAMP :
pathogen-associated molecular pattern
; TLR :
toll-like receptor
; IL-1b : interleukine 1 bêta ; GSDMD :
gasdermin D
; NLRP3 :
nucleotide-binding domain leucin-rich repeat and pyrin-containing receptor 3
; ASC2 :
apoptosis-associated speck-like protein containing a caspase recruitment domain 2
; PYHIN :
pyrin and hematopoietic interferon-inducible nuclear domain-containing protein
; NF-kB :
nuclear factor-kappa B
(figure créée sur BioRender.com).
|
L’inflammasome peut également être activé en réponse à la présence d’ADN dans le cytoplasme d’une cellule. Les gènes du locus PYHIN (
pyrin and hematopoietic interferon-inducible nuclear domain
) codent les seuls senseurs qui reconnaissent ce signal de danger et sont capables d’activer l’inflammasome. Ils sont absents des génomes de dix espèces de chauves-souris [
36
,
37
], ce qui en fait les seuls mammifères placentaires n’ayant pas au moins un membre de cette famille de gènes. Leur absence entraîne la perte de l’activation de l’inflammasome au niveau cellulaire [
35
]. D’autres adaptations existent dans la voie de reconnaissance des ADN cytoplasmiques impliquant la protéine STING (
stimulator of interferon genes)
, dont l’activation entraîne la production d’IFN-β. Chez les trente espèces de chauves-souris pour lesquelles la séquence de STING est disponible, une mutation de cette protéine qui induit une diminution de son activité antivirale a été décrite [
38
].
La présence de nombreuses adaptations des voies de reconnaissance des ADN cytoplasmiques pourrait être liée à l’évolution du vol actif chez les chauves-souris. Le vol a en effet un coût énergétique et métabolique élevé et induit la production d’espèces réactives de l’oxygène, qui sont à l’origine de dommages à l’ADN. Les chauves-souris pourraient alors avoir développé des systèmes permettant de réduire les réponses à ces signaux de danger afin d’éviter une inflammation persistante [
31
].
|
Quelles directions pour le futur
Les recherches sur les chauves-souris sont réduites en raison du manque d’outils disponibles. La plupart des espèces sont protégées en Europe, et les modèles
in vivo
sont rares. Les modèles
in vitro
sont peu nombreux. Ils consistent principalement en des cellules immortalisées isolées d’un nombre restreint d’espèces, limitant leur utilisation comme substrat cellulaire pour l’isolement viral.
Durant les dernières années, très peu de virus identifiés chez les chauves-souris ont pu être isolés. Quand ils l’ont été, ces virus ont souvent été propagés sur des lignées cellulaires hétérologues, ce qui peut être à l’origine de mutations d’adaptation et entraîner des divergences par rapport aux souches dites sauvages. Lorsque les virus de chauves-souris ne peuvent pas être cultivés sur des modèles
in vitro
, les recherches sont en général réalisées à partir de virus humains proches des virus de chauves-souris, mais ces modèles d’étude ne sont pas représentatifs des interactions entre virus et réservoirs. Afin de pallier ces obstacles, le développement de différentes approches de génétique inverse, qui permettent de produire des souches virales infectieuses à partir de séquences d’ADN, pourra permettre d’accélérer leur étude.
Les données de la littérature sont également bien souvent biaisées, favorisant l’étude de virus à potentiel zoonotique sur un nombre limité d’espèces modèles. Ces résultats ne peuvent donc pas être considérés comme représentatifs de l’intégralité des chiroptères. Par exemple, une expression constitutive de l’IFN-a a été rapportée chez
P. alecto
, mais ces résultats n’ont pas été reproduits chez d’autres espèces de chauves-souris, comme
R. aegypticus
et
M. daubentonii
.
Des efforts de développement d’outils sont donc nécessaires afin de pouvoir étudier les réactions immunitaires des chauves-souris dans des contextes représentant au mieux les infections pouvant se produire dans la nature, et de caractériser la capacité des virus à entrer et à se répliquer dans les cellules humaines, afin d’évaluer leur potentiel zoonotique. Récemment, le développement de nouveaux modèles innovants a apporté un nouvel espoir pour l’étude de l’immunité des chauves-souris. L’adaptation de protocoles de reprogrammation cellulaire permettant la génération de cellules souches pluripotentes induites permet en effet d’envisager l’étude de phénomènes spécifiques à certains tissus et à certains types cellulaires, et ouvrent la voie vers le développement d’organoïdes pour l’étude des chauves-souris [
39
]. Les modèles
in vivo
hybrides, comme des souris transgéniques qui expriment un gène de chauve-souris, ou un modèle chimérique de souris – chauve-souris représentent une alternative à l’utilisation de colonies de chauves-souris en captivité, difficiles à établir et à maintenir [
18
].
Grâce à l’initiative Bat1K (
https://bat1k.com/
), de récents efforts ont permis de séquencer et annoter les génomes de plusieurs centaines d’espèces de chauves-souris. La mise à disposition de nouveaux génomes annotés et l’adaptation de techniques comme le séquençage à l’échelle de la cellule unique (
single cell
) ou les cribles CRISPR (
clustered regularly interspaced short palindromic repeats
) – Cas9 pour l’étude des chauves-souris permettront de développer une meilleure compréhension de leurs mécanismes immunitaires singuliers.
|
Au cours de leur évolution, les chauves-souris ont développé des adaptations qui leur permettent d’avoir des défenses antivirales puissantes et efficaces, tout en limitant leurs réponses inflammatoires qui peuvent s’avérer délétères pour leur organisme. Elles maintiennent donc un état homéostatique contribuant à leur survie face aux infections virales, sans présenter de symptômes. Développer une meilleure compréhension de leurs mécanismes immunitaires permettra d’ouvrir des perspectives de traitements pour certaines maladies infectieuses ou inflammatoires. En effet, alors que de nombreuses maladies humaines sont associées à une activation excessive du système immunitaire, la découverte de mécanismes limitant l’inflammation chez les chauves-souris se révèle prometteuse. Récemment, Ahn
et al.
ont introduit la protéine ASC2 de chauves-souris, inhibitrice de l’inflammasome, dans des cellules humaines, ce qui a permis d’inhiber l’activation de ce complexe dans ces cellules [
34
]. Cette étude constitue une preuve de concept pour une application des recherches sur le système immunitaire des chauves-souris dans le traitement des maladies inflammatoires ou des maladies infectieuses, comme, par exemple, la COVID-19 [
40
] (
→
).
(→) Voir la Synthèse de M. Chemarin
et al
.,
m/s
n° 6-7, juin-juillet 2022, page 545
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Ge
X-Y
,
Li
J-L
,
Yang
X-L
,
et al.
Isolation and characterization of a bat SARS-like coronavirus that uses the ACE2 receptor.
.
Nature
2013;
;
503
:
:535.
–
538
.
2.
Zaki
AM
,
van Boheemen
S
,
Bestebroer
TM
,
et al.
Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia.
.
N Engl J Med
2012;
;
367
:
:1814.
–
1820
.
3.
Zhou
P
,
Yang
X-L
,
Wang
X-G
,
et al.
A pneumonia outbreak associated with a new coronavirus of probable bat origin.
.
Nature
2020;
;
579
:
:270.
–
3
.
4.
Calisher
CH
,
Childs
JE
,
Field
HE
,
et al.
Bats: important reservoir hosts of emerging viruses.
.
Clin Microbiol Rev
2006;
;
19
:
:531.
–
545
.
5.
Van Brussel
K
,
Holmes
EC
.
Zoonotic disease and virome diversity in bats.
.
Curr Opin Virol
2022;
;
52
:
:192.
–
202
.
6.
Luis
AD
,
Hayman
DTS
,
O’Shea
TJ
,
et al.
A comparison of bats and rodents as reservoirs of zoonotic viruses: are bats special?
.
Proceedings of the Royal Society B: Biological Sciences
2013;
;
280
:
:20122753.
.
7.
Weinberg
M
,
Yovel
Y
.
Revising the paradigm: Are bats really pathogen reservoirs or do they possess an efficient immune system?
iScience
2022
;
:25.
.
8.
Towner
JS
,
Amman
BR
,
Sealy
TK
,
et al.
Isolation of Genetically Diverse Marburg Viruses from Egyptian Fruit Bats.
.
PLOS Pathog
2009;
;
5
:
:e1000536.
.
9.
Halpin
K
,
Young
PL
,
Field
HE
,
et al.
Isolation of Hendra virus from pteropid bats: a natural reservoir of Hendra virus.
.
J Gen Virol
2000;
;
81
:
:1927.
–
1932
.
10.
Chua
KB
,
Lek Koh
C
,
Hooi
PS
,
et al.
Isolation of Nipah virus from Malaysian Island flying-foxes.
.
Microbes Infection
2002;
;
4
:
:145.
–
151
.
11.
Ruiz-Aravena
M
,
McKee
C
,
Gamble
A
,
et al.
Ecology, evolution and spillover of coronaviruses from bats.
.
Nat Rev Microbiol
2022;
;
20
:
:299.
–
314
.
12.
Shipley
R
,
Wright
E
,
Selden
D
,
et al.
Bats and Viruses: Emergence of Novel Lyssaviruses and Association of Bats with Viral Zoonoses in the EU.
.
Trop Med Infect Dis
2019;
;
4
:
:31.
.
13.
Haydon
DT
,
Cleaveland
S
,
Taylor
LH
,
Laurenson
MK
Identifying Reservoirs of Infection: A Conceptual and Practical Challenge.
.
Emerg Infect Dis
2002;
;
8
:
:1468.
–
1473
.
14.
Aicher
S-M
,
Streicher
F
,
Chazal
M
,
et al.
Species-Specific Molecular Barriers to SARS-CoV-2 Replication in Bat Cells.
.
J Virol
2022;
;
96
:
:e0060822.
.
15.
Sallard
E
,
Halloy
J
,
Casane
D
,
et al.
Retrouver les origines du SARS-CoV-2 dans les phylogénies de coronavirus.
.
Med Sci (Paris)
2020;
;
36
:
:783.
–
96
.
16.
Frutos
R
,
Gavotte
L
,
Devaux
CA
.
Le virus SARS-CoV-2 n’a pas « d’origine ».
.
Med Sci (Paris)
2022;
;
38
:
:600.
–
7
.
17.
Temmam
S
,
Vongphayloth
K
,
Baquero
E
,
et al.
Bat coronaviruses related to SARS-CoV-2 and infectious for human cells.
.
Nature
2022;
;
604
:
:330.
–
6
.
18.
Irving
AT
,
Ahn
M
,
Goh
G
,
et al.
Lessons from the host defences of bats, a unique viral reservoir.
.
Nature
2021;
;
589
:
:363.
–
70
.
19.
Leroy
É
,
Pourrut
X
,
Gonzalez
J-P
Les chauves-souris, réservoirs du virus Ebola : Le mystère se dissipe.
.
Med Sci (Paris)
2006;
;
22
:
:78.
–
80
.
20.
Amengual
B
,
Bourhy
H
,
López-Roig
M
,
et al.
Temporal Dynamics of European Bat Lyssavirus Type 1 and Survival of Myotis myotis Bats in Natural Colonies.
.
PLOS ONE
2007;
;
2
:
:e566.
.
21.
Brook
CE
,
Dobson
AP
Bats as ‘special’ reservoirs for emerging zoonotic pathogens.
.
Trends Microbiol
2015;
;
23
:
:172.
–
180
.
22.
Zhou
P
,
Tachedjian
M
,
Wynne
JW
,
et al.
Contraction of the type I IFN locus and unusual constitutive expression of IFN-α in bats.
.
Proc Natl Acad Sci U S A
2016;
;
113
:
:2696.
–
2701
.
23.
Pavlovich
SS
,
Lovett
SP
,
Koroleva
G
,
et al.
The Egyptian Rousette Genome Reveals Unexpected Features of Bat Antiviral Immunity.
.
Cell
2018;
;
173
:
:1098.
–
1110.e18
.
24.
Hölzer
M
,
Schoen
A
,
Wulle
J
,
et al.
Virus- and Interferon Alpha-Induced Transcriptomes of Cells from the Microbat Myotis daubentonii.
.
iScience
2019;
;
19
:
:647.
–
61
.
25.
Zhou
P
,
Cowled
C
,
Mansell
A
,
et al.
IRF7 in the Australian Black Flying Fox, Pteropus alecto: Evidence for a Unique Expression Pattern and Functional Conservation.
.
PLOS ONE
2014;
;
9
:
:1.
–
13
.
26.
Banerjee
A
,
Zhang
X
,
Yip
A
,
et al.
Positive Selection of a Serine Residue in Bat IRF3 Confers Enhanced Antiviral Protection.
.
iScience
2020;
;
23
:
:100958.
.
27.
He
X
,
Korytár
T
,
Schatz
J
,
et al.
Anti-Lyssaviral Activity of Interferons κ and ω from the Serotine Bat.
.
Eptesicus serotinus. J Virol
2014;
;
88
:
:5444.
–
5454
.
28.
Shaw
AE
,
Hughes
J
,
Gu
Q
,
et al.
Fundamental properties of the mammalian innate immune system revealed by multispecies comparison of type I interferon responses.
.
PLOS Biol
2017;
;
15
:
:e2004086.
.
29.
De La Cruz-Rivera
P
,
Kanchwala
M
,
Liang
H
,
et al.
The IFN Response in Bats Displays Distinctive IFN-Stimulated Gene Expression Kinetics with Atypical RNASEL Induction.
.
J Immunol
2018;
;
200
:
:209.
–
217
.
30.
Jacquet
S
,
Culbertson
M
,
Zhang
C
,
et al.
Adaptive duplication and genetic diversification of protein kinase R contribute to the specificity of bat-virus interactions.
.
Sci Adv
2022;
;
8
:
:eadd7540.
.
31.
Hayman
DTS
.
Bat tolerance to viral infections.
.
Nat Microbiol
2019;
;
4
:
:728.
–
729
.
32.
Banerjee
A
,
Rapin
N
,
Bollinger
T
,
et al.
Lack of inflammatory gene expression in bats: a unique role for a transcription repressor.
.
Sci Rep
2017;
;
7
:
:2232.
.
33.
Ahn
M
,
Anderson
DE
,
Zhang
Q
,
et al.
Dampened NLRP3-mediated inflammation in bats and implications for a special viral reservoir host.
.
Nat Microbiol
2019;
;
4
:
:789.
–
799
.
34.
Ahn
M
,
Chen
VC-W
,
Rozario
P
,
et al.
Bat ASC2 suppresses inflammasomes and ameliorates inflammatory diseases.
.
Cell
2023;
;
186
:
:2144.
–
2159.e22
.
35.
Goh
G
,
Ahn
M
,
Zhu
F
,
et al.
Complementary regulation of caspase-1 and IL-1β reveals additional mechanisms of dampened inflammation in bats.
.
Proc Natl Acad Sci U S A
2020;
;
117
:
:28939.
–
49
.
36.
Zhang
G
,
Cowled
C
,
Shi
Z
,
et al.
Comparative Analysis of Bat Genomes Provides Insight into the Evolution of Flight and Immunity.
.
Science
2013;
;
339
:
:456.
–
460
.
37.
Ahn
M
,
Cui
J
,
Irving
AT
,
et al.
Unique Loss of the PYHIN Gene Family in Bats Amongst Mammals: Implications for Inflammasome Sensing.
.
Sci Rep
2016;
;
6
:
:21722.
.
38.
Xie
J
,
Li
Y
,
Shen
X
,
et al.
Dampened STING-Dependent Interferon Activation in Bats.
.
Cell Host Microbe
2018;
;
23
:
:297.
–
301.e4
.
39.
Déjosez
M
,
Marin
A
,
Hughes
GM
,
et al.
Bat pluripotent stem cells reveal unusual entanglement between host and viruses.
.
Cell
2023;
;
186
:
:957.
–
74.e28
.
40.
Chemarin
M
,
Dufies
O
,
Mazet
A
,
et al.
L’inflammasome NLRP3 dans la physiopathologie des infections virales - Un focus sur la COVID-19.
.
Med Sci (Paris)
2022;
;
38
:
:545.
–
52
.
|