Les leucémies aiguës myéloïdes sont des hémopathies malignes caractérisées par l’accumulation de cellules immatures de lignage myéloïde (ou myéloblastes) [ 1 ]. Les stratégies thérapeutiques actuelles dépendent de l’âge et des comorbidités de chaque patient, ainsi que de l’évaluation du risque de rechute, qui est fortement associé aux caractéristiques cytogénétiques et moléculaires de ces hémopathies [ 2 ]. Ainsi, pour les patients les plus jeunes et sans comorbidité importante, le traitement initial consiste en une chimiothérapie associant une anthracycline (daunorubicine ou idarubicine) et la cytarabine. Dans le cas de l’obtention d’une réponse complète à cette première phase, un traitement dit de consolidation est proposé, soit par chimiothérapie, soit par une greffe de cellules souches hématopoïétiques. Pour les patients plus âgés ou fragiles, le traitement repose actuellement sur l’association d’un agent déméthylant (azacytidine) et d’un inhibiteur sélectif de la protéine anti-apoptotique BCL2, le venetoclax [ 3 ]. En présence de certains profils moléculaires, des thérapies ciblées peuvent être combinées à la chimiothérapie ou à l’azacytidine. Il s’agit des inhibiteurs de tyrosine kinase ciblant FLT3 ( fms-like tyrosine kinase 3 ) et des inhibiteurs ciblant les formes mutantes des enzymes IDH1 et IDH2 (isocitrate déshydrogénases 1 et 2). Malgré ces avancées thérapeutiques récentes, les leucémies aiguës myéloïdes restent des maladies au pronostic réservé, avec une survie médiane comprise entre 12 et 36 mois. Une meilleure compréhension des mécanismes de résistance thérapeutique est ainsi nécessaire afin d’améliorer les traitements et le pronostic.
L’un des gènes les plus fréquemment mutés dans ces leucémies est FLT3 , qui code un récepteur transmembranaire à activité tyrosine kinase [ 4 ] impliqué dans la prolifération et la survie des cellules souches hématopoïétiques normales. L’interaction de FLT3 avec son ligand ( FLT3-ligand ) change sa conformation en ouvrant la boucle d’activation contenant la poche de fixation de l’ATP. Le récepteur se dimérise alors, entraînant la phosphorylation en trans de deux résidus tyrosine situés dans le domaine juxta-membranaire, ce qui active la fonction tyrosine kinase du récepteur et différentes voies de signalisation, notamment les voies des MAPK ( mitogen-associated protein kinase ), de PI3K ( phosphoinositide 3 kinase )/AKT, et de STAT5 ( signal transducer and activator of transcription 5 ), impliquées dans la prolifération, la survie et la différenciation cellulaires, et dans le contrôle de l’apoptose. L’acquisition de mutations de FLT3 est un évènement tardif dans la leucémogenèse et représente un tournant évolutif. FLT3 est muté chez près de 30 % des patients présentant une leucémie aiguë myéloïde au moment du diagnostic. On distingue les insertions sans décalage du cadre de lecture ( internal tandem duplication , ITD), les plus fréquentes, et des mutations ponctuelles du domaine tyrosine kinase ( tyrosine kinase domain , TKD) conduisant à des substitutions d’acides aminés. Les inhibiteurs de tyrosine kinase ciblant FLT3 sont utilisés en pratique médicale depuis plusieurs années : en particulier, l’utilisation de midostaurine ou de quizartinib en association à la polychimiothérapie a apporté d’importants bénéfices en termes de survie et de diminution du risque de rechute chez des patients ayant une mutation de FLT3 , et chez les patients en rechute après la chimiothérapie ou réfractaires à celle-ci, et le gilteritinib est supérieur à la chimiothérapie pour l’obtention de rémission et la survie globale [ 5 – 7 ]. Malheureusement, les rechutes surviennent rapidement sous traitement, et sont associées à l’acquisition de nouvelles mutations entraînant une résistance aux inhibiteurs de tyrosine kinase : mutations TKD de FLT3 , mutations de gènes de la voie de signalisation RAS/MAPK, de TP53 et de différents modulateurs épigénétiques comme les gènes TET2 (codant une méthylcytosine dioxygénase) , IDH1, IDH2 ou DNMT3A (codant une méthyltransférase) [ 8 , 9 ]. Ainsi, une compréhension approfondie des conséquences des mutations de FLT3 est indispensable pour définir de nouvelles stratégies thérapeutiques dans ce sous-type de leucémie aiguë myéloïde.
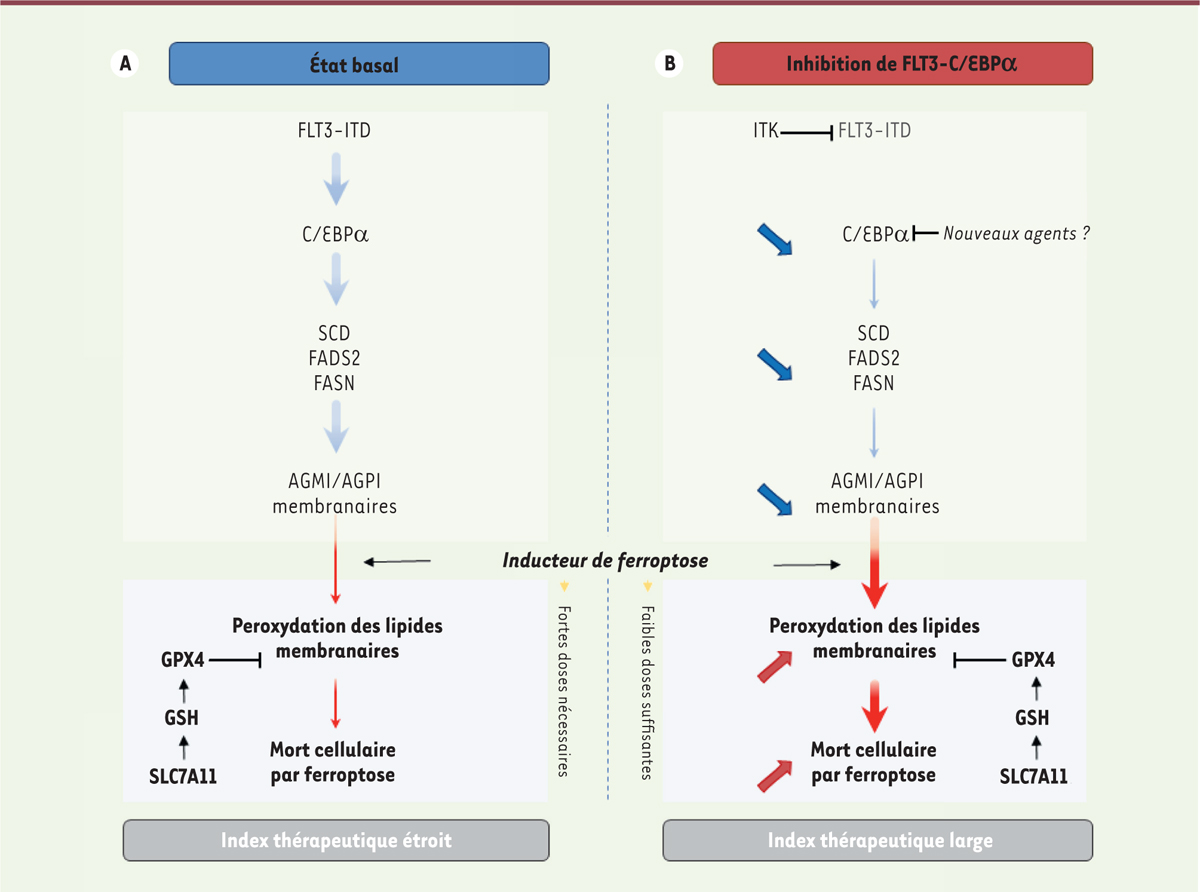
La reprogrammation du métabolisme des cellules cancéreuses est une caractéristique de l’oncogenèse : elle permet de répondre à l’augmentation des demandes énergétiques de la cellule tumorale [ 10 , 11 ]. Dans le cas des leucémies aiguës myéloïdes avec mutation de FLT3 , la glycolyse, la voie des pentoses phosphates, le métabolisme de la glutamine ou encore les voies de biosynthèse de la sérine représentent d’importantes dépendances métaboliques [ 12 – 14 ]. En appliquant une approche « multiomique » à partir de modèles murins humanisés dérivant de cellules primaires issues de patients présentant une leucémie aiguë myéloïde ( patient-derived xenograft , PDX), nous avons montré que la forme mutante du récepteur FLT3 activait des voies de contrôle du métabolisme des lipides, en particulier les voies de biosynthèse des acides gras et du cholestérol. Notamment, les gènes SCD ( stearoyl-CoA desaturase ), impliqué dans la biosynthèse des acides gras monoinsaturés, et FADS2 ( fatty acid desaturase 2 ), impliqué dans la biosynthèse des acides gras hautement insaturés à partir des acides gras polyinsaturés, sont surexprimés dans les cellules exprimant FLT3-ITD. D’un point de vue mécanistique, l’activation mutationnelle de FLT3 entraîne indirectement la phosphorylation du facteur de transcription C/EBPα ( CCAAT/enhancer-binding protein α ) sur un résidu sérine, ce qui en augmente la quantité en limitant sa dégradation par le protéasome, et favorise alors l’expression de nombreux gènes, en particulier ceux impliqués dans la biosynthèse des acides gras, comme SCD, FADS2 et FASN ( fatty acid synthase ). Dans une perspective thérapeutique, l’inhibition de C/EBPα ou de FLT3-ITD conduit à un blocage de ces voies de biosynthèse des acides gras, en particulier via l’inhibition de SCD , et modifie ainsi profondément la composition cellulaire en lipides, en entraînant notamment une diminution globale du contenu cellulaire en glycérophospholipides, un des constituants majeurs des membranes cellulaires.
La biosynthèse des lipides de novo , qui implique notamment les enzymes FASN et SCD, est en grande partie dédiée à la synthèse des acides gras monoinsaturés, tandis que les acides gras polyinsaturés sont principalement synthétisés à partir des acides gras importés du milieu extracellulaire. En analysant la proportion de ces sous-groupes d’acides gras dans les phospholipides majoritaires, dont la phosphatidylcholine, nous avons montré que l’inhibition de FLT3 ou de C/EBPα diminue davantage la quantité d’acides gras monoinsaturés que celle d’acides gras polyinsaturés. Or, ces derniers sont plus volontiers la cible de réactions de peroxydation que les acides gras monoinsaturés. L’accumulation des lipides peroxydés au sein des phospholipides altère l’intégrité des membranes et peut conduire à un processus de mort cellulaire indépendant de l’apoptose : la ferroptose 1 [ 15 ] ( → ).
(→) Voir la Synthèse de R. Birsen et al., m/s n° 8-9, août-septembre 2021, page 726
D’où l’hypothèse que l’enrichissement cellulaire relatif en acides gras polyinsaturés observé après l’inhibition de FLT3-ITD ou l’inactivation de C/EBPα pourrait sensibiliser les cellules leucémiques à l’induction de la ferroptose. Nous avons confirmé, dans notre modèle murin de leucémie aiguë myéloïde, que l’inhibition de la synthèse des acides gras monoinsaturés par inhibition (génétique ou pharmacologique) de SCD augmentait la sensibilité aux inducteurs de ferroptose [ 16 ]. Inversement, la surexpression de SCD, ou la culture dans un milieu riche en oléate (un acide gras monoinsaturé), protégeait les cellules leucémiques de l’induction de la ferroptose. In vitro , l’association du quizartinib à un inhibiteur de GPX4 ( glutathione peroxydase 4 , enzyme impliqué dans la détoxification des lipides peroxydés) induisant la ferroptose était synergique et augmentait la mort cellulaire par ferroptose. De plus, nous avons montré que l’inactivation du gène codant GPX4 (en utilisant la méthode CRISPR-Cas9) augmentait l’activité anti-leucémique du gilteritinib in vivo [ 17 ].
En résumé, nous avons montré que la signalisation oncogénique FLT3-ITD limitait la dégradation du facteur de transcription C/EBPα. Or, C/EBPα contrôle l’expression de plusieurs acteurs majeurs du métabolisme des lipides. Ainsi l’inhibition de FLT3-ITD a pour conséquence une diminution de la quantité protéique de CEBP/α, une altération des voies de biosynthèse des lipides et une modification profonde de la composition cellulaire en lipides. En particulier, elle entraîne une augmentation relative du contenu cellulaire en acide gras polyinsaturés par rapport aux acide gras monoinsaturés, ce qui augmente la susceptibilité des cellules à la peroxydation des lipides membranaires et à la mort cellulaire par ferroptose. Ainsi, l’association d’un inducteur de ferroptose à un inhibiteur de tyrosine kinase ciblant FLT3 produit une létalité synthétique 2, à l’origine d’un effet anti-leucémique in vitro et in vivo ( Figure 1 ) [ 17 ]. Au-delà de l’éclairage physiopathologique sur les modifications du métabolisme lipidique induit par la mutation FLT3-ITD dans la leucémie aiguë myéloïde, ces résultats apportent une preuve de concept inédite dans le domaine de l’utilisation de la mort cellulaire par ferroptose comme stratégie thérapeutique innovante en oncologie. En effet, le développement d’inducteurs de ferroptose à visée antitumorale est actuellement l’objet d’une recherche intense portant sur des inhibiteurs de GPX4 ou du transporteur SLC7A11 impliqué dans l’import cellulaire de cystine, un métabolite contribuant à la synthèse de l’antioxydant glutathion ( Figure 1 ) [ 15 ]. Mais la potentielle toxicité de ces inducteurs de ferroptose sur les cellules normales, notamment les neurones et les cellules rénales, dont la survie dépend fortement de GPX4, limitera vraisemblablement notre capacité à les utiliser à des doses suffisantes pour obtenir une forte activité antitumorale. Pour une efficacité sur les cellules tumorales sans toxicité excessive pour l’organisme, une étude systématique des paramètres de susceptibilité ou de résistance à la ferroptose sera nécessaire pour chaque sous-type tumoral afin d’identifier les cancers ou hémopathies malignes qui seront particulièrement sensibles à l’induction de ferroptose [ 18 ]. Nous proposons ici une stratégie thérapeutique alternative : utiliser un composé ciblant spécifiquement les cellules tumorales pour les rendre vulnérables à la peroxydation des lipides membranaires, ce qui devrait permettre de diminuer la dose efficace des inducteurs de ferroptose.
| Figure 1.
Reprogrammation du métabolisme lipidique induit par C/EBPα dans les leucémies aiguës myéloïdes avec mutation « internal tandem duplication » du récepteur FLT3 (FLT3-ITD), avant (a) et après (b) inhibition de FLT3 ou du facteur de transcription C/EBPα.
AGMI : acides gras monoinsaturés ; AGMP : acides gras polyinsaturés ; C/EBPα : CCAAT/enhancer-binding protein α ; FADS2 : fatty acid desaturase 2 ; FASN : fatty acid synthase ; FLT3 : fms-like tyrosine kinase 3 ; SCD : stearoyl-CoA desaturase ; ITK : inhibiteur de tyrosine kinase ; GPX4 : glutathione peroxydase 4 ; GSH : glutathion ; SLC7A11 : solute carrier family 7 member 11, échangeur cystine/glutamate.
|