| |
| Med Sci (Paris). 39(11): 896–898. doi: 10.1051/medsci/2023128.Des outils transcriptomiques pour identifier des patients répondeurs à l’immunothérapie dans le cancer du pancréas Zélie Bouveret1* and Ana Hennino1,2,3** 1Université Claude Bernard Lyon 1
,
69000Lyon
,
France 2Cancer Research Center of Lyon, UMR Inserm 1052, CNRS 5286
,
Lyon
,
France 3Centre Léon Bérard
,
Lyon
,
France MeSH keywords: Humains, Transcriptome, Tumeurs du pancréas, Analyse de profil d'expression de gènes, Immunothérapie, Tumeurs du pancréas, génétique, thérapie |
En 2020, l’adénocarcinome canalaire pancréatique (ADKP) était associé à 466 003 décès, pour 495 773 cas, faisant de l’ADKP la septième cause de décès par cancer [
1
]. Ce faible taux de survie de l’ADKP s’explique, pour une majorité des patients, par un diagnostic tardif de la maladie. Les possibilités thérapeutiques de l’ADKP sont très limitées, et la plupart du temps fondées sur l’administration d’une chimiothérapie, dont l’efficacité reste limitée. La résistance à la chimiothérapie est principalement due au microenvironnement de l’ADKP. Ce microenvironnement est décrit comme un environnement très dense, en raison de la sécrétion importante de protéines de la matrice extracellulaire, comme les collagènes, la fibronectine et la laminine, qui empêche la pénétration des agents thérapeutiques au sein de la tumeur [
2
]. Parmi les différents acteurs du microenvironnement, les fibroblastes associés aux carcinomes (CAF) sont des acteurs majeurs de la production de cette matrice extracellulaire.
Les immunothérapies fondées sur l’utilisation d’anticorps inhibiteurs des points de contrôle immunitaire (ICI) ont été introduites il y a plus d’une vingtaine d’années en oncologie. Parmi ces anticorps inhibiteurs, l’ipilimumab a été le premier ICI approuvé par la FDA (
Food and Drug Administration
) américaine, en 2014, pour le traitement mélanome métastatique qui n’avait montré aucune amélioration thérapeutique depuis plusieurs années [
3
]. Les points de contrôle immunitaire (CI) les plus étudiés, PD-1 (
programmed cell death protein 1)
et CTLA-4 (
cytotoxic T-lymphocyte-associated protein 4)
, sont des molécules présentes à la surface des lymphocytes T. La liaison de ces CI à leur ligand produit un signal inhibiteur qui, dans le lymphocyte T, va induire une diminution de l’activation de la voie du TCR (
T-cell receptor
) et de la production de cytokines pro-inflammatoires et, ainsi, la diminution de la lyse des cellules cibles. Ces molécules interviennent dans des conditions physiologiques au terme de la réponse immunitaire pour contrôler sa cinétique et son intensité et éviter un emballement de cette dernière. Elles permettent également de protéger notre corps des réactions auto-immunes. L’augmentation de l’expression des CI à la surface des cellules cancéreuses est l’un des mécanismes qui permet à la tumeur d’échapper à la réponse immunitaire. Les ICI ont été ainsi développés pour lever cette inhibition en bloquant les interactions des CI avec leurs ligands.
Ayant prouvé une certaine efficacité dans différents cancers, l’utilisation de l’ipilimumab (un anticorps anti-CTLA-4) et durvalumab (un anticorps anti-PDL-1) dans l’ADKP n’ont peu, voire pas, montré d’efficacité [
4
,
5
]. Le microenvironnement de l’ADKP est souvent caractérisé par une abondante réaction stromale desmoplastique. Les CAF sont une des raisons pour lesquelles les ICI n’apportent pas de bénéfice thérapeutique aux patients présentant un ADKP, principalement par leur rôle de barrière physique et fonctionnelle. En effet, les CAF sécrètent des agents immunosuppresseurs dans le microenvironnement tumoral empêchant les cellules immunitaires de pénétrer au sein de la tumeur.
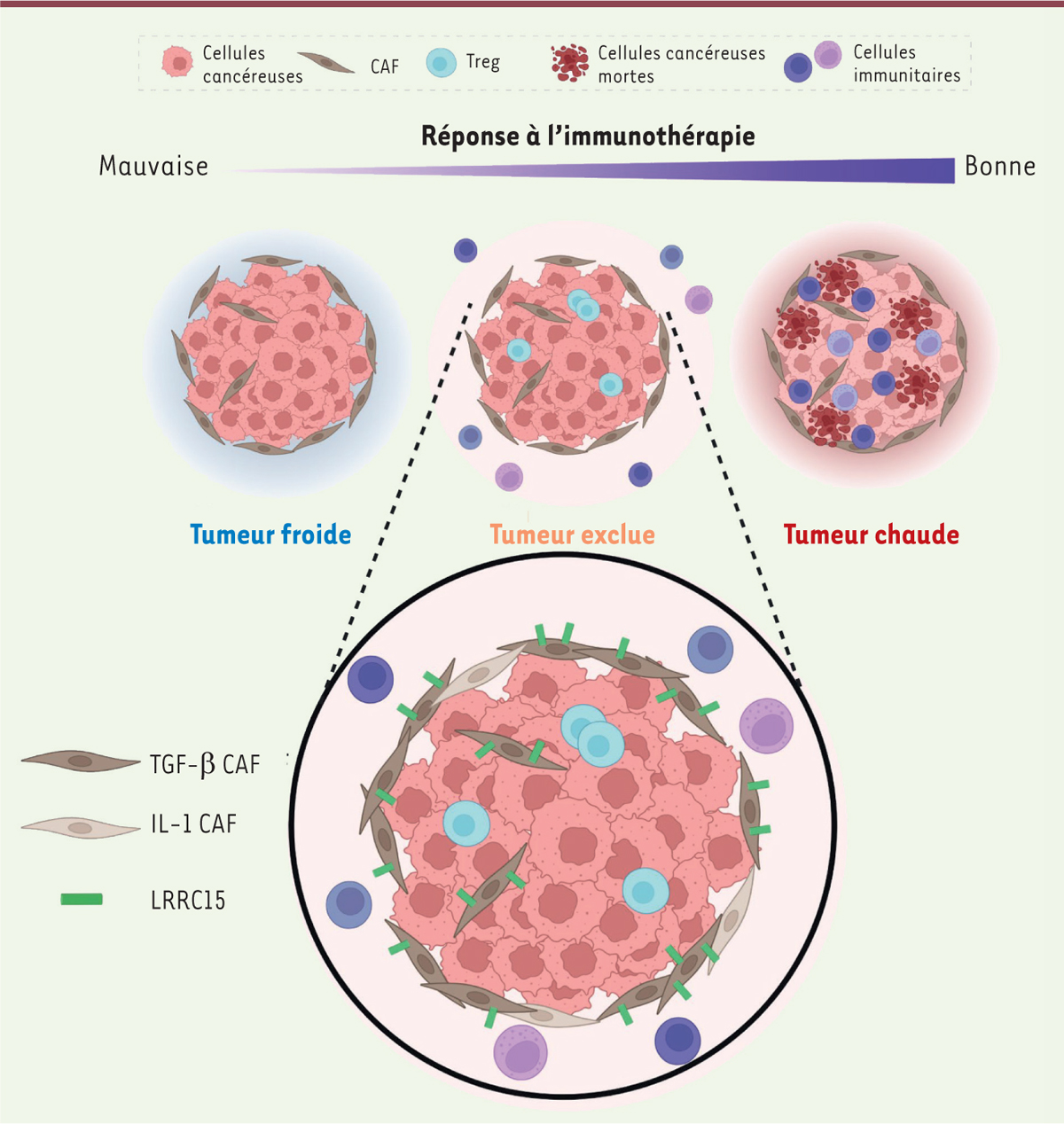
Les ICI ont une bonne efficacité pour les tumeurs fortement infiltrées par des cellules immunitaires (des tumeurs dites « chaudes ») alors que pour les tumeurs « exclues », dans lesquelles les cellules immunitaires sont présentes mais restent en périphérie de la zone tumorale (à la différence des tumeurs « froides » dans lesquelles il n’y a pas d’infiltrat immunitaire), cette efficacité est limitée [
6
]. Les ADKP sont des tumeurs connues pour être le plus souvent de type « exclues ». La découverte de biomarqueurs d’efficacité des ICI dans ce type de cancer est donc primordiale pour une meilleure prise en charge thérapeutique des patients.
|
La technique d’analyse des séquences d’ARN en cellule unique : un puissant outil de prédiction à travers une analyse transcriptomique
Dominguez
et al.
ont récemment réalisé une analyse de séquençage d’ARN en cellule unique (ou scRNAseq) du microenvironnement tumoral de l’ADKP afin de définir des signatures moléculaires de réponse à l’immunothérapie [
9
]. Dans une étude publiée en 2020, ces chercheurs ont présenté les résultats de leur analyse en scRNAseq de tumeurs de pancréas de souris, dont une partie portait plus particulièrement sur l’étude des CAF. Plusieurs sous-populations de CAF ont été identifiées, dont deux retrouvées particulièrement dans les stades avancés de l’ADKP, les IL1-CAF et les TGFβ-CAF, appelées ainsi car leur signature transcriptionnelle est induite respectivement par l’IL-1 (interleukine 1) et le TGF-β (
transforming growth factor
b). Étant donné que la fréquence de la population TGFβ-CAF augmente avec la progression tumorale, ces auteurs ont particulièrement étudié cette population et ont cherché à caractériser un marqueur permettant de l’identifier facilement. Ils ont observé que LRRC15 (
leucine-rich repeat-containing 15)
, une protéine transmembranaire dont l’expression est régulée positivement par le TGF-β est plus exprimée dans les TGFβ-CAF que dans d’autres sous-populations de CAF.
Une analyse en immunohistochimie de 70 tumeurs ADKP de patients a montré que 100 % des patients positifs pour ce marqueur LRRC15 présentaient une tumeur « exclue ». De plus, la surexpression de LRRC15 dans les CAF a été corrélée à une mauvaise réponse des ICI dans les tumeurs exclues (
Figure 1
) alors que cette expression n’est pas prédictive de la réponse aux ICI dans les tumeurs chaudes et froides. Ainsi, pour les patients ayant une tumeur exclue, l’absence de la protéine LRRC15 dans les CAF pourrait être un indicateur d’éligibilité aux ICIs dans l’ADKP [
9
].
 | Figure 1.
Représentation des trois phénotypes tumoraux avec un focus sur le marqueur LRRC15 dans les tumeurs exclues.
CAF : fibroblaste associé au carcinome ; Treg : lymphocyte T régulateur ; TGF-β :
transforming growth factor beta
; IL1-β : interleukine 1-beta ; LRRC15 :
leucine-rich repeat-containing 15
(figure réalisée avec Biorender).
|
|
L’analyse transcriptomique spatiale, un nouvel outil en complément du scRNAseq Néanmoins, la technique de scRNAseq utilisée dans cette étude ne permet pas d’aborder la problématique de la localisation des cellules immunitaires dans la tumeur, qui semble être un facteur essentiel à la réponse ou la résistance aux immunothérapies dans les ADPK. Une analyse spatiale du microenvironnement tumoral de l’ADKP semble alors être indispensable pour déterminer des biomarqueurs de réponse aux immunothérapies dans ce type de cancer.
L’analyse transcriptomique spatiale permet d’analyser les transcriptomes de cellules en gardant l’information de leur localisation. L’échantillon congelé ou inclus en paraffine est déposé sur une plaque divisée en plusieurs spots. Chaque spot contient des amorces ARN auxquelles est associé un code-barre référençant la localisation de ce spot. Ainsi, chaque spot est caractérisé par une information spatiale et transcriptomique [
10
]. Cependant, la résolution de cette technique ne permet pas la capture de l’information transcriptomique à l’échelle de la cellule unique comme le scRNAseq, mais permet celle de spots contenant 10 à 200 cellules en fonction du tissu analysé.
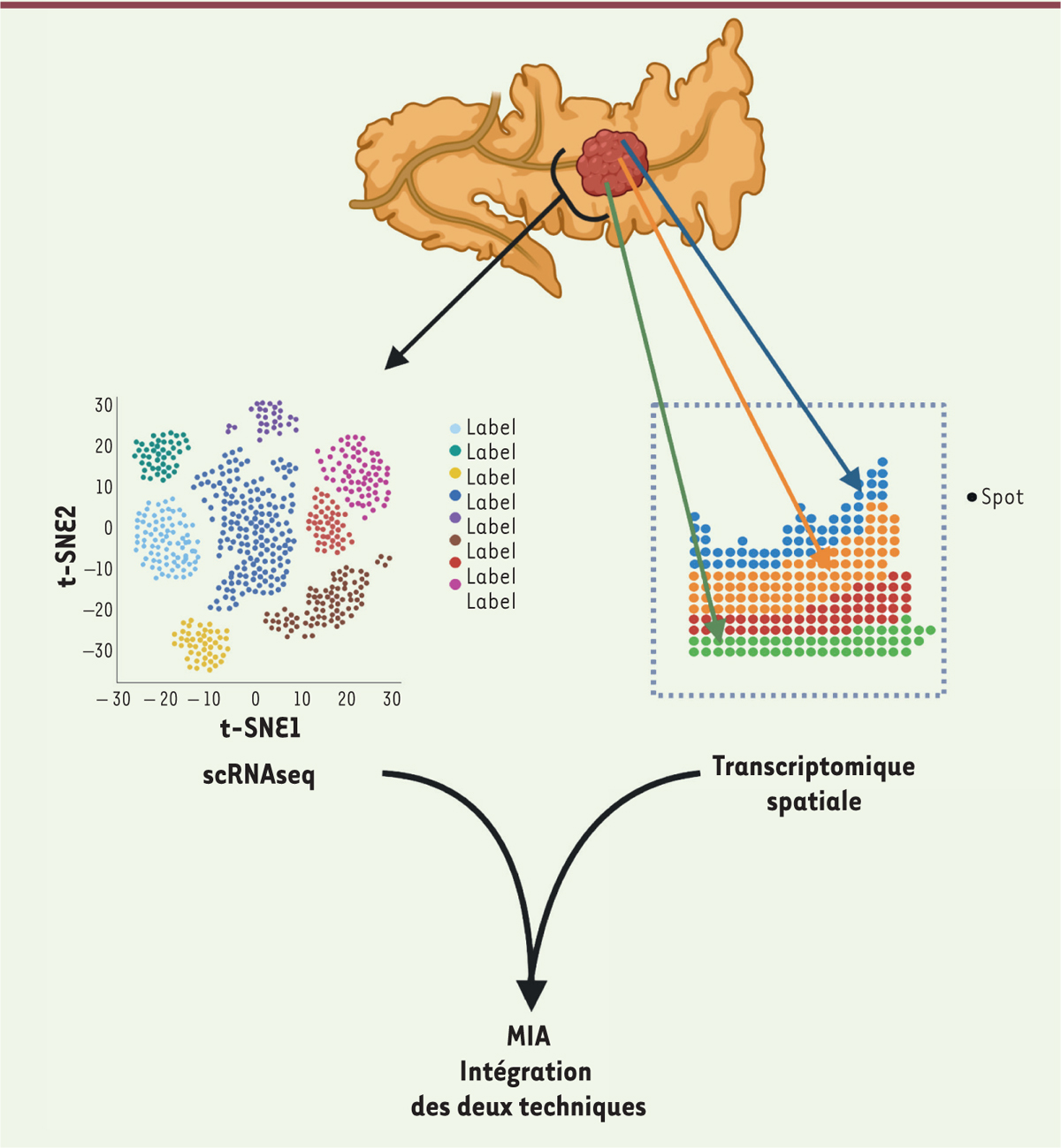
Dans une étude récente, Moncada et
al
. ont donc combiné la technique de scRNAseq et d’analyse transcriptomique spatiale, pour réaliser une étude intégrative du microenvironnement de l’ADKP qu’ils ont surnommée MIA (analyse des intersections multimodales) (
Figure 2
) [
11
]. D’une part, cette analyse prend en compte l’enrichissement dans l’expression de gènes d’un type cellulaire spécifique par rapport aux autres types cellulaires par scRNAseq. D’autre part, elle prend en compte l’enrichissement des gènes les plus exprimés dans une région par rapport aux autres par l’analyse transcriptomique spatiale. La MIA fait ensuite la combinaison des deux analyses, ce qui permet de voir la localisation des types cellulaires détectés par le scRNAseq. Ces auteurs ont ainsi pu mettre en évidence qu’une sous-population particulière de fibroblastes pro-inflammatoires (dont pourrait faire partie la population de CAFs exprimant LRRC15 caractérisée dans l’étude décrite précédemment) se situait à proximité de cellules tumorales exprimant des gènes liés à la réponse au stress [
11
]. Ainsi, au-delà de la caractérisation des profils pro-inflammatoires de différentes sous-populations de fibroblastes par scRNAseq, la technique de MIA permet de localiser ces sous-populations dans l’environnement tumoral et potentiellement de les associer à un profil d’expression génique particulier des cellules tumorales voisines. Ainsi, l’utilisation de cette technique chez des patients résistants ou non aux ICI permettrait d’affiner la prédiction de la réponse aux immunothérapies et d’identifier de nouvelles cibles thérapeutiques afin de proposer des thérapies combinées et améliorer la prise en charge des patients avec un très faible taux de survie.
 | Figure 2.
Représentation schématique de l’intégration du scRNAseq et de l’analyse transcriptomique spatiale au sein de l’analyse MIA (analyse des intersections multimodales).
scRNAseq : analyse des séquences d’ARN en cellules uniques (figure réalisée avec Biorender).
|
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Sung
H
,
Ferlay
J
,
Siegel
RL
,
et al
.
Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries.
.
CA Cancer J Clin
.
2021;
;
71
:
:209.
–
49
.
2.
Zeng
S
,
Pöttler
M
,
Lan
B
,
et al.
Chemoresistance in Pancreatic Cancer.
.
Int J Mol Sci
.
2019;
;
20
:
:4504.
.
3.
Hodi
FS
,
O’Day
SJ
,
McDermott
DF
,
et al.
Improved Survival with Ipilimumab in Patients with Metastatic Melanoma.
.
N Engl J Med
.
2010;
;
363
:
:711.
–
723
.
4.
Royal
RE
,
Levy
C
,
Turner
K
,
et al.
Phase 2 Trial of Single Agent Ipilimumab (Anti-CTLA-4) for Locally Advanced or Metastatic Pancreatic Adenocarcinoma.
.
J Immunother
.
2010;
;
33
:
:828.
–
833
.
5.
O’Reilly
EM
,
Oh
D-Y
,
Dhani
N
,
et al.
Durvalumab With or Without Tremelimumab for Patients With Metastatic Pancreatic Ductal Adenocarcinoma.
.
JAMA Oncol
.
2019;
;
5
:
:1431.
–
1438
.
6.
Herbst
RS
,
Soria
J-C
,
Kowanetz
M
,
et al.
Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients.
.
Nature
.
2014;
;
515
:
:563.
–
567
.
7.
Liu
Y-T
,
Sun
Z-J
.
Turning cold tumors into hot tumors by improving T-cell infiltration.
.
Theranostics
.
2021;
;
11
:
:5365.
–
86
.
8.
Balachandran
VP
,
Łuksza
M
,
Zhao
JN
,
et al.
Identification of unique neoantigen qualities in long term pancreatic cancer survivors.
.
Nature
.
2017;
;
551
:
:512.
–
516
.
9.
Dominguez
CX
,
Müller
S
,
Keerthivasan
S
,
et al
.
Single-Cell RNA Sequencing Reveals Stromal Evolution into LRRC15+ Myofibroblasts as a Determinant of Patient Response to Cancer Immunotherapy.
.
Cancer Discov
.
2020;
;
10
:
:232.
–
53
.
10.
Ståhl
PL
,
Salmén
F
,
Vickovic
S
,
et al.
Visualization and analysis of gene expression in tissue sections by spatial transcriptomics.
.
Science
.
2016;
;
353
:
:78.
–
82
.
11.
Moncada
R
,
Barkley
D
,
Wagner
F
,
et al
.
Integrating microarray-based spatial transcriptomics and single-cell RNA-seq reveals tissue architecture in pancreatic ductal adenocarcinomas.
.
Nat Biotechnol
.
2020;
;
38
:
:333.
–
42
.
|