| |
| Med Sci (Paris). 39(11): 893–895. doi: 10.1051/medsci/2023127.L’inflammasome NLRP1 : un nouveau senseur cytosolique de virus Sarah Moran Y. Rodriguez1* and Virginie Petrilli2** 1Université Claude Bernard Lyon 1. Master biologie du cancer
,
Lyon
,
France 2Cancer Research Centre of Lyon, Inserm 1052, CNRS 5286, centre Léon Bérard, université de Lyon, université Claude Bernard Lyon 1
,
Lyon
,
France MeSH keywords: Humains, Inflammasomes, Protéines adaptatrices de la transduction du signal, Transduction du signal, Protéines NLR, métabolisme |
Les cellules du système immunitaire inné sont dotées de différents récepteurs, appelés PRR (pour pattern recognition receptors), qui leur permettent de détecter des motifs présents sur les pathogènes, ou PAMP (
pathogen-associated molecular pattern
), et des signaux de danger, ou DAMP (
danger-associated molecular pattern
), afin d’induire une réponse inflammatoire indispensable au retour à l’homéostasie [
1
]. Ces PRR sont localisés dans différents compartiments cellulaires, notamment au niveau des membranes cellulaires et dans le cytosol. Parmi les PRR cytosoliques se trouvent les NLRP (
nod-like receptor pyrin domain-containing
) qui, lorsqu’ils détectent des PAMP ou des DAMP, forment une structure multimérique, appelée inflammasome, constituée de la protéine adaptatrice ASC (
apoptosis-associated speck-like protein containing a CARD [caspase recruitement domain]
) et d’un effecteur, l’enzyme caspase-1 [
2
,
3
] (
→
).
(→) Voir la Synthèse de Y. Jamilloux et T. Henry,
m/s
n° 11, novembre 2013, page 975
Activée, la caspase-1 clive différents substrats : des cytokines pro-inflammatoires, la proIL-1β (pro-interleukine 1β) et la proIL-18, générant ainsi l’IL-1β et l’IL-18, ainsi que la gasdermine-D (GSDMD). La libération du fragment N-terminal de la GSDMD permet son oligomérisation et son insertion dans la membrane plasmique sous la forme de pores, conduisant à une mort lytique des cellules, appelée pyroptose.
Les NLRP sont des protéines clés de l’immunité. L’hyperactivation de l’inflammasome NLRP3 par les cristaux d’acide urique, ou des mutations du gène codant NLRP3, sont en effet responsables de maladies autoinflammatoires, respectivement, la maladie de la goutte ou des cryopyrinopathies [
4
,
5
]. Des mutations du gène codant NLRP1 sont également responsables de certaines maladies auto-immunes, comme le vitiligo [
6
].
Historiquement, le NLRP1 humain fut le premier des NLRP décrit comme étant impliqué dans la formation d’un inflammasome [
2
]. Chez l’homme, un seul gène code NLRP1. Chez la souris, en revanche, trois paralogues,
Nlpr1a,b,c
, sont exprimés différemment selon les fonds génétiques des souris [
7
]. Le premier activateur de NLRP1 découvert a été celui du NLRP1b murin. Il s’agit de la toxine létale de l’anthrax qui active NLRP1b par le clivage de son extrémité N-terminale, induisant la formation de l’inflammasome [
8
]. Cependant, la découverte des PAMPs et mécanismes moléculaires conduisant à l’activation de NLRP1 humain n’est que très récente.
|
Structure de NLRP1
Les NLRP possèdent trois domaines : un domaine N-terminal appelé PYD (
pyrin domain
) ; un domaine central NACHT (domaine présent dans les protéines
NAIP, CIITA, HET-E and TP1
), permettant l’oligomérisation de NLRP1 ; suivi d’un domaine LRR (
leucine-rich repeat
), un motif impliqué dans la reconnaissance des PAMP et des DAMP [
2
]. À la différence des autres NLRP, le NLRP1 humain possède deux autres domaines, en C-terminal : un domaine FIIND (
function-to-find domain
) et un domaine CARD (
caspase recruitement domain)
. C’est ce domaine CARD qui recrute la caspase-1 et interagit avec la protéine adaptatrice ASC pour amplifier l’oligomérisation et l’activation de la caspase-1.
L’auto-protéolyse de NLRP1
La présence du domaine FIIND confère une particularité à NLRP1. En effet, ce domaine contient deux régions appelées UPA (domaine retrouvé dans les protéines
UNC5, PIDD and Ankirin
) et ZU5 (domaine trouvé dans les protéines
ZO-1 and UNC5)
entre lesquelles se trouvent une séquence SF/S (sérine
1211
, phénylalaline
1212
, sérine
1213
) conduisant à l’auto-protéolyse de NLRP1, du fait de l’attaque nucléophile de la sérine 1213 sur la liaison peptidique scissile [
9
]. Il en résulte deux fragments, dont l’un contient principalement le domaine CARD, nécessaire à l’assemblage de l’inflammasome. Dans le génome, le gène CARD8 code une protéine qui ressemble à la partie C-terminale de NLRP1. Cette protéine qui est composée uniquement des domaines UPA, ZU5 et CARD [
9
,
10
], contient également une séquence SF
296
/S
297
conduisant à la libération du domaine CARD, et est capable de former un inflammasome. Les deux fragments de NLRP1 libérés restent néanmoins associés de façon non covalente pour maintenir une auto-inhibition de la protéine. Cette inhibition est maintenue par les DPP(
dipeptidyl peptidases
) 8 et 9 intracellulaires, prévenant la formation spontanée du complexe de l’inflammasome (
Figure 1A
) [
11
,
12
]. L’inhibition de ces peptidases par le Val-boro-Pro (VbP, aussi connu sous le nom de talabostat, un agent anti-néoplasique) provoque la libération du fragment contenant le domaine CARD qui peut alors s’oligomériser, et recruter la caspase-1 pour induire la formation de l’inflammasome NLRP1.
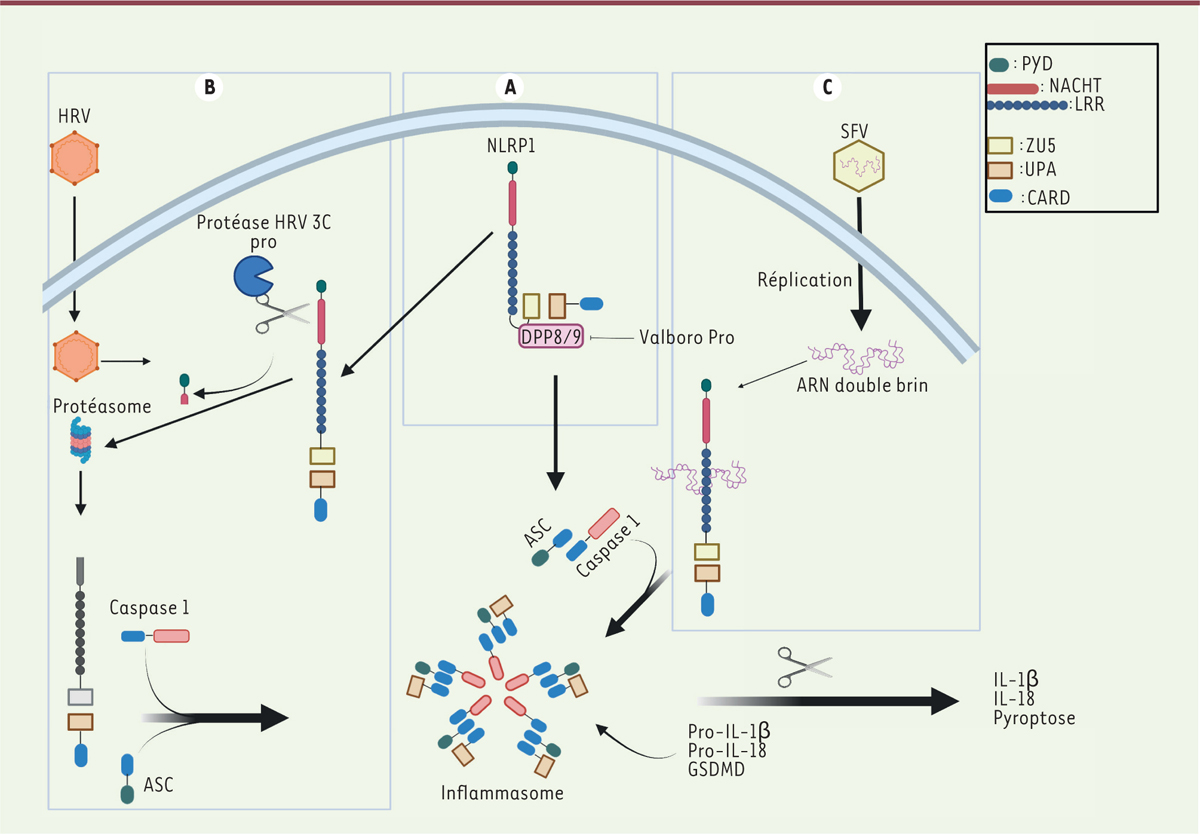
 | Figure 1.
Schéma représentant l’activation de NLRP1 et la formation de l’inflammasome après activation par les rinovirus (HRV) ou le Semliki Forrest virus (SFV). A.
NLRP1 est composé d’un domaine PYD suivi du domaine central NACHT puis des domaines ZU5, UPA et CARD. La présence d’une séquence SF
1212
/S
1213
entre les domaines ZU5 et UPA induit l’autoprotéolyse de la protéine, et les fragments générés sont maintenus dans une conformation inactive par les DDP8/9. Le Val-boro-Pro, en inhibant les DPP8/9, conduit à la formation de l’inflammasome NLRP1.
B.
Activation de l’inflammasome par la protéine 3C du HRV. La libération de la protéase 3C lors de la phase de réplication du virus clive la partie N-terminale de NLRP1, ce qui conduit à la dégradation de cette partie N-terminale. Le fragment libre UPA-CARD de NLRP1 s’oligomérise, recrute ASC et la caspase-1 pour former l’inflammasome.
C.
Activation de l’inflammasome par l’ARN réplicatif du SFV. La réplication du virus SFV induit sa détection par NLRP1 et, en conséquence, la formation de l’inflammasome. L’assemblage de l’inflammasome conduit à l’activation de la caspase-1 et au clivage de ses substrats proIL-1β, proIL-18 et GSDMD. Le clivage de cette dernière induit la pyroptose et la sécrétion des formes actives d’IL-1β et IL-18. PYD :
pyrin domain
; NACHT: domaine présent dans les protéines NAIP, CIITA, HET-E and TP1 ; LRR :
leucine-rich repeat
; CARD :
caspase recruitement domain
; UPA : domaine trouvé dans les protéines UNC5, PIDD et Ankirine ; ZU5 : domaine trouvé dans les protéines ZO-1 et UNC (figure conçue avec Biorender.com).
|
|
L’inflammasome NLRP1 détecte des PAMP viraux Depuis la description du premier inflammasome, il aura fallu presque 20 ans pour identifier les PAMP que détecte NLRP1. Plusieurs études ont, ces deux dernières années, révélé que, dans les cellules épithéliales, NLRP1 était activé par les virus, selon deux mécanismes distincts. Activation par les protéases virales
Les équipes de Reversade et de Daugherty ont en effet montré que la protéase 3C (3Cpro) de certains picornavirus activait NLRP1, par clivage [
13
,
14
]. Cette protéase est nécessaire au virus pour couper le polypeptide synthétisé à partir de l’ARN viral et libérer les protéines virales. Lors de l’infection d’une cellule épithéliale pulmonaire par le rhinovirus humain (HRV), 3Cpro clive NLRP1, entre la glutamine 130 et la glycine 131. Ce clivage retire le domaine PYD de la protéine et révèle un module N-dégron
1,
sur NLRP1, conduisant à la dégradation de la partie N-terminale de la protéine par le protéasome jusqu’au site d’autoclivage (
Figure 1B
). Ceci aboutit à la libération du peptide contenant le domaine CARD et à la formation de l’inflammasome [
13
,
14
].
De même, l’équipe du Dr Meunier a montré que les coronavirus, notamment le SARS-CoV-2, libérait la protéase 3CL NSP5 capable de cliver NLRP1 au niveau de la glutamine 333, conduisant également à la dégradation du fragment N-terminal et à l’assemblage de l’inflammasome, et donc à la sécrétion de cytokines proinflammatoires ainsi qu’à la pyroptose [
15
].
Activation par l’ARN double brin
Dans les cellules de type épithélial, l’équipe du Dr Hornung a identifié un mécanisme différent d’activation de NLRP1 par un virus. NLRP1 est activé par le poly(I:C), un ARN double brin synthétique, mais aussi par le
Semliki forest virus
(SFV), un virus à ARN simple brin de polarité positive lors de son stade réplicatif, c’est-à-dire lorsqu’il est sous forme double brin [
16
]. Le motif LRR de NLRP1 interagit avec l’ARN double brin, et induit la libération du fragment UPA-CARD, et ainsi la formation de l’inflammasome (
Figure 1C
).
|
Bien qu’il ait été initialement décrit que les rayons UVB activent le NLRP1 humain dans les kératinocytes sans que les mécanismes moléculaires associés n’aient été déterminés, les signaux et mécanismes activateurs de NLRP1 sont restés longtemps énigmatiques [
17
]. Récemment, plusieurs travaux ont révélé que l’inflammasome NLRP1 joue un rôle central dans l’activation de l’immunité inné au niveau de la barrière épithéliale. Mais contrairement à l’inflammasome NLRP3, l’inflammasome NLRP1 ne nécessite pas d’étape de «
priming
» pour son activation. Elle dépend en effet de son auto-protéolyse. La découverte de son clivage par les protéases virales de certains picornavirus ou du SARS-CoV-2, et de son activation par les ARN double brins viraux, ont constitué des avancées majeures dans la compréhension des mécanismes de détection des agents pathogènes par les cellules épithéliales. Le rôle physiopathologique de NLRP1 émerge et une meilleure compréhension des voies moléculaires conduisant à son activation pourrait ouvrir de nouvelles opportunités de ciblage thérapeutique. Ce domaine d’étude est en pleine émergence, et il est fort probable que NLRP1 n’ait pas encore délivré tous ses secrets.
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Murphy
K
,
Janeway
CA
.
Janeway’s immunobiology.
. In:
Weaver
C
,
Berg
L
,
editors
.
Janeway’s immunobiology
. (10th edition)
.
10th edition.
.
New York, NY:
:
W.W. Norton and Company;
,
2022
: Chap 3, p. 79.
2.
Martinon
F
,
Burns
K
,
Tschopp
J
.
The Inflammasome: A Molecular Platform Triggering Activation of Inflammatory Caspases and Processing of proIL-β.
.
Molecular Cell
.
2002;
;
10
:
:417.
–
426
.
3.
Jamilloux
Y
,
Henry
T
.
Les inflammasomes - Plates-formes de l’immunité innée.
.
Med Sci (Paris)
.
2013;
;
29
:
:975.
–
984
.
4.
Pétrilli
V
,
Martinon
F
.
The inflammasome, autoinflammatory diseases, and gout.
.
Joint Bone Spine
.
2007;
;
74
:
:571.
–
576
.
5.
Aganna
E
,
Martinon
F
,
Hawkins
PN
,
et al.
Association of mutations in the NALP3/CIAS1/PYPAF1 gene with a broad phenotype including recurrent fever, cold sensitivity, sensorineural deafness, and AA amyloidosis.
.
Arthritis & Rheumatism
.
2002;
;
46
:
:2445.
–
2452
.
6.
Jin
Y
,
Mailloux
CM
,
Gowan
K
,
et al.
NALP1 in Vitiligo-Associated Multiple Autoimmune Disease.
.
N Engl J Med
.
2007;
;
356
:
:1216.
–
1225
.
7.
Boyden
ED
,
Dietrich
WF
.
Nalp1b controls mouse macrophage susceptibility to anthrax lethal toxin.
.
Nat Genet
.
2006;
;
38
:
:240.
–
244
.
8.
Frew
BC
,
Joag
VR
,
Mogridge
J
.
Proteolytic Processing of Nlrp1b Is Required for Inflammasome Activity.
.
PLoS Pathog
.
2012;
;
8
:
:e1002659.
.
9.
D’Osualdo
A
,
Weichenberger
CX
,
Wagner
RN
,
et al.
CARD8 and NLRP1 undergo autoproteolytic processing through a ZU5-like domain.
.
PLoS One
.
2011;
;
6
:
:e27396.
.
10.
Johnson
DC
,
Okondo
MC
,
Orth
EL
,
et al
.
DPP8/9 inhibitors activate the CARD8 inflammasome in resting lymphocytes.
.
Cell Death Dis
.
2020;
;
11
:
:628.
.
11.
Okondo
MC
,
Johnson
DC
,
Sridharan
R
,
et al.
DPP8 and DPP9 inhibition induces pro-caspase-1-dependent monocyte and macrophage pyroptosis.
.
Nat Chem Biol
.
2017;
;
13
:
:46.
–
53
.
12.
Zhong
FL
,
Robinson
K
,
Teo
DET
,
et al.
Human DPP9 represses NLRP1 inflammasome and protects against autoinflammatory diseases via both peptidase activity and FIIND domain binding.
.
J Biol Chem
.
2018;
;
293
:
:18864.
–
18878
.
13.
Robinson
KS
,
Teo
DET
,
Tan
KS
,
et al
.
Enteroviral 3C protease activates the human NLRP1 inflammasome in airway epithelia.
.
Science
.
2020;
;
370
:
:eaay2002.
.
14.
Tsu
BV
,
Beierschmitt
C
,
Ryan
AP
,
et al
.
Diverse viral proteases activate the NLRP1 inflammasome.
.
Elife
.
2021;
;
10
:
:e60609.
.
15.
Planès
R
,
Pinilla
M
,
Santoni
K
,
et al
.
Human NLRP1 is a sensor of pathogenic coronavirus 3CL proteases in lung epithelial cells.
.
Mol Cell
.
2022;
;
82
:
:2385.
–
400.e9
.
16.
Bauernfried
S
,
Scherr
MJ
,
Pichlmair
A
,
et al
.
Human NLRP1 is a sensor for double-stranded RNA.
.
Science
.
2021;
;
371
:
:eabd0811.
.
17.
Watanabe
H
,
Gaide
O
,
Pétrilli
V
,
et al.
Activation of the IL-1β-Processing Inflammasome Is Involved in Contact Hypersensitivity.
.
J Invest Dermatol
.
2007;
;
127
:
:1956.
–
1963
.
|