| |
| Med Sci (Paris). 39(11): 889–892. doi: 10.1051/medsci/2023126.Thérapies ciblées et immunothérapies dans le mélanome Une approche temporelle pour une réponse optimale Nicolas Braissand1* and Isabelle Coste2** 1Master 2 Biologie du cancer, ISPB, université Claude Bernard Lyon 1
,
France 2Université Lyon, université Claude Bernard Lyon 1, Inserm 1052, CNRS 5286, centre Léon Bérard, centre de recherche en cancérologie de Lyon
,
Lyon
,
69008
,
France |
Module d’immunologie virologie et cancer du Master de cancérologie de Lyon
Série coordonnée par Sophie Sibéril.
Le mélanome est un cancer de la peau relativement rare et particulièrement agressif. Il est le cancer présentant la plus importante augmentation d’incidence au cours des dernières décennies, affectant en 2019, plus de 150 000 personnes en Europe [
1
]. Il constitue de loin la cause majoritaire de mortalité liée aux cancers de la peau : si les stades précoces du mélanome sont facilement curables (avec un taux de survie à 5 ans de 99 %), les stades avancés sont dramatiquement plus fatals, présentant un taux de survie à 5 ans de 20 % pour les mélanomes métastatiques [
2
].
Jusqu’en 2011, les traitements étaient principalement restreints à des thérapies dites « classiques » : la chirurgie, pour les mélanomes localisés, et la chimiothérapie. Toutefois, depuis un peu plus d’une décennie, la disponibilité sur le marché de plusieurs nouveaux traitements a permis d’améliorer considérablement la survie des malades présentant des stades avancés.
Les études menées sur les mutations génétiques prévalentes et sur l’infiltrat de cellules immunitaires dans les mélanomes ont en effet permis de diriger la recherche vers le développement de nouvelles thérapies, en particulier les thérapies ciblées et les immunothérapies. Ces traitements ont montré des résultats encourageants, en monothérapie et en combinaison. Néanmoins, des phénomènes de résistance et de «
cross-resistance »
(par lesquels les cellules deviennent résistantes non seulement au traitement administré, mais aussi à d’autres types de thérapies) ont rapidement émergé et ont révélé la nécessité d’une réflexion approfondie sur la fenêtre temporelle d’administration de ces médicaments.
|
Les inhibiteurs de la voie des MAP kinases (MAPKi)
Les thérapies ciblées visent à inhiber de manière spécifique un acteur majeur dans une voie de signalisation souvent dérégulée dans les cellules tumorales. La voie de signalisation des MAPK (
mitogen-activated protein kinases
) est d’un intérêt particulier dans les mélanomes, dans lesquels l’oncogène BRAF (
v-raf murine sarcoma viral oncogene homolog B1
) est muté dans plus de 50 % des cas [
3
]. La mutation de ce gène, codant une sérine/thréonine kinase, peut entraîner une activation aberrante de la voie des MAPK conduisant notamment à une prolifération incontrôlée des cellules tumorales [
4
]. De nombreux essais cliniques visant à cibler un ou plusieurs acteurs de cette voie ont mis en évidence une régression significative et rapide des tumeurs, en comparaison avec des thérapies classiques [
5
].
Actuellement, les inhibiteurs utilisés ciblent deux acteurs de la voie [
4
] : BRAF et MEK (
mitogen-activated protein kinase kinase
ou
MAP/ERK kinase
), une MAPK kinase située en aval de BRAF (
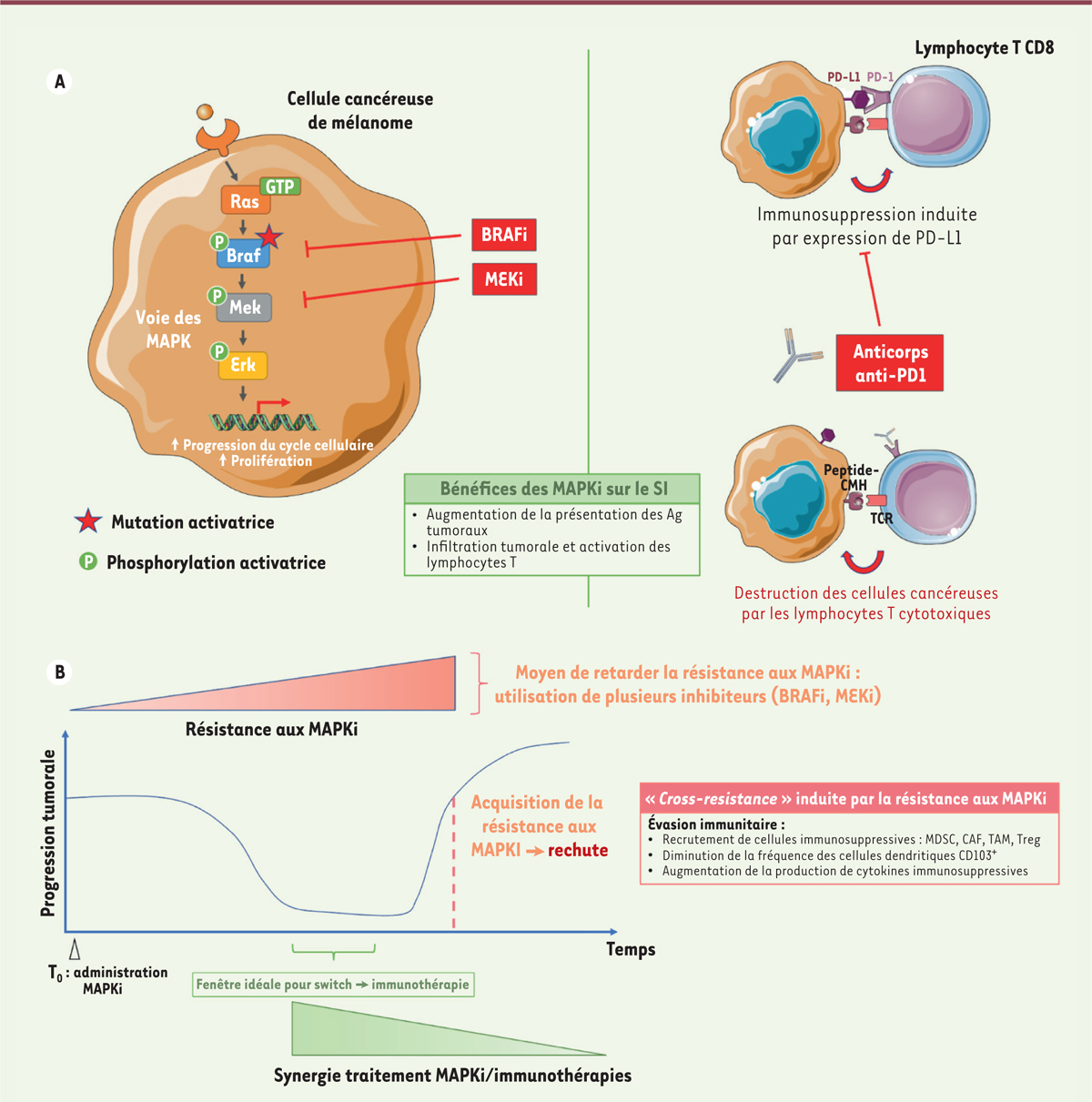
Figure 1A
). Les inhibiteurs de BRAF (ou BRAFi) sont dits « sélectifs » car ils ciblent directement la protéine BRAF mutée, sans altérer la protéine « sauvage », entraînant ainsi une altération de la voie spécifiquement dans les cellules cancéreuses mutées. Les monothérapies à base d’inhibiteurs de MEK (MEKi) se sont révélées plus efficaces que la chimiothérapie [
5
], et, par la suite, leur association avec les BRAFi a montré une synergie importante, sans entraîner de toxicité additionnelle [
6
]. Malgré des réponses remarquables aux MAPKi, le développement d’une résistance au traitement, après quelques mois, entraîne une rechute chez la majorité des patients – la survie sans progression à trois ans n’est que d’environ 20 % après le traitement combiné MEKi + BRAFi [
7
].
 | Figure 1.
Thérapies ciblées et immunothérapies : modes d’action, synergie et temporalité.
Les inhibiteurs des MAPK (
A
, à gauche) bloquent l’activation constitutive de la voie des MAP-kinases ; ils réduisent ainsi la prolifération des cellules cancéreuses, et, en parallèle, induisent un microenvironnement tumoral plus favorable à l’action des immunothérapies (
A
, à droite). Toutefois, les cellules tumorales vont peu à peu acquérir une résistance aux MAPKi : la forte réponse antitumorale obtenue est donc, chez la plupart des patients, suivie d’une rechute, qui s’accompagne de surcroît d’une «
cross-resistance
» vis-à-vis des immunothérapies (
B
). Il apparaît dès lors crucial d’envisager une approche temporelle pour l’administration de ces deux thérapies afin d’administrer un traitement MAPKi sans nuire à l’action des immunothérapies, et ainsi obtenir une synergie optimale et une meilleure survie pour les patients présenant des mélanomes métastatiques (figure réalisée en partie avec
Servier Medical Art
, fourni par Servier, sous licence
Creative Commons Attribution 3.0 Unported license
).
|
Deux hypothèses principales ont été posées pour expliquer ces mécanismes de résistance [
5
] : 1) la réactivation de la voie des MAPK à travers des mutations secondaires d’autres acteurs de cette même voie ; et 2) une potentielle activation alternative d’autres voies de signalisation oncogéniques. Un enjeu majeur est donc de trouver un moyen de lutter contre ces résistances pour continuer à contrôler le développement tumoral.
|
La stimulation du système immunitaire par l’immunothérapie
Récemment, les immunothérapies visant à stimuler le système immunitaire, souvent altéré dans le microenvironnement tumoral, sont devenues une option thérapeutique afin d’obtenir une réponse durable chez les patients présenant des mélanomes. Plusieurs anticorps monoclonaux (AcM) thérapeutiques ciblant notamment les points de contrôle immunitaire inhibiteurs CTLA-4 (
cytotoxic lymphocyte associated protein-4
) et PD-1 (
programmed cell death protein 1
) sont actuellement utilisés en clinique pour le traitement du mélanome [
5
]. Ces molécules dites points de contrôle immunitaire sont exprimés de façon homéostatique à la surface des cellules immunitaires et servent principalement à réguler l’activité du système immunitaire. Toutefois, les cellules cancéreuses, en exprimant les ligands de ces molécules, sont capables de détourner ces mécanismes de régulation afin d’échapper à la réponse immunitaire anti-tumorale. Les AcM ciblant CTLA-4 ou l’interaction PD-1/PD-L1 (le ligand de PD-1) permettent ainsi de restaurer la réponse du système immunitaire contre la tumeur (
Figure 1A
), induisant de remarquables bénéfices cliniques [
8
].
Les inhibiteurs de CTLA-4 ont été les premiers de cette famille d’AcM anti-points de contrôle immunitaire à obtenir une autorisation de mise sur le marché pour le traitement du mélanome métastatique. Bien que ce type de traitement ait démontré un effet bénéfique remarquable sur la survie globale dans ce contexte pathologique, les observations cliniques ont révélé que seuls 10 à 20 % des patients présentent des réponses objectives [
5
], mettant en évidence la nécessité d’avoir également recours à d’autres immunothérapies. Les AcM anti-PD-1, notamment, développés plus récemment, sont associés à une meilleure efficacité (taux de réponse allant de 20 à 40 %) et à une réduction des effets secondaires [
8
]. Enfin, la combinaison des deux monothérapies AcM anti-PD-1 et AcM anti-CTLA-4 s’est montrée plus efficace dans plusieurs essais cliniques (taux de réponse globale supérieur à 50 %), mais elle est associée à une toxicité plus importante chez les patients.
Sur la base de ces données cliniques, identifier des biomarqueurs prédictifs de l’efficacité des immunothérapies chez les patients traités est devenu crucial. Parmi ces biomarqueurs, la charge mutationnelle tumorale, l’infiltration tumorale en lymphocytes T (LT), la présence de structures lymphoïdes tertiaires [
9
] et l’expression par les cellules cancéreuses du ligand PD-L1 (bien que controversée à ce jour [
8
]), sont des facteurs pouvant avoir un impact sur la réponse aux immunothérapies.
|
Le rationnel de la combinaison MAPKi et immunothérapie Ainsi, d’une part, l’administration de thérapies ciblées induit de fortes réponses chez la majorité des patients, mais qui sont souvent suivies par des rechutes et, d’autre part, les immunothérapies peuvent induire un effet antitumoral à long terme mais qui concerne seulement un sous-groupe de patients. Ces différents constats ont amené les chercheurs à envisager une administration conjointe de ces deux médicaments comme stratégie thérapeutique pour améliorer la survie globale des patients.
Les résultats cliniques obtenus avec les MAPKi et les immunothérapies ont également suggéré une potentielle complémentarité des deux types de traitements. Cette complémentarité s’explique notamment par le fait que les thérapies ciblées MAPKi modulent également la réponse immunitaire en améliorant l’infiltration et l’activation des LT CD8 spécifiques d’antigènes tumoraux et en augmentant l’expression du ligand PD-L1 et d’antigènes tumoraux à la surface des cellules du mélanome [
10
,
11
], rendant le système immunitaire potentiellement plus sensible à l’action de l’immunothérapie. De plus, le microenvironnement tumoral immunosuppressif est altéré par les BRAFi à travers l’inhibition de cellules immunosuppressives (LT régulateurs, fibroblastes associés au cancer) [
12
].
Les tests cliniques combinant les deux traitements ont conduit à des résultats prometteurs [
13
]. Toutefois, contrairement à ce qui avait été suggéré dans l’étude mentionnée plus haut montrant un effet bénéfique des MAPKi sur le système immunitaire [
10
], la résistance acquise contre les MAPKi évoquée précédemment est également associée à une moins bonne réponse aux immunothérapies [
14
] (ce phénomène étant appelé «
cross-resistance
»), laissant envisager un effet immunosuppressif des MAPKi - en contradiction avec les effets positifs sur le système immunitaire. La fenêtre temporelle pourrait expliquer cette contradiction. En effet, l’acquisition de la résistance aux MAPKi entraînerait également un remodelage secondaire du microenvironnement tumoral qui deviendrait alors moins sensible aux immunothérapies (
Figure 1B
). Ainsi, Haas
et al.
[
14
] ont récemment démontré
in vivo
, dans un modèle de mélanome BRAF muté, que cette «
cross-resistance
» pourrait impliquer les cellules cancéreuses qui, par la réactivation de la voie des MAPK, modifient le microenvironnement tumoral et induisent un contexte immunosuppressif. Ce mécanisme de résistance des cellules tumorales au traitement par MAPKi est en particulier associé à un déficit de cellules dendritiques CD103
+
dans le microenvironnement tumoral, cellules présentatrices d’antigènes importantes pour la mise en place de la réponse des LT cytotoxiques. Clairement, l’absence ou l’altération de la réponse des LT, cellules stimulées par les immunothérapies, réduit drastiquement l’action de ce type de traitements. Les résultats de Haas
et al.
suggèrent que, pour contrecarrer ce problème, le traitement des mélanomes avancés pourrait être l’administration de MAPKi comme thérapie à court terme dans le but d’induire une forte réponse antitumorale et de potentialiser l’infiltration immunitaire, suivie par l’immunothérapie qui fonctionnerait ainsi de manière optimale avant l’acquisition de la résistance aux MAPKi. Des essais cliniques en cours [
15
] s’intéressent d’ailleurs à la fenêtre temporelle assurant la meilleure synergie entre les deux thérapies. Enfin, la restauration d’un compartiment immunitaire fonctionnel dans le microenvironnement tumoral est une stratégie de plus en plus envisagée pour les patients ayant déjà acquis une «
cross-resistance
», permettant de les rendre de nouveau sensibles aux immunothérapies.
|
Il ressort de ces études que, malgré la forte synergie observée lors de la combinaison des traitements à base de MAPKi et d’immunothérapies dans la prise en charge thérapeutique du mélanome avancé, l’acquisition d’une résistance vis-à-vis des thérapies ciblées peut fortement compromettre la mise en place d’une réponse durable chez la plupart des patients lors de la combinaison de ces deux traitements. Bien que cette hypothèse doit être confirmée par de futurs essais cliniques, il semblerait que les patients doivent bénéficier de l’immunothérapie avant la mise en place de la résistance aux thérapies ciblées administrées en amont. Dès lors, une surveillance accrue des patients devient nécessaire et des biomarqueurs sont à valider pour évaluer l’évolution biologique suite au traitement par MAPKi : cela permettrait de cibler et de personnaliser la fenêtre idéale de traitement, chez chaque patient. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
The International Agency for Research on Cancer (IARC).
.
Global Cancer Observatory
.
,
2020
.
2.
Siegel
RL
,
Miller
KD
,
Jemal
A
.
Cancer statistics.
.
CA Cancer J Clin
.
2018;
;
68
:
:7.
–
30
.
3.
The Cancer Genome Atlas Network.
.
Genomic Classification of Cutaneous Melanoma.
.
Cell
.
2015;
;
161
:
:1681.
–
1696
.
4.
Samatar
AA
,
Poulikakos
PI
.
Targeting RAS-ERK signalling in cancer: promises and challenges.
.
Nat Rev Drug Discov
.
2014;
;
13
:
:928.
–
942
.
5.
Yu
C
,
Liu
X
,
Yang
J
et al.
Combination of Immunotherapy With Targeted Therapy: Theory and Practice in Metastatic Melanoma.
.
Front Immunol
.
2019;
;
10
:
:990.
.
6.
Flaherty
KT
,
Infante
JR
,
Daud
A
,
et al.
Combined BRAF and MEK inhibition in melanoma with BRAF V600 mutations.
.
N Engl J Med
.
2012;
;
367
:
:1694.
–
1703
.
7.
Long
GV
,
Weber
JS
,
Infante
JR
,
et al.
Overall Survival and Durable Responses in Patients With BRAF V600-Mutant Metastatic Melanoma Receiving Dabrafenib Combined With Trametinib.
.
J Clin Oncol
.
2016;
;
34
:
:871.
–
878
.
8.
Luke
JJ
,
Flaherty
KT
,
Ribas
A
,
Long
GV
.
Targeted agents and immunotherapies: optimizing outcomes in melanoma.
.
Nat Rev Clin Oncol
.
2017;
;
14
:
:463.
–
482
.
9.
Kalaora
S
,
Nagler
A
,
Wargo
JA
,
Samuels
Y
.
Mechanisms of immune activation and regulation: lessons from melanoma.
.
Nat Rev Cancer
.
2022;
;
22
:
:195.
–
207
.
10.
Sumimoto
H
,
Imabayashi
F
,
Iwata
T
,
Kawakami
Y
.
The BRAF-MAPK signaling pathway is essential for cancer-immune evasion in human melanoma cells.
.
J Exp Med
.
2006;
,
203
;
(7)
:
:1651.
–
1656
.
11.
Frederick
DT
,
Piris
A
,
Cogdill
AP
,
et al.
BRAF inhibition is associated with enhanced melanoma antigen expression and a more favorable tumor microenvironment in patients with metastatic melanoma.
.
Clin Cancer Res
.
2013;
;
19
:
:1225.
–
1231
.
12.
Reddy
SM
,
Reuben
A
,
Wargo
JA
.
Influences of BRAF Inhibitors on the Immune Microenvironment and the Rationale for Combined Molecular and Immune Targeted Therapy.
.
Curr Oncol Rep
.
2016;
;
18
:
:42.
.
13.
Ribas
A
,
Butler
M
,
Lutzky
J
,
et al.
Phase I study combining anti-PD-L1 (MEDI4736) with BRAF (dabrafenib) and/or MEK (trametinib) inhibitors in advanced melanoma.
.
JCO
.
2015;
;
15
:
:3003.
.
14.
Haas
L
,
Elewaut
A
,
Gerard
CL
,
et al
.
Acquired resistance to anti-MAPK targeted therapy confers an immune-evasive tumor microenvironment and cross-resistance to immunotherapy in melanoma.
.
Nat Cancer
.
2021;
;
2
:
:7.
.
15.
Long
GV
,
Carlino
MS
,
Au-Yeung
G
,
et al
.
NeoTrio: Randomized trial of neoadjuvant (NAT) pembrolizumab (Pembro) alone, in sequence (SEQ) with, or concurrent (CON) with dabrafenib plus trametinib (D+T) in resectable BRAF-mutant stage III melanoma to determine optimal combination of therapy.
.
JCO
.
2022;
;
40
:
:9503.
.
|