La maladie de Crigler-Najjar est une maladie héréditaire récessive du foie responsable d’une accumulation, dès la naissance, de bilirubine non conjuguée dans le sang. La bilirubine est un produit de la dégradation de l’hème, qui est contenu dans l’hémoglobine et ne peut être directement réutilisé. Du fait du renouvellement quotidien d’environ 1 % des érythrocytes, de grandes quantités de bilirubine sont produites chaque jour. La bilirubine est un composé très lipophile, qui doit être conjugué à l’acide glucuronique dans le foie pour devenir hydrosoluble et être éliminé dans les urines et les matières fécales. C’est une isoforme de l’enzyme uridine glucuronosyl transférase (UGT), codée par le gène UGT1A1 , qui permet la conjugaison de la bilirubine dans le foie. En l’absence de cette conjugaison, la bilirubine non conjuguée s’accumule dans les tissus lipidiques et en particulier dans les noyaux gris centraux du cerveau. Cette accumulation provoque des désordres neurologiques irréversibles chez les enfants présenant une maladie de Crigler-Najjar, qui sont génétiquement déficients en UGT1A1. Pour empêcher cette redoutable évolution de la maladie, on utilise la photothérapie prolongée (plusieurs heures par jour) en lumière bleue, qui permet de dégrader les molécules de bilirubine à travers la peau. La transplantation hépatique était jusqu’à présent la seule solution curative pour cette maladie.
La maladie de Crigler-Najjar est considérée depuis longtemps comme une maladie modèle pour la thérapie génique, et cela pour plusieurs raisons : 1) il s’agit d’une maladie monogénique, dont le gène responsable est connu, et pour laquelle l’ADN complémentaire (ADNc) du transcrit de ce gène est de petite taille (environ 1,8 kb), ce qui facilite la construction de vecteurs viraux pour son transfert aux cellules à traiter ; 2) au cours de la maladie, la structure histologique du foie reste normale, et les hépatocytes qui doivent être corrigés génétiquement sont viables ; 3) le foie, qui est l’organe à traiter, est facilement accessible par la circulation sanguine du fait du débit sanguin portal important (environ 20 % du débit cardiaque) et de la présence d’un endothélium fenestré dans les sinusoïdes hépatiques, ce qui permet l’extravasation des vecteurs de transfert présents dans le flux sanguin ; 4) le nombre d’hépatocytes qui doivent être corrigés pour avoir un impact clinique est faible, et l’on considère que le traitement de 5 % à 10 % de la masse hépatique permet une amélioration clinique ; 5) enfin, il existe des modèles animaux de la maladie de Crigler-Najjar : le rat Gunn, identifié en 1932, qui reste le modèle animal le plus utilisé, et une souris transgénique générée en 2008 [ 1 ]. Pour toutes ces raisons, les études expérimentales visant à mettre au point une thérapie génique pour la maladie de Crigler Najjar ont commencé il y a près de 30 ans, en particulier à l’Institut Pasteur, dans le laboratoire Rétrovirus et transfert génétique . Les premiers vecteurs viraux de transfert de gènes qui ont été développés à cette époque étaient dérivés des rétrovirus murins, des adénovirus, puis des lentivirus. Ces premières études ont démontré la faisabilité d’un traitement à long terme de l’hyperbilirubinémie chez le rat Gunn [ 2 – 5 ]. Cependant, la nécessite de stimuler les hépatocytes préalablement à la transduction par les rétrovirus, les réponses inflammatoires fortes induites par les adénovirus, et les difficultés de production des lentivirus restaient des obstacles majeurs à la mise au point de cette thérapie génique pour l’homme.
Le développement des vecteurs viraux dérivés du virus adéno-associé (AAV) durant les quinze dernières années a permis une avancée décisive. Ces vecteurs sont plus faciles à produire en grande quantité que les autres vecteurs viraux, et leur administration par voie intraveineuse corrige la maladie dans les modèles animaux de la maladie de Crigler-Najjar [ 6 , 7 ].
Grâce à la constitution d’un consortium international regroupant des cliniciens et des chercheurs français, italiens et hollandais, et sous l’impulsion décisive du Généthon à Évry, un essai clinique évaluant la tolérance et l’efficacité de l’administration intraveineuse d’AAV recombinants (de sérotype 8) véhiculant l’ADNc humain de l’UGT1A1 a pu être réalisé. Les résultats très encourageants de cet essai, qui a duré plus de quatre ans, ont été publiés durant l’été 2023 [ 8 ].
Cet essai clinique de phase I/II a inclus cinq patientes réparties en deux groupes recevant une dose plus faible (2 × 10 12 particules virales par kg, deux patientes) ou plus forte (5 × 10 12 particules virales par kg, trois patientes) de vecteur viral. Les patientes ont été suivies pendant un an et demi, avec des dosages réguliers de bilirubinémie et une évaluation clinique régulière.
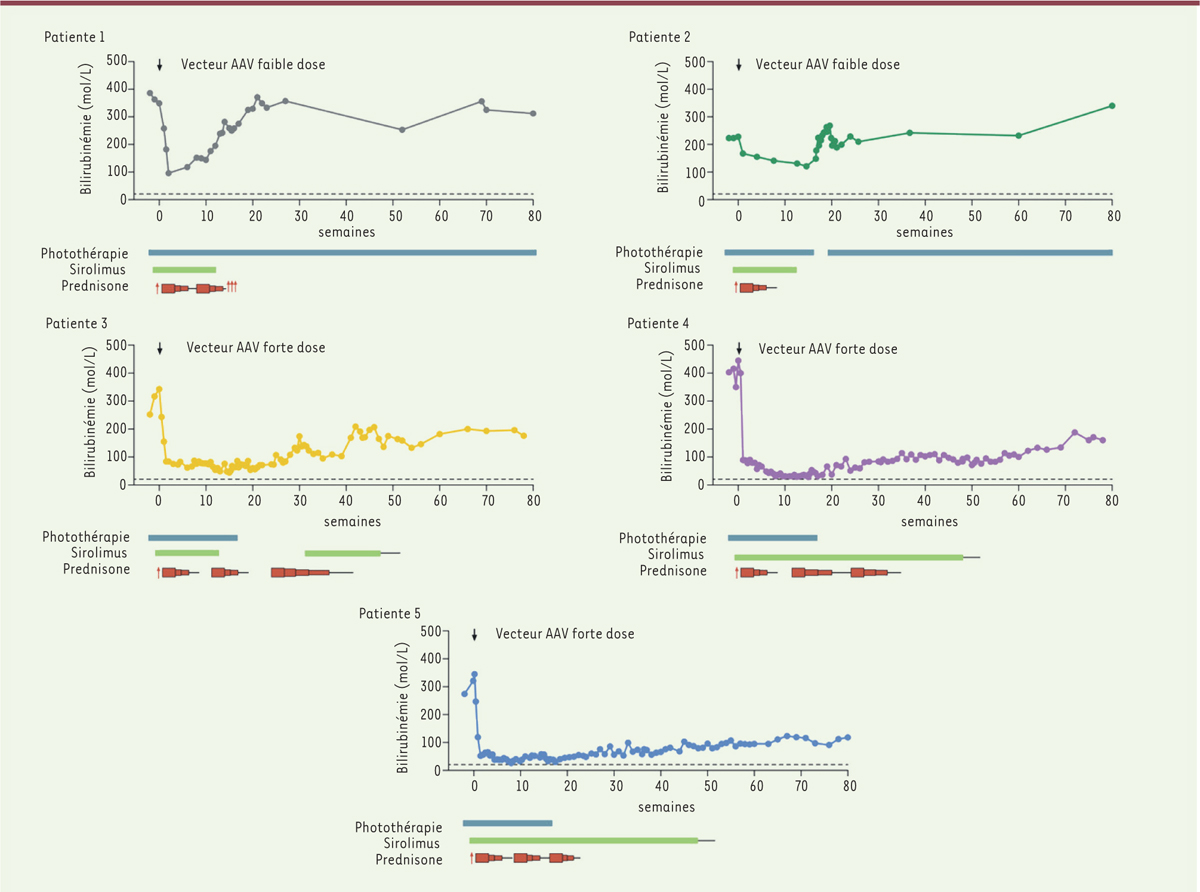
Les résultats de cette étude montrent tout d’abord que l’efficacité du traitement est, comme dans le modèle animal, dépendante de la dose administrée. La dose la plus faible a eu un effet modeste et transitoire sur la bilirubinémie, alors que la dose la plus forte a entraîné une baisse significative et durable de la bilirubinémie chez les trois patientes de ce groupe. La bilirubinémie était proche des valeurs normales chez deux patientes dix à vingt semaines après le traitement. Chez ces patientes, la photothérapie a pu être stoppée ( Figure 1 ) . Il convient également de mentionner que le traitement a été très bien toléré par toutes les patientes, avec des effets indésirables très modérés. Enfin, la durée obtenue de correction de la bilirubinémie est très encourageante pour le développement de cette stratégie thérapeutique. Des essais précédents de thérapie génique utilisant des AAV pour traiter le foie de patients souffrant d’hémophilie avaient montré des augmentations transitoires des enzymes hépatiques, suivies d’une perte de la correction génique [ 9 ]. Ces atteintes du foie étaient attribuées à une réponse immunitaire contre les cellules transduites par le vecteur viral. C’est pour cette raison qu’un traitement immunosuppresseur préventif a été institué chez les patientes participant à l’essai de thérapie génique de la maladie de Crigler-Najjar. La réponse immunitaire à l’injection du vecteur viral n’a pas encore été complètement caractérisée chez ces patientes, mais il existe une réponse humorale, qui était d’ailleurs attendue, contre la capside de l’AAV [ 8 ]. Les auteurs ont cherché à caractériser la réponse cellulaire contre les hépatocytes, mais sans succès, peut-être à cause du traitement immunosuppresseur. Néanmoins, les mécanismes de la réponse immunitaire devront être mieux caractérisés pour permettre d’adapter plus finement le traitement immunosuppresseur.
| Figure 1.
Évolution de la bilirubinémie chez les patientes présenant une maladie de Crigler-Najjar et traitées par thérapie génique.
Les patientes incluses dans l’essai thérapeutique ont reçu une faible dose (patientes 1 et 2) ou une forte dose (patientes 3, 4, 5) du vecteur AAV recombinant GNT 003. Une flèche verticale indique le moment de l’injection. La concentration de la bilirubine dans le sang (bilirubinémie, en μM) a été dosée au cours du temps (80 semaines). Pour chaque patiente traitée, sont indiquées sous la courbe la période de traitement par photothérapie ainsi que l’administration d’immunomodulateurs (sirolimus et prednisone). La ligne horizontale en trait pointillé indique la valeur supérieure de la bilirubinémie normale (17 μM). Les patientes ayant reçu la plus forte dose de vecteur AAV recombinant ont une bilirubinémie bien contrôlée malgré l’arrêt de la photothérapie (figure adaptée de [
8
]).
|
Ce premier essai démontre la faisabilité et l’efficacité de la thérapie génique pour traiter des maladies ciblant le foie. Il s’inscrit dans la lignée des résultats encourageants obtenus pour le traitement de l’hémophilie [ 9 ], et confirme que le foie est une cible pertinente pour les thérapies géniques utilisant des AAV recombinants à des doses modérées. En effet, des études cliniques récentes ont montré une toxicité des AAV recombinants pour des doses supérieures à 10 13 particules virales par kg chez des patients présentant une maladie génétique musculaire. Pour atteindre les muscles, il est nécessaire d’utiliser des doses fortes d’AAV (pouvant aller jusqu’à 10 15 particules virales par kg), mais au prix d’une toxicité sévère chez certains patients [ 10 ]. La possibilité d’obtenir une réponse thérapeutique avec des doses modérées de vecteur AAV est donc un élément de sécurité important pour le développement de ces thérapies géniques contre les maladies du foie.
La question principale qui demeure est celle de la durée de correction de la maladie avec des AVV recombinants. En effet, contrairement aux vecteurs intégratifs qui peuvent insérer le transgène thérapeutique dans le patrimoine génétique de la cellule transduite (comme les rétrovirus et les lentivirus recombinants), les formes actives du génome viral de l’AAV recombinant se présentent dans le noyau de la cellule transduite sous la forme de concatamères formés par de nombreux génomes viraux fusionnés entre eux. Ces concatamères peuvent disparaître lors de la désintégration de la membrane nucléaire au cours de la division cellulaire. Une infection du foie qui entraînerait la disparition d’un grand nombre d’hépatocytes et un processus de régénération du tissu hépatique pourrait également diminuer le niveau de correction génique. La courte durée de vie des rongeurs (de l’ordre de deux ans) ne permet pas de les utiliser comme modèles pour étudier l’efficacité de la thérapie génique à très long terme. Seul le suivi prolongé des patientes traitées permettra de répondre à cette question.
Ces dernières années ont vu le développement de thérapies géniques efficaces et sûres pour diverses maladies touchant différents organes. Le développement de ces approches coûteuses au bénéfice de tous les malades nécessite souvent l’implication de l’industrie pharmaceutique pour produire les vecteurs viraux recombinants en quantité suffisante. Cependant, la rareté de certaines maladies génétiques bénéficiant de ces thérapies innovantes, comme c’est le cas pour la maladie de Crigler-Najjar, dont l’incidence est de l’ordre d’un cas par million de naissances, fait reculer les industriels, qui ne voient pas de bénéfice financier à s’engager dans ces innovations. Souhaitons que les pouvoirs publics, prenant conscience du problème, agissent pour que ces traitements efficaces contre certaines maladies génétiques rares puissent être demain disponibles pour la plupart des personnes qui en sont atteintes.