Malgré la résolution des crises sanitaires liées à la pandémie de Covid-19 ( Coronavirus disease 2019 ) et le développement d’un vaccin protecteur contre les infections sévères par le virus SARS-CoV-2 ( Severe Acute Respiratory Syndrome-Coronavirus 2 ), les autorités de santé restent à l’affût d’une nouvelle menace de ce virus pour la santé humaine et animale. La dissémination de nouveaux variants du SARS-CoV-2 et celle d’autres virus pathogènes respiratoires émergents est un problème majeur en santé publique, notamment à cause de la menace qu’elle représente pour les populations les plus vulnérables. Les campagnes de vaccination déployées depuis le début de la pandémie de Covid-19 ont permis à la population de développer une immunité face au SARS-CoV-2. Néanmoins, cette immunité s’estompe au cours du temps, et il est donc fortement recommandé, notamment aux individus les plus fragiles, de se faire vacciner chaque année, en particulier parce que l’apparition de nouveaux variants du virus devrait continuer pendant encore quelques années. De plus, l’exposition répétée au virus augmenterait le risque d’apparition de symptômes prolongés post-Covid-19 (appelés Covid-long). En plus de la vaccination, il est donc nécessaire de continuer à explorer de nouvelles pistes de traitement.
Nous avons mis en évidence un nouveau mode d’entrée du virus SARS-CoV-2 dans la cellule faisant intervenir l’enzyme LSD1 ( lysine-specific demethylase-1 ), précédemment impliquée dans le remodelage de la chromatine, notamment en ciblant les groupements mono- et di-méthyles des histones de type H3K4 (histone H3 lysine 4) ou H3K9, généralement associées respectivement à l’activation ou à la répression de l’expression des gènes [ 1 , 2 ]. Nous avons montré que LSD1 permet également la déméthylation du récepteur ACE2 (enzyme de conversion de l’angiotensine 2), une protéine membranaire de surface, méthylée sur son résidu lysine en position 31 (K31), qui est impliquée dans la pénétration cellulaire du SARS-CoV-2 lors d’une infection. Cette activité enzymatique de LSD1 facilite l’entrée du virus dans la cellule via la reconnaissance de la protéine virale Spike, et le complexe virus-récepteur et importine-a (protéine navette nucléaire) atteint facilement le noyau de la cellule pour déclencher les mécanismes nécessaires à la réplication du virus. La découverte de l’importation nucléaire du récepteur ACE2 ( nuclear ACE2 , nACE2) ouvre ainsi une nouvelle perspective thérapeutique pour inhiber cette réplication [ 3 ].
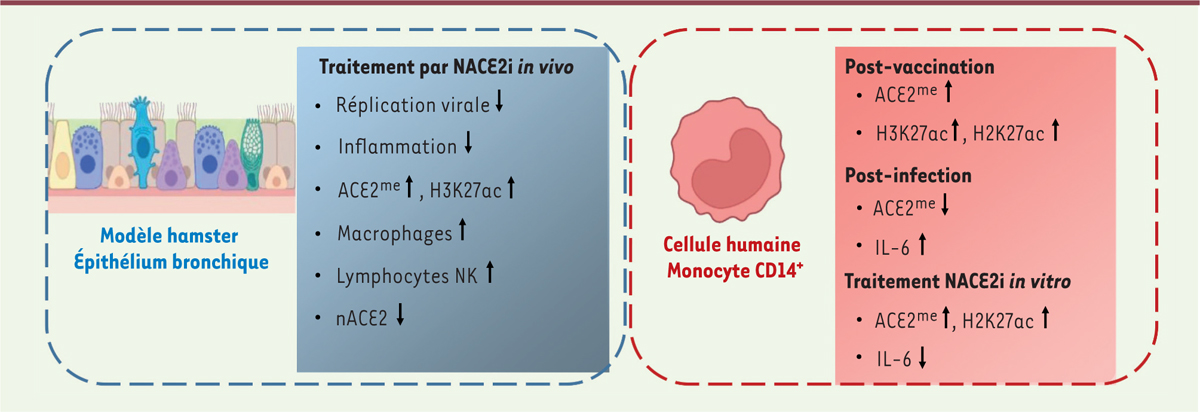
Nous avons conçu un peptide inhibiteur de nACE2 ( nuclear ACE2 inhibitor , NACE2i), qui agit sur le mode d’entrée et de réplication du virus [ 4 ]. Dans un modèle de hamster infecté par le SARS-CoV-2 et traité avec ce peptide, nous avons montré que ce dernier inhibe la réplication du virus, prévient l’inflammation induite principalement par les macrophages résidents des poumons, et augmente l’infiltration des bronchioles par des lymphocytes NK ( natural killer ) cytotoxiques.
Pour tenter de comprendre le mécanisme d’action de NACE2i, nous avons utilisé la technique NanoString GeoMx Digital Spatial Profiler (DSP), qui permet un profilage spatial à haut débit des cibles ARN et protéiques et de la morphologie des cellules dans leur contexte tissulaire natif (sans perturber leur organisation spatiale ou leur microenvironnement). Nous avons analysé des coupes de poumons d’animaux infectés par le SARS-CoV-2, traités ou non avec NACE2i, et avons mis en évidence une signature spécifique associée au traitement par NACE2i. Nous avons en effet constaté que ce peptide entraîne la présence d’une forme acétylée de l’histone H3 (H3K27ac) dans les poumons des animaux traités ( Figure 1 ) , ce qui suggère qu’une activation de la transcription des gènes de l’immunité est impliquée dans l’inhibition de la réplication virale. Le peptide induit également l’augmentation d’une forme méthylée du récepteur ACE2 (ACE2 me ) dans les cellules de l’épithélium bronchique. Nous cherchons désormais à comprendre le mécanisme par lequel NACE2i induit cette immunité contre le SARS-CoV-2.
Nous avons également montré que le traitement par NACE2i conduit à une diminution spectaculaire de l’inflammation pulmonaire impliquant principalement les voies de signalisation dépendant de la molécule TLR4 ( toll-like receptor 4 ), et à une réduction du réservoir viral dans l’épithélium bronchique. Ainsi, le peptide NACE2i entraînerait une « reprogrammation épigénétique » du récepteur ACE2, qui désarme le virus SARS-CoV-2 et l’empêche de se répliquer dans la cellule. Le récepteur ACE2 reprogrammé est renvoyé à la surface de la cellule, où il agit comme un verrou empêchant le virus de pénétrer dans la cellule.
Les mêmes reprogrammations épigénétiques de ACE2 (ACE2 me ) et de H3K27 (H3K27ac) ont également été retrouvées dans les monocytes de personnes infectées par le virus et en cours de rétablissement, ou chez les personnes vaccinées. Nous avons constaté que cette signature épigénétique était moindre dans les cellules de personnes hospitalisées ayant développé une infection très sévère, et qu’elle était corrélée positivement avec la présence des anticorps anti-Spike neutralisants, et négativement avec l’expression de la protéine virale Spike dans les monocytes, chez ces personnes. L’ensemble de ces résultats reflète le rôle du peptide NACE2i dans la mise en place d’une empreinte épigénétique, ACE2 me , qui est associée à une réduction du réservoir viral dans les cellules cibles et à une diminution de la réponse inflammatoire ( Figure 1 ) . Nous suggérons qu’à la suite d’une vaccination contre le virus SARS-CoV-2, les monocytes CD14 + circulants, qui expriment abondamment le récepteur ACE2 [ 5 ], sont activés par la protéine Spike apportée par le vaccin, via la voie de signalisation TLR4, ce qui induirait une augmentation de l’expression de gènes codant des méthylases impliquées dans la méthylation de la protéine ACE2 cytoplasmique (cette empreinte épigénétique protectrice contre l’infection) par un mécanisme qui reste à découvrir.
La forme nucléaire du récepteur ACE2 représente donc une cible thérapeutique d’intérêt pour le traitement des infections sévères par le SARS-CoV-2, ou pour les individus qui développent des symptômes de « Covid-long », contre lesquels on ne dispose à ce jour d’aucun traitement spécifique. Les résultats précliniques prometteurs obtenus avec le peptide NACE2i indiquent qu’il pourrait être utilisé pour renforcer l’efficacité des vaccins contre le SARS-CoV-2, offrant ainsi une protection durable contre le virus et ses variants. Nous évaluons actuellement la présence de la signature ACE2 me chez un plus grand nombre de personnes infectées (avec une infection de gravité variable, modérée à sévère), d’âges différents, avec ou sans comorbidités. Nous nous intéressons notamment à celles qui ont développé des symptômes post-infection persistants (Covid-long).
La reprogrammation épigénétique des cellules du système immunitaire inné par l’utilisation de molécules remodelant la chromatine afin de moduler l’expression des gènes est un domaine de recherche thérapeutique en plein essor. Cette thérapie épigénétique est déjà testée en oncologie, avec l’utilisation médicale de plusieurs molécules approuvées par la FDA ( Food and Drug Administration ) [ 6 ]. L’utilisation des molécules à effet épigénétique pour reprogrammer les cellules de l’immunité innée afin d’induire une immunité « entraînée » constitue également une piste thérapeutique prometteuse contre les infections.