La brucellose, une maladie due à diverses espèces de bactéries du genre Brucella , est une zoonose constituant une menace pour la santé humaine dans le monde entier ( → ). Selon l’Organisation mondiale de la santé (OMS), elle figure parmi les sept principales zoonoses négligées qui entraînent la pauvreté et entravent le développement [ 1 ]. Toutes les espèces de Brucella ne sont pas responsables de zoonoses. Les êtres humains sont principalement infectés par B. mellitensis , B. abortus et B. suis . Chez les animaux domestiques, B. abortus provoque l’avortement, une progéniture affaiblie, une réduction de la production laitière, et une orchite et une épididymite stérilisantes chez les mâles, ce qui entraîne des pertes économiques considérables dans les pays en développement. La brucellose humaine se manifeste par des signes cliniques non spécifiques, tels que malaises, fièvre ondulante et fatigue. Malheureusement, la maladie n’est souvent pas traitée en raison de fréquentes erreurs de diagnostic, ce qui entraîne sa progression vers une phase chronique avec lésions osseuses, arthrite, ostéomyélite, endocardite, splénomégalie et orchite. La transmission de la maladie des animaux à l’homme se fait par contact direct avec des animaux infectés ou avec leurs tissus, ou encore par des produits animaux contaminés. La transmission interhumaine peut se produire par voie transplacentaire, par une transfusion sanguine, ou par une greffe de moelle osseuse.
(→) Voir la Synthèse de S. Lambert et al. , m/s n° 10, octobre 2023, page 722
Brucella est un maître dans l’art de l’évasion. Sa capacité à établir des infections persistantes et chroniques est due à sa capacité à échapper à la réponse immunitaire de l’hôte. La bactérie se réplique dans le réticulum endoplasmique de cellules endothéliales, de trophoblastes, de lymphocytes B et T, d’ostéoblastes, d’ostéoclastes, de macrophages, de cellules dendritiques, et d’autres types cellulaires ( Figure 1 ) , modulant à la fois l’immunité innée et l’immunité adaptative. Bien que l’infection par B. abortus soit associée à une réponse pro-inflammatoire des lymphocytes T auxiliaires du type Th1, détectable au cours de la phase aiguë de l’infection, les cytokines pro-inflammatoires associées à cette réponse n’ont que peu d’effet sur la survie de la bactérie. Pendant la phase tardive de l’infection, Brucella inhibe la production de cytokines pro-inflammatoires par les cellules dendritiques, et induit une réponse lymphocytaire du type Th2, avec production d’interleukine-10 (IL-10) et de facteur de croissance transformant (TGF-β).
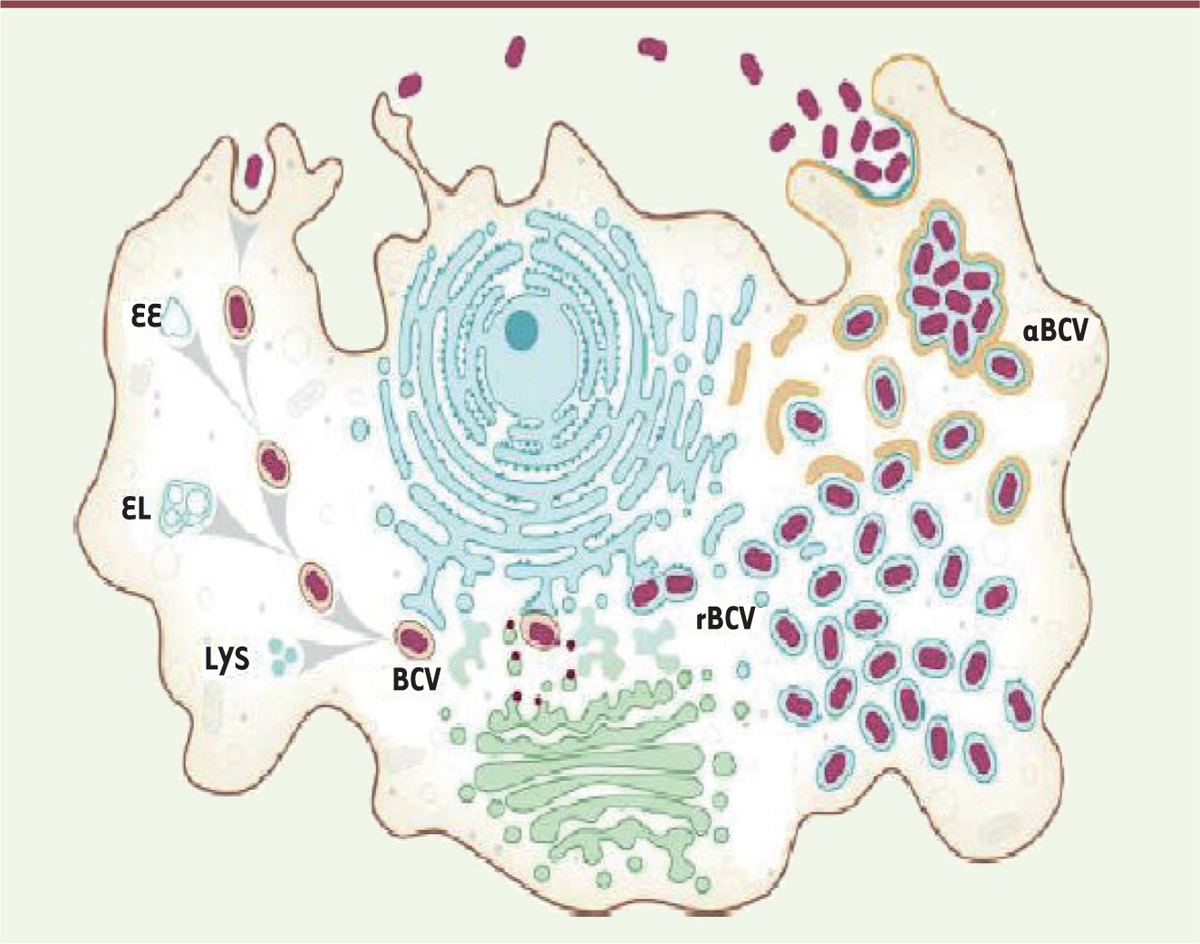
| Figure 1.
Trafic intracellulaire des bactéries du genre Brucella.
Brucella
pénètre dans la cellule par les radeaux lipidiques, dans une vacuole (
Brucella
-containing vacuole, BCV). Une fois internalisée, cette vacuole interagit avec les endosomes précoces (
early endosome
, EE), les endosomes tardifs (
late endosome
, EL) et les lysosomes (LYS). Ensuite, la bactérie cible l’ERES (
endoplasmic reticulum exit site
) et fusionne avec le réticulum endoplasmique pour former la vacuole réplicative (rBCV). Au cours de l’apoptose de la cellule infectée, cette vacuole réplicative est convertie en autophagosome (aBCV), et permet aux bactéries de s’échapper de la cellule (figure adaptée de [
7
]).
|
Notre groupe de recherche a été directement impliqué dans la découverte de facteurs de virulence de Brucella importants pour subvertir les défenses de l’hôte, notamment son lipopolysaccharide non canonique, caractérisé par une faible endotoxicité, une résistance accrue à la dégradation par les macrophages et une protection contre les réponses immunitaires de l’hôte [ 2 ]. Nous nous sommes plus particulièrement intéressés aux protéines de la membrane externe ( outer membrane proteins , OMP) de Brucella , notamment à la protéine OMP25. Cette protéine inhibe l’activation des monocytes et des macrophages humains in vitro . Nous avons montré que la protéine OMP25 de B. abortus interagit directement avec le récepteur CD150 des cellules dendritiques in vitro . Cette interaction inhibe la maturation de ces cellules en limitant la translocation de NF-κB (nuclear factor-kappa B ) et en diminuant la sécrétion de cytokines pro-inflammatoires. In vivo , l’axe de signalisation OMP25-CD150 semble jouer un rôle essentiel dans la persistance de Brucella au stade chronique de l’infection [ 3 ]. CD150 est une protéine transmembranaire de type 1 1 appartenant à la famille des molécules de signalisation d’activation lymphocytaire ( signaling lymphocyte activation molecule family , SLAMF). Elle est produite principalement par les cellules hématopoïétiques, notamment les lymphocytes T et B, les monocytes activés et les cellules dendritiques, ainsi que par les cellules souches hématopoïétiques. Puisque Brucella peut coloniser la moelle osseuse murine et y persister [ 4 ], nous nous sommes demandé si l’infection par cette bactérie pouvait subvertir la fonction des cellules souches hématopoïétiques de manière dépendante de OMP25/CD150.
Nous avons découvert que Brucella est capable de mener une danse très brève avec les cellules souches hématopoïétiques sans les infecter [ 5 ]. Nous avons montré que la présence de B. abortus dans la moelle osseuse murine perturbe l’homéostasie du compartiment des cellules souches et progénitrices hématopoïétiques en entraînant une augmentation de la production de cellules progénitrices multipotentes précoces et en favorisant l’engagement des cellules souches hématopoïétiques vers la différenciation myéloïde. Nous avons ensuite confirmé que la protéine OMP25 de la membrane externe de B. abortus était nécessaire pour induire l’engagement myéloïde de ces cellules. En utilisant des souris mutantes privées de CD150, nous avons montré que l’augmentation de l’élément régulateur promoteur de PU.1 (ou Spi-1-proto-oncogène, un facteur de transcription impliqué dans la différenciation des cellules hématopoïétiques des lignées myéloïdes et lymphoïde B) dans les cellules souches hématopoïétiques au début de l’infection dépend de l’interaction entre OMP25 et CD150. Nous avons également analysé la composition des cellules progénitrices issues de ces cellules après l’infection. Nous avons détecté une augmentation des progéniteurs des lignées myéloïdes dans la moelle osseuse des souris de génotype « sauvage » infectées par B. abortus ( Figure 2 ) , mais pas dans celle des souris infectées par une souche mutante de la bactérie dépourvue de OMP25, ou dans celle des souris infectées dépourvues de la protéine CD150. Nous avons également constaté une réduction de la production des cellules progénitrices des globules rouges dépendant de l’interaction entre OMP25 et CD150 au cours de l’infection, en accord avec l’anémie détectée chez un tiers des patients présentant une brucellose.
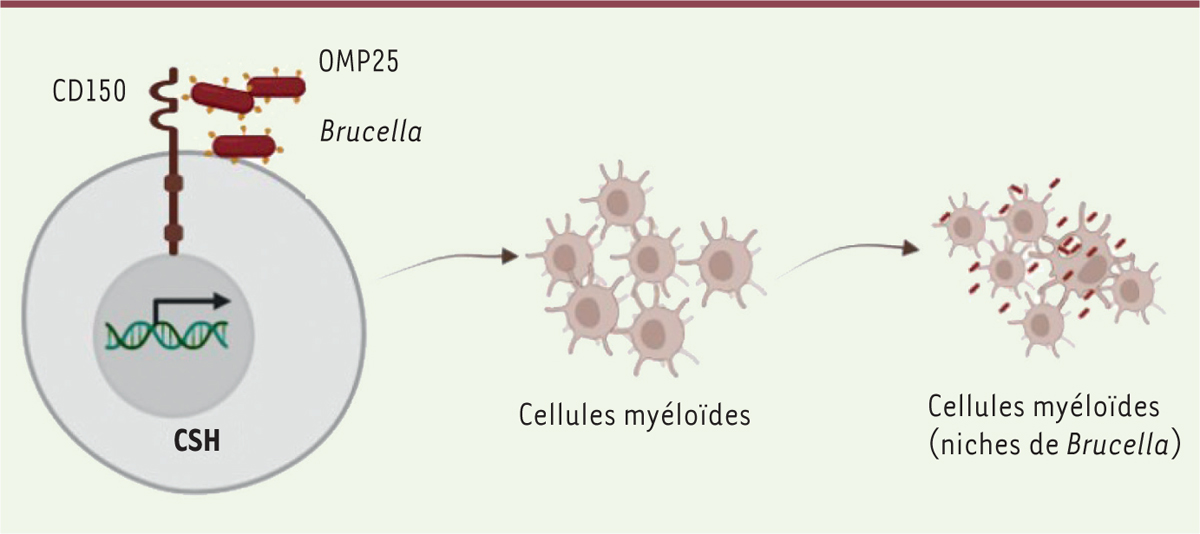
| Figure 2.
L’interaction OMP25-CD150 à la surface de cellules souches hématopoïétiques oriente leur différenciation vers la voie myéloïde.
L’interaction de la protéine OMP25 de
Brucella
avec la protéine CD150 à la membrane plasmique de cellules souches hématopoïétiques (CSH) favorise l’engagement de ces dernières dans la voie de différenciation myéloïde. Les cellules myéloïdes en nombre augmenté constitueront la niche principale de l’infection par la bactérie.
|
Cet effet de Brucella sur les cellules souches hématopoïétiques profite-t-il à la bactérie ou à l’hôte ? Une augmentation transitoire de l’engagement de ces cellules vers une voie de différenciation myéloïde induite par l’interaction OMP25-CD150 est plus susceptible d’être bénéfique à la bactérie puisque B. abortus est capable d’infecter les cellules myéloïdes et de s’y répliquer. Par conséquent, la myélopoïèse induite par B. abortus augmente le nombre de cellules cibles de la bactérie et constitue un avantage pour sa dissémination et l’infection chronique. Cela peut donc être considéré comme une nouvelle stratégie d’évasion exploitée par Brucella , et souligne l’effet néfaste sur l’hôte d’une infection prolongée par cette bactérie. Il convient de noter que dans le cas d’une infection par les entérobactéries Escherichia coli ou Salmonella Typhimurium, l’augmentation de la production de cellules myéloïdes favorise au contraire la clairance bactérienne [ 6 ].
Les résultats de cette recherche innovante sur les bactéries du genre Brucella montrent qu’elles peuvent influencer la différenciation de cellules souches, et révèlent de nouveaux aspects de la relation hôte-pathogène. Il reste à déterminer si des mécanismes similaires sont utilisés par d’autres bactéries pathogènes pour subvertir le système immunitaire, ou s’il s’agit d’une caractéristique spécifique de Brucella . Un tel mécanisme pourrait-il être utilisé par des bactéries, telles que certaines entérobactéries, responsables d’infections aiguës induisant une réponse inflammatoire manifeste, ou plutôt par des agents pathogènes « silencieux » et responsables d’une infection chronique, tels que Coxiella burnetii (responsable de la fièvre Q) ou Mycobacterium tuberculosis (responsable de la tuberculose) ?