| |
| Med Sci (Paris). 39(11): 815–819. doi: 10.1051/medsci/2023150.Un fibroscope biphotonique pour l’imagerie et la stimulation optogénétique des neurones chez des souris se déplaçant librement Antonio Lorca-Cámara,1 François G.C. Blot,1 Nicolò Accanto,1 and Valentina Emiliani1* 1Groupe d’ingénierie du front d’onde appliquée à la microscopie, Sorbonne université, Inserm, CNRS, Institut de la vision
,
Paris
,
France MeSH keywords: Souris, Animaux, Optogénétique, Neurones, Imagerie diagnostique, méthodes, physiologie |
L’optogénétique pour étudier l’activité neuronale dans le cerveau
La mise en évidence du lien entre le comportement animal et son activité cérébrale représente un enjeu majeur en neurosciences. De nouvelles techniques permettent aujourd’hui l’enregistrement de l’activité de populations de neurones dans de vastes régions du cerveau au cours du comportement animal. Parmi ces techniques, l’imagerie optique fondée sur des indicateurs calciques codés génétiquement, tels que les GCaMP
1
[
1
], confère aux chercheurs la possibilité d’enregistrer l’activité individuelle de centaines de neurones dans un vaste champ de vue. Cependant, une étude complète implique d’être capable de manipuler les circuits neuronaux parallèlement à l’acquisition d’images de la région cérébrale étudiée, afin de déterminer le rôle de chaque neurone ou groupe de neurones dans la production des réponses comportementales. Au début des années 2000, le développement d’une nouvelle technique, l’optogénétique, a permis le contrôle de l’activité neuronale de manière optique grâce à l’expression artificielle de canaux ioniques photosensibles, les opsines, dans les neurones [
2
,
3
].
Dans la plupart des expériences ayant recours à l’optogénétique, les expérimentateurs illuminent la région cérébrale d’intérêt avec de la lumière visible (illumination dite monophotonique) en utilisant des diodes électroluminescentes (LED,
light-emitting diode
) ou des lasers couplés à des fibres optiques, afin de stimuler le groupe de neurones dans lesquels l’expression de l’opsine a été induite génétiquement. Grâce à cette technique, il a été possible d’établir des liens entre différents types de neurones et certaines fonctions cérébrales ou comportements de l’animal. Néanmoins, ces approches ne permettent pas le contrôle de neurones uniques, et entraînent un certain degré de synchronisation qui diffère des conditions de l’activité cérébrale physiologique. Afin d’y remédier et de pouvoir étudier comment des motifs spatio-temporels spécifiques d’activité neuronale contrôlent le comportement animal, il est nécessaire de développer des techniques permettant de contrôler l’activité d’un ou plusieurs neurones indépendamment dans l’espace et dans le temps.
Pour obtenir la résolution de la cellule unique dans la profondeur du tissu cérébral, des lasers à impulsions ultra-courtes sont utilisés pour induire une excitation optique dite biphotonique. Grâce à leur longueur d’onde située dans l’infrarouge, ces rayonnements lasers pénètrent mieux dans le cerveau, tandis que l’excitation biphotonique offre un meilleur confinement axial par rapport à l’excitation monophotonique avec des lasers émettant une lumière visible, garantissant ainsi une précision accrue dans le ciblage des neurones qu’on souhaite contrôler. L’effet biphotonique est utilisé pour l’imagerie à haute résolution de l’activité neuronale en utilisant des systèmes qui balayent le faisceau laser dans la région cérébrale d’intérêt. Cependant, pour la manipulation de plusieurs neurones simultanément, un autre outil est nécessaire, qui doit permettre de cibler précisément les neurones d’intérêt tout en illuminant plusieurs neurones simultanément, en conservant la résolution d’un neurone unique. Cela est rendu possible grâce à l’holographie [
4
], une méthode optique découverte par Dennis Gabor (lauréat du prix Nobel de physique en 1971) et qui consiste à moduler le front d’onde d’un laser afin de reproduire le motif souhaité dans le plan focal. La version moderne de l’holographie, appelée
computer generated holography
(CGH), s’appuie sur des modulateurs spatiaux de lumière (SLM,
spatial light modulator
), qui sont des dispositifs comparables à des vidéoprojecteurs capables de reproduire des hologrammes en trois dimensions, calculés à l’avance par ordinateur [
5
]. Une fois qu’une image de référence des neurones a été acquise, il est possible de créer un hologramme ciblant simultanément plusieurs neurones que l’on souhaite stimuler à partir de la lumière laser. On peut utiliser un hologramme qui génère plusieurs points focaux qui vont être balayés sur les corps cellulaires [
6
], ou utiliser plusieurs disques d’illumination qui couvrent l’ensemble du corps cellulaire [
7
]. Dans ce dernier cas, pour compenser la perte de résolution axiale, on combine l’holographie CGH avec la technique de focalisation temporelle [
8
]. Ainsi, de grandes taches sont créées pour couvrir l’ensemble du neurone tout en conservant une résolution axiale équivalente à celle d’une cellule unique. En fonction de l’opsine choisie, cette stimulation permet l’activation ou l’inhibition d’un neurone unique ou de groupes spécifiques de neurones avec la résolution de la cellule unique.
Ces outils très puissants, combinés à l’imagerie calcique, permettent un contrôle « tout-optique » des circuits neuronaux, et sont utilisés par différents groupes de recherche souhaitant enregistrer et stimuler par optogénétique l’activité de populations de neurones avec précision, ce qui a permis de progresser dans notre compréhension de la façon dont les circuits neuronaux influencent le comportement animal [
9
]. Néanmoins, la grande majorité des études sont menées sur des animaux dont les mouvements sont restreints afin de les placer sous l’objectif de microscopes volumineux, empêchant ainsi la capacité de suivre et manipuler avec précision l’activité neuronale lorsque l’animal est libre de ses mouvements. La restriction d’un animal engendre des contraintes mécaniques et du stress, tout en entraînant une orientation des tâches comportementales. Cela a indubitablement un impact artificiel sur l’activité neuronale, quelle que soit la région du cerveau étudiée. Comprendre les liens entre comportement animal et activité neuronale nécessite de pouvoir suivre et manipuler cette activité dans des conditions plus naturelles, lorsque l’animal se déplace librement.
|
Contrôle « tout-optique » des circuits neuronaux chez des animaux se déplaçant librement
Au cours de la dernière décennie, plusieurs systèmes optiques ont été développés dans le but d’enregistrer l’activité neuronale d’animaux se déplaçant librement. Ces systèmes peuvent être regroupés en trois catégories : 1) des microscopes monophotoniques (1P) miniaturisés, 2) des microscopes biphotoniques (2P) ou à trois photons (3P) [
10
] miniaturisés à fibre unique (ou monocœur), et 3) des fibroscopes monophotoniques et biphotoniques à fibres multicœurs, également appelés fibroscopes. Les microscopes 1P miniaturisés présentent comme limitation l’absence de sectionnement optique, ce qui implique une plus grande excitation des plans hors focalisation
,
et une faible profondeur de pénétration tissulaire du rayonnements lumineux, dont la longueur d’onde est située dans le spectre visible [
11
]. Au contraire, les microscopes biphotoniques utilisant des fibres monocœur offrent une résolution cellulaire et subcellulaire, sur un vaste champ de vue tridimensionnel de 400 x 400 x 200 µm
3
[
12
]. Malgré ces avantages, ce système est difficilement compatible avec la stimulation optogénétique de haute résolution des neurones en utilisant par exemple l’approche holographique.
L’utilisation de fibres multicœurs flexibles combinée à des micro-objectifs ou à des microlentilles permet d’acheminer des motifs d’illumination spécifiques jusqu’au cerveau murin. En 2014, nous avons utilisé cette approche pour développer le premier endoscope fibré 1P permettant la manipulation tout-optique de circuits neuronaux chez des souris se déplaçant librement [
13
]. Le système comprenait deux voies optiques pour l’imagerie calcique (excitation à 491 nm) et la stimulation holographique (excitation à 473 nm). Chez des souris en libre mouvement, après la co-injection du senseur calcique GCaMP5-G et du canal ionique photoactivable ChR2 (channelrhodopsine-2), un canal ionique sensible à la lumière bleue, nous avons pu montrer le contrôle d’un ou plusieurs neurones avec l’enregistrement simultané de l’activité neuronale. Cependant, le système restait limité premièrement, par l’utilisation des longueurs d’onde d’illumination situées dans la gamme du visible et de l’excitation monophotonique, qui empêche l’illumination en profondeur à partir de la surface, et deuxièmement, par l’utilisation d’un micro-objectif de grande taille (diamètre 2,3 mm), dont l’implantation cérébrale en profondeur est assez invasive.
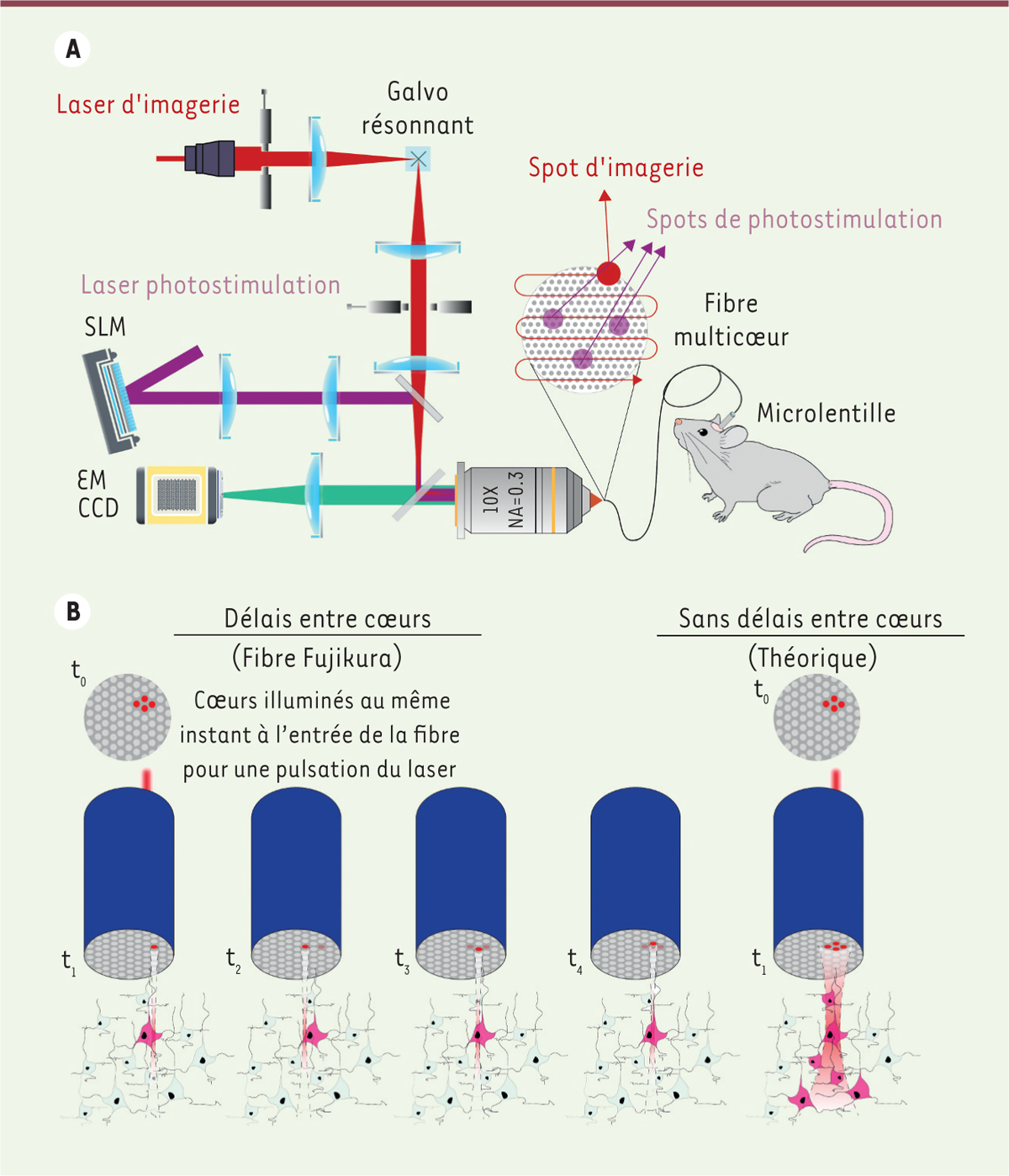
Notre équipe de recherche a réussi à surmonter cet obstacle en développant un nouveau fibroscope biphotonique, le 2P-FENDO. Ce système est spécifiquement conçu pour enregistrer l’activité neuronale et effectuer une stimulation optogénétique de haute résolution chez des souris se déplaçant librement, en utilisant des lasers biphotoniques couplés à une fibre multicœurs
(
Figure 1A
)
[
14
]. Pour enregistrer l’activité neuronale, nous utilisons un laser infrarouge qui balaye la région cérébrale d’intérêt, préalablement traitée pour permettre l’expression de l’indicateur calcique GCaMP7s (laser d’imagerie à 920 nm). Ensuite, la stimulation des neurones exprimant l’opsine ChRmine est réalisée à l’aide d’un second laser infrarouge (laser de photostimulation à 1030 nm). Enfin, pour refocaliser le faisceau lumineux à la sortie de la fibre multicœurs et collecter la fluorescence émise par les neurones, nous utilisons une microlentille (
GRIN lens
, diamètre 1,3 mm) spécialement conçue pour maintenir une haute résolution spatiale [
15
].
 | Figure 1.
A. Schéma du système optique pour l’imagerie et la stimulation holographique biphotonique d’un ensemble de neurones dans le cerveau de souris, avec une fibre multicœurs et une microlentille. B. Représentation des délais temporels à travers les différents cœurs de la fibre lors de la propagation du laser, résultant en une résolution spatiale optimale afin de ne pas stimuler les neurones avoisinants.
À droite : exemple théorique sans les délais temporels entre cœurs qui se produisent dans une fibre multicœurs : la résolution neuronale disparaît et la stimulation des neurones avoisinants non ciblés directement serait inévitable. SLM :
spatial light modulator
(modulateur spatial de lumière)
; EM :
electron-multiplying
(électromultiplicateur) ; CCD :
charge-coupled device
(capteur photographique à transfert de charges). Galvo-résonnant : miroirs pour le balayage du faisceau à haute vitesse.
|
Deux problèmes principaux se posent pour la photostimulation et l’imagerie biphotonique à travers une fibre optique : tout d’abord, la nécessité d’illuminer le neurone avec un
spot
large et la capacité d’illuminer plusieurs neurones simultanément. Pour cela, le faisceau de photostimulation, comme pour le système fibré monophotonique [
13
], est modulé en amont par un SLM afin de créer des hologrammes à l’entrée de la fibre, qui sont ensuite projetés dans le cerveau de la souris. En ce qui concerne l’imagerie, le défi majeur réside dans la limitation de puissance que chaque cœur de la fibre peut supporter pour ne pas distordre l’excitation biphotonique. Les fibroscopes 2P conventionnels surmontent cette difficulté en utilisant de longues durées d’illumination, mais au détriment de la vitesse d’imagerie [
16
]. Au lieu de cela, nous avons proposé d’augmenter la taille du
spot
illuminé afin de collecter davantage de fluorescence. Pour préserver la résolution spatiale du signal recueilli, le système a été couplé à une caméra de haute sensibilité.
L’utilisation des grands
spots
pour l’imagerie et la photostimulation holographique à l’aide d’un microscope conventionnel entraînerait une perte de la résolution axiale, ce qui nécessiterait l’utilisation de la focalisation temporelle [
8
]. Dans le cas du fibroscope 2P-FENDO, une haute résolution axiale est obtenue grâce à un effet intrinsèque de la fibre multicœurs
(
Figure 1B
)
. En effet, la fibre disperse temporellement les différentes fractions de l’impulsion laser lorsque cette dernière se propage à travers les différents cœurs de la fibre, en raison d’infimes différences géométriques entre ces cœurs. Par conséquent, la résolution axiale de la lumière produite dans le plan de l’échantillon reste similaire à celle d’un seul cœur, indépendamment de la taille du
spot
d’illumination. Du point de vue d’un neurone, le faisceau qui illumine plusieurs cœurs de la fibre arrive à des instants très légèrement différents (quelques picosecondes de différence), mais le neurone « perçoit » le faisceau avec la résolution d’un seul cœur (haute résolution) et non pas avec celle de plusieurs cœurs (basse résolution). Cette propriété de la fibre multicœurs, combinée à l’utilisations de lasers à impulsions ultracourtes, a permis de saisir jusqu’à 50 images successives par seconde à des profondeurs pouvant atteindre 150 µm à partir de la surface du cerveau, tout en réalisant une photostimulation optogénétique avec une résolution cellulaire, c’est-à-dire en activant des neurones individuels sans activer les neurones environnants
(
Figure 2
)
.
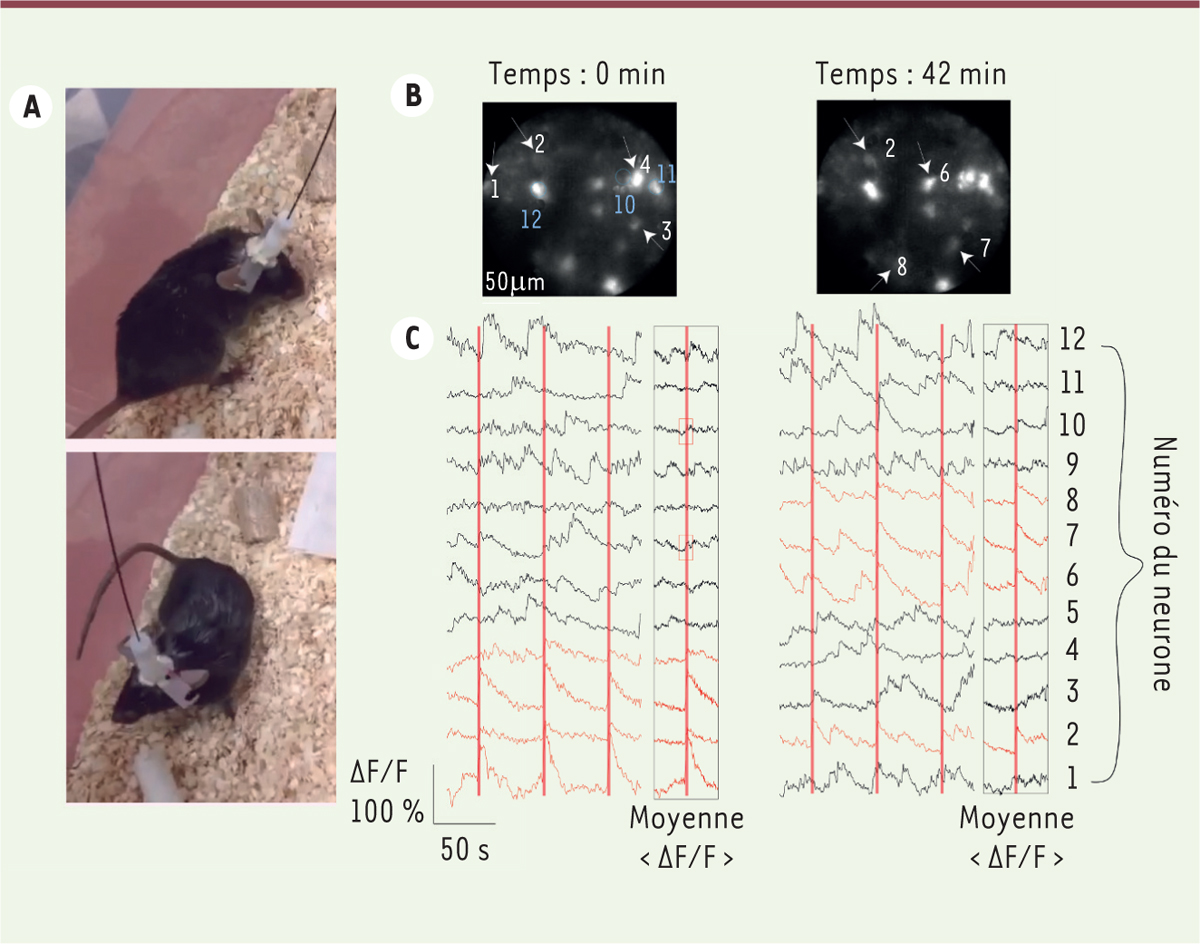
 | Figure 2.
A. Images d’une souris se déplaçant librement, avec la fibre multicœurs couplée à la microlentille fixée à la surface du cerveau grâce à un implant. B. Exemple d’un champ de vue (250 x 250 µm
2
) dans le cortex sensoriel W1 d’une souris préalablement injectée avec des vecteurs viraux permettant l’expression de l’indicateur calcique jGCaMP7s et de l’opsine ChRmine pour la stimulation optogénétique, à deux moments différents de l’expérience.
Les flèches indiquent les neurones (numérotés en blanc) ciblés et activés par optogénétique à un instant
t
. D’autres neurones non ciblés sont numérotés en bleu.
C. Enregistrements de l’activité des différents neurones ciblés dans le champ de vue en B.
Les tracés des neurones ciblés et activés pendant une courte durée sont indiqués en rouge, et ceux des neurones non ciblés, en noir. Les lignes verticales rouges signalent le temps des stimulations lumineuses successives. Ces stimulations déclenchent une augmentation de l’activité des neurones ciblés (augmentation du rapport de fluorescence ΔF/F à la suite de la stimulation).
|
|
Cette technique permet, pour la première fois, d’étudier et d’interroger les systèmes neuronaux chez des animaux se déplaçant librement avec une haute résolution spatiale et temporelle, ce qui ouvre de nouvelles perspectives pour la recherche en neurosciences. Nous avons démontré la capacité d’enregistrer rapidement l’activité neuronale, tout en ciblant précisément les neurones choisis grâce à des hologrammes pour stimuler leur activité. La micro-lentille (diamètre 1,3 mm) que nous utilisons actuellement permettra également d’accéder à des régions plus profondes du cerveau, telles que l’hippocampe, l’amygdale ou le thalamus, et d’approfondir ainsi notre compréhension de l’intégration neuronale dans ces circuits neuronaux liés à la mémoire spatiale, aux comportements provoqués par la peur, ou encore, à l’intégration des informations sensorielles et motrices. De futures optimisations et améliorations optiques dans le but d’élargir le champ d’acquisition et d’améliorer l’efficacité de transmission de la lumière permettront la manipulation simultanée d’un nombre croissant de neurones, dans des régions plus étendues du cerveau. Si le système est actuellement limité à la manipulation de neurones dans un seul plan, l’implémentation de lentilles réglables positionnées après la fibre multicœurs pourrait permettre d’élargir le champ d’excitation à plusieurs plans. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Tian
L
,
Andrew Hires
S
,
Looger
LL
.
Imaging neuronal activity with genetically encoded calcium indicators.
.
Cold Spring Harb Protoc
.
2012;
;
7
:
:647.
–
56
.
2.
Emiliani
V
,
Entcheva
E
,
Hedrich
R
,
et al
.
Optogenetics for light control of biological systems.
.
Nat Rev Methods Primers
.
2022;
;
2
:
:55.
.
3.
Deisseroth
K.
.
Optogenetics.
.
Nat Methods
.
2011;
;
8
:
:26.
–
29
.
4.
Gabor
D.
Holography, 1948–1971.
.
Science
.
1972;
;
177
:
:299.
–
313
.
5.
Chen
IW
,
Papagiakoumou
E
,
Emiliani
V
.
Towards circuit optogenetics.
.
Curr Opin Neurobiol
.
2018;
;
50
:
:179.
–
189
.
6.
Packer
AM
,
Russell
LE
,
Dalgleish
HWP
,
et al.
Simultaneous all-optical manipulation and recording of neural circuit activity with cellular resolution in vivo.
.
Nat Methods
.
2015;
;
12
:
:140.
–
146
.
7.
Ronzitti
E
,
Ventalon
C
,
Canepari
M
,
et al.
Recent advances in patterned photostimulation for optogenetics.
.
J Opt (UK)
.
2017;
;
19
:
:113001.
.
8.
Papagiakoumou
E
,
Ronzitti
E
,
Emiliani
V
.
Scanless two-photon excitation with temporal focusing.
.
Nat Methods
.
2020;
;
17
:
:571.
–
81
.
9.
Marshel
JH
,
Kim
YS
,
Machado
TA
,
et al
.
Cortical layer-specific critical dynamics triggering perception.
.
Science (80)
.
2019;
;
365
:
:1.
–
23
.
10.
Chen
K
,
Tian
Z
,
Kong
L
.
Advances of optical miniscopes for in vivo imaging of neural activity in freely moving animals.
.
Front Neurosci
.
2022;
;
16
:
:1.
–
9
.
11.
Aharoni
D
,
Hoogland
TM
.
Circuit investigations with open-source miniaturized microscopes: Past, present and future.
.
Front Cell Neurosci
.
2019;
;
13
:
:1.
–
12
.
12.
Zong
W
,
Wu
R
,
Chen
S
,
et al
.
Miniature two-photon microscopy for enlarged field-of-view, multi-plane and long-term brain imaging.
.
Nat Methods
.
2021;
;
18
:
:46.
–
9
.
13.
Szabo
V
,
Ventalon
C
,
De Sars
V
,
et al.
Spatially selective holographic photoactivation and functional fluorescence imaging in freely behaving mice with a fiberscope.
.
Urology
.
2014;
;
84
:
:1157.
–
1169
.
14.
Accanto
N
,
Blot
FGC
,
Lorca-Cámara
A
,
et al
.
A flexible two-photon fiberscope for fast activity imaging and precise optogenetic photostimulation of neurons in freely moving mice.
.
Neuron
.
2023;
;
111
:
:176.
–
89.e6
.
15.
Antonini
A
,
Sattin
A
,
Moroni
M
,
et al
.
Extended field-of-view ultrathin microendoscopes for high-resolution two-photon imaging with minimal invasiveness in awake mice.
.
eLife
.
2020;
;
9
:
:e58882.
.
16.
Ozbay
BN
,
Futia
GL
,
Ma
M
,
et al.
Three dimensional two-photon brain imaging in freely moving mice using a miniature fiber coupled microscope with active axial-scanning.
.
Sci Rep
.
2018;
;
8
:
:1.
–
14
.
|