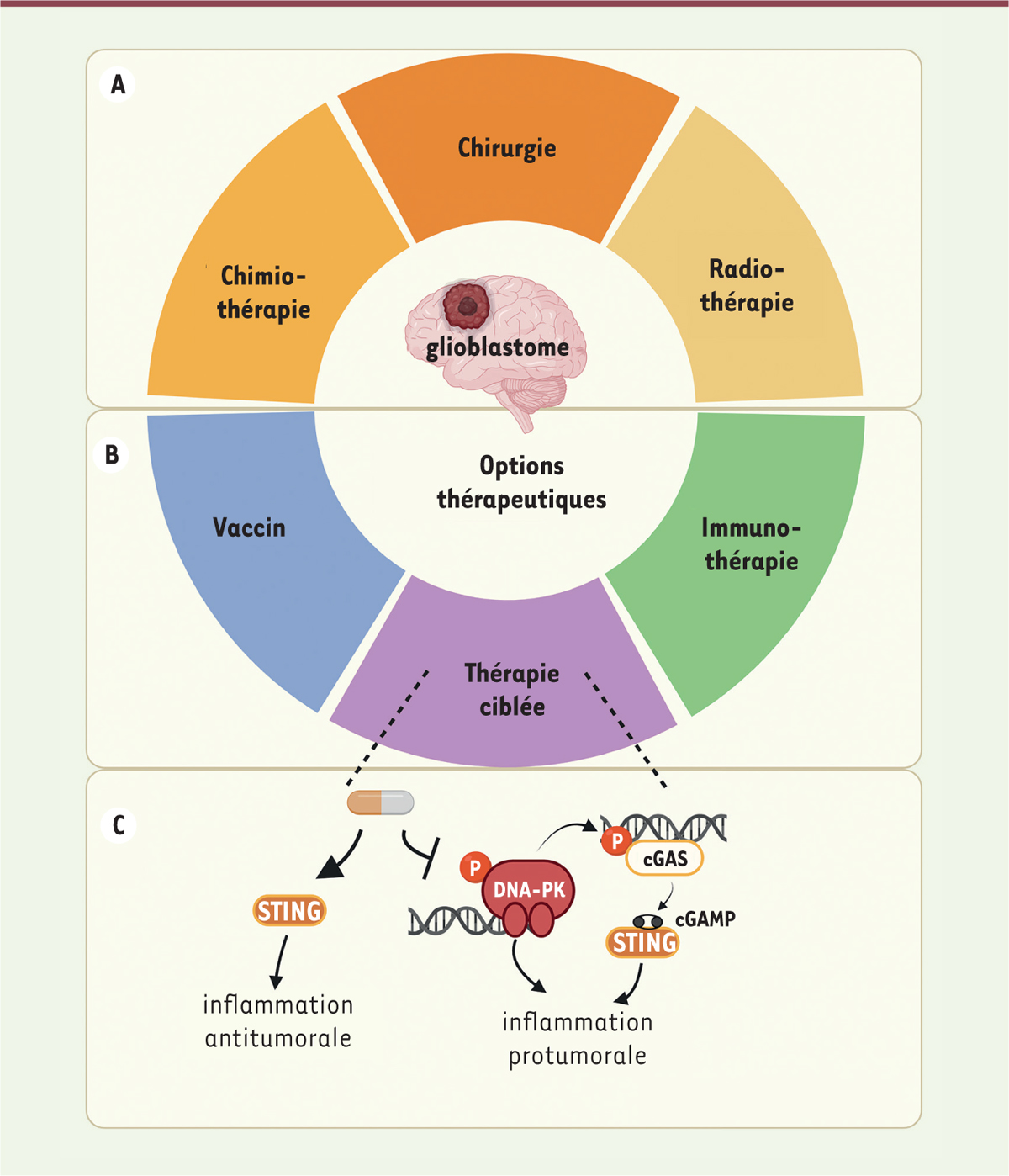
Le glioblastome est une tumeur cérébrale agressive et invasive formée à partir des cellules gliales. Il appartient à la famille des gliomes (qui sont les plus fréquents cancers primitifs du cerveau), dont il est le stade le plus avancé et le plus meurtrier chez l’adulte. Les traitements actuels impliquent généralement une résection chirurgicale associée à la radiothérapie et à la chimiothérapie ( Figure 1A ) . Néanmoins, le risque de récidive est très élevé, et le pronostic reste sombre, avec une survie médiane des patients d’environ 15 mois.
| Figure 1.
Vers une thérapie ciblée du glioblastome ? A.
Les principales options thérapeutiques conventionnelles du glioblastome comprennent une combinaison de résection chirurgicale, radiothérapie et chimiothérapie.
B.
De nouvelles approches, telles que l’immunothérapie, la vaccination ou l’utilisation d’agonistes de la protéine stimulatrice des gènes de l’interféron (STING) pour stimuler l’immunité antitumorale, ont donné des résultats prometteurs dans des études précliniques.
C.
Nos résultats indiquent que la protéine kinase dépendante de l’ADN (DNA-PK) stimule l’activité de la GMP-AMP cyclique (cGAMP) synthase (cGAS), ce qui entraîne une inflammation pro-tumorale plus importante dans les gliomes de haut grade. Nous proposons donc d’utiliser des inhibiteurs de DNA-PK pour bloquer cette inflammation (figure créée par Biorender).
|
Le cerveau contient des cellules immunitaires particulières : les cellules de la microglie. Ces cellules myéloïdes, susceptibles d’être polarisées en cellules anti-inflammatoires ou pro-inflammatoires, influencent favorablement ou défavorablement la croissance tumorale. Le glioblastome est infiltré par des cellules microgliales qui promeuvent la croissance tumorale par de nombreux mécanismes, dont la sécrétion de cytokines et de chimiokines immunosuppressives [ 1 ]. Diverses stratégies thérapeutiques récentes en cancérologie, notamment celles fondées sur l’administration d’anticorps monoclonaux, d’immunomodulateurs, ou sur des approches vaccinales, tentent de réactiver la réponse immunitaire anti-tumorale pour obtenir la reconnaissance et la destruction des cellules tumorales par les cellules immunitaires [ 2 ] ( Figure 1B ) . Cependant, de nombreux patients ou types de cancer sont réfractaires à ces traitements. C’est le cas des glioblastomes, contre lesquels les approches d’immunothérapie se sont avérées inefficaces à ce jour [ 2 ].
Des stratégies ont été proposées afin de potentialiser l’efficacité des immunothérapies, parmi lesquelles la stimulation des réponses inflammatoires associées aux acides nucléiques occupe une place de choix. En effet, il a été montré que l’activation d’une voie de signalisation impliquant le récepteur cGAS (GMP-AMP cyclique synthase) et la protéine adaptatrice STING (stimulateur des gènes de l’interféron), qui détecte les acides nucléiques présents dans le cytosol, a un effet synergique avec les chimiothérapies, radiothérapies et immunothérapies [ 3 ]. Le potentiel thérapeutique de l’activation de cette voie dans le traitement du cancer fait donc l’objet de nombreux travaux de recherche [ 4 , 5 ] ( → ).
(→) Voir la Synthèse de R. Chanut et V. Petrilli, m/s n° 6-7, juin-juillet 2019, page 527, et la Nouvelle de H. Bacar et M.C. Michallet, m/s n° 6-7, juin-juillet 2021, page 677
Aussi, souhaitions-nous approfondir la compréhension des mécanismes qui sous-tendent les réactions inflammatoires dans le glioblastome, ainsi que celle du rôle de la voie cGAS-STING dans l’évolution des gliomes vers ce stade [ 6 ].
La voie cGAS-STING est généralement activée en présence d’acides nucléiques anormaux, étrangers à la cellule ou mal localisés (par exemple, lorsqu’ils sont cytosoliques). La reconnaissance de ces espèces moléculaires implique la protéine cGAS, qui produit alors un messager secondaire, le GMP-AMP cyclique (cGAMP), qui à son tour active STING. L’activation de STING entraîne la formation d’un complexe de signalisation qui orchestre une réponse cytokinique portant une signature particulière de production d’interférons de type I. L’activation de cette voie de signalisation jouant un rôle important dans l’activation de la réponse antitumorale, il n’est pas surprenant que l’expression des différents acteurs de cette voie soit réprimée dans certaines tumeurs. C’est notamment le cas pour certains mélanomes et cancers colorectaux, ou pour les gliomes [ 6 – 8 ].
Dans le contexte du glioblastome, la protéine kinase dépendante de l’ADN (DNA-PK), normalement impliquée dans la réparation des dommages à l’ADN, permet une réponse inflammatoire en présence d’ADN cytosolique, notamment lorsque les cellules sont confrontées à un stress génotoxique [ 6 ]. D’une part, ce complexe de réparation de l’ADN favorise des réponses inflammatoires indépendantes de cGAS, en activant directement des facteurs de transcription contrôlant la production de cytokines. D’autre part, la DNA-PK potentialise l’activation de cGAS, ce qui augmente la production de cGAMP ( Figure 1C ) . La synergie de ces mécanismes augmente les réponses inflammatoires lorsque cGAS et DNA-PK sont présentes. La coopération entre ces deux voies de signalisation favorise le recrutement de cellules microgliales dans le microenvironnement tumoral dans un modèle de glioblastome [ 6 ]. Ce recrutement tumoral accru de cellules immunitaires lorsque cGAS est présent dans les cellules tumorales entrave les étapes précoces de la croissance tumorale. Par ailleurs, nous avons montré que plus les gliomes évoluent vers le stade glioblastome, plus le niveau d’expression de cGAS et DNA-PK est augmenté.
En nous fondant sur nos résultats expérimentaux, nous suggérons que l’analyse de la présence et de la fonctionnalité de la voie cGAS-STING est essentielle pour l’orientation thérapeutique des patients présentant un glioblastome. Lorsque cGAS est absent, il pourrait être préférable de stimuler STING pour favoriser la régression de la tumeur. À cet égard, l’utilisation d’agonistes de STING pourrait représenter une voie thérapeutique prometteuse [ 9 ]. Au contraire, lorsque cGAS est présent et favorise une inflammation chronique pro-tumorale, il pourrait convenir de l’inhiber ( Figure 1C ) .
Ainsi, nous suggérons que la signalisation dépendante de cGAS est acquise au cours de la progression tumorale, et que le ciblage de cette voie ne peut être efficace contre le glioblastome que si une stratification des patients est établie, fondée sur la présence de ce récepteur, mais aussi de la protéine DNA-PK, qui pourrait aussi être ciblée pour inhiber ou activer les réponses inflammatoires en fonction du statut inflammatoire de la tumeur. Des inhibiteurs de DNA-PK ont d’ailleurs été utilisés dans des études précliniques sur le glioblastome avec des résultats prometteurs [ 10 – 12 ], et plusieurs essais cliniques sont en cours (NCT01353625, NCT02977780 et NCT04555577).