| |
| Med Sci (Paris). 39(10): 787–789. doi: 10.1051/medsci/2023107.Du nouveau dans l’administration orale de médicaments Une capsule aux allures d’œuf de Pâques Kimberley Dauvergne,1a Kami Chahine,1b Solal Bellaiche,2c and Claire Deligne3d 1M2 Immunologie translationnelle et biothérapies, Sorbonne université
,
75005
,
France 2M2 Immunologie intégrative et systématique, Sorbonne université
,
75005
,
France 3Université de Paris, institut Cochin, CNRS, Inserm
,
Paris
,
France MeSH keywords: Humains, Administration par voie orale, Capsules |
L’essor récent des biothérapies s’accompagne d’un questionnement sur leur voie d’administration, la plupart de ces traitements présentant l’inconvénient de ne pouvoir être administrés que par voie parentérale et non par voie orale, pour des raisons pharmacocinétiques principalement [
1
]. En effet, cette dernière est difficilement utilisable car elle présente plusieurs contraintes pour ces médicaments, qui seront en partie dégradés dans l’estomac à cause de la baisse du pH qu’ils y rencontrent et de la présence d’enzymes protéolytiques dans cet organe [
2
]. De plus, le mucus et la barrière épithéliale limitent et ralentissent leur absorption [
3
]. À titre d’exemple, sans formulation particulière, la biodisponibilité de l’insuline [
4
] et du GLP-1 (
glucagon-like peptide-1
) [
5
] par voie orale est quasi nulle. Les chercheurs tentent de répondre à cette question depuis un siècle, la première tentative d’administration orale d’insuline datant des années 1920 [
2
] ! Actuellement, différentes approches sont en cours de développement, telles que les dispositifs de pilule robotique [
6
], les liquides ioniques [
7
] et les microparticules ou nanoparticules [
8
,
9
]. De plus, les patients sont demandeurs d’une forme galénique orale, plus simple d’emploi et moins invasive [
10
], qui limiterait également la sollicitation des soignants et s’accompagnerait d’une meilleure observance.
C’est dans cette optique que l’équipe d’Abramson
et al.
a imaginé une solution permettant d’allier l’efficacité pharmacocinétique des injections avec la facilité des prises orales : ces chercheurs ont ainsi développé un dispositif ingérable en forme de gélule contenant une dose de médicament auto-injectable dans la paroi gastrique. Leur article présente ce dispositif, nommé L-SOMA
(liquid self-orienting millimeter-scale applicator)
, qui permet la délivrance et l’absorption rapide d’une dose de substance active, protégée de la dégradation [
11
].
|
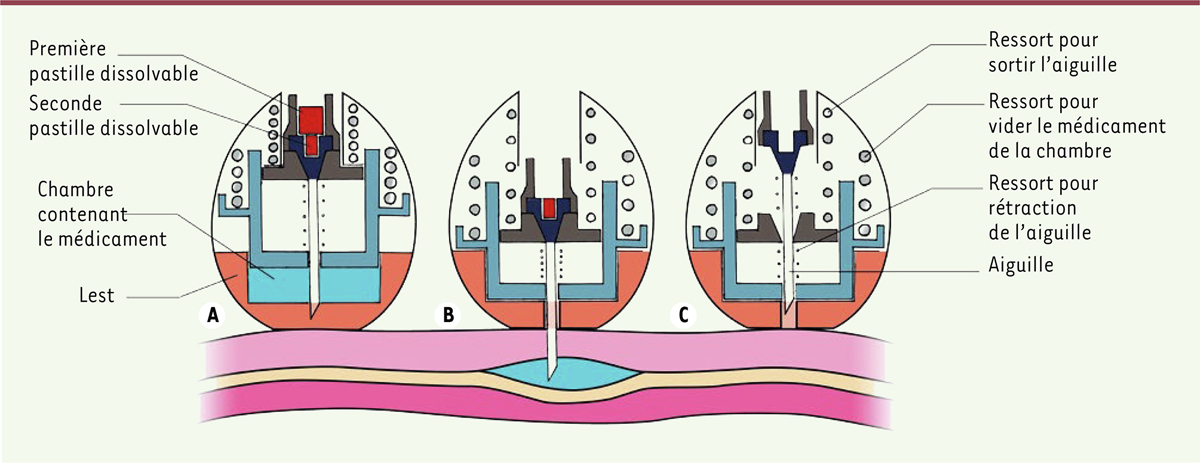
Comment fonctionne ce dispositif ?
Le L-SOMA est une capsule de 12 mm sur 15 mm, ce qui correspond à la taille d’une gélule classique pour un homme ou une femme adultes. Elle présente une coque en surface s’inspirant des carapaces de tortue et une partie inférieure lestée, rappelant le centre de gravité des jouets culbuto. Cette géométrie particulière lui permet de s’auto-positionner de manière à ce que le mécanisme d’injection se présente toujours face à la muqueuse gastrique (
Figure 1
).
 | Figure 1.
Schéma en coupe longitudinale du dispositif L-SOMA positionné sur la muqueuse gastrique (A)
, après activation de l’aiguille et délivrance du médicament (
B
) et après rétraction de l’aiguille (
C
).
|
La capsule est composée d’une chambre contenant le médicament, d’une aiguille, de trois ressorts et de deux pastilles composées d’isomalt, un sucre dissoluble au contact prolongé de l’eau (
Figure 1a
). Une fois le L-SOMA positionné dans l’estomac, le liquide gastrique dissout la première pastille, libérant successivement les deux premiers ressorts (
Figure 1b
) permettant à l’aiguille de pénétrer la paroi jusqu’à la sous-muqueuse, puis de vider le contenu de la chambre. Le découplage de ces deux actions permet d’injecter la totalité de la dose dans le tissu. La deuxième pastille, alors exposée, se dissout et permet l’action du troisième ressort qui rétracte l’aiguille (
Figure 1c
). Les auteurs ont déterminé que la profondeur idéale d’injection était de 4,5 mm, correspondant à la sous-muqueuse et permettant une absorption optimale, contrairement à la muqueuse dans laquelle la solution fuit vers la lumière gastrique et sera donc dégradée.
|
Biodisponibilité par voie orale grâce au dispositif L-SOMA : rêve ou réalité ?
Pour déterminer l’efficacité de leur dispositif, les chercheurs ont administré à des porcs divers médicaments : l’adalimumab (4 mg), un anticorps monoclonal humain anti-TNF-α (
tumor necrosis factor alpha
) utilisé dans certaines maladies inflammatoires chroniques comme la maladie de Crohn ; l’insuline (4 U.I.) et un analogue de GLP-1 (4 mg), des hormones régulant la glycémie, utilisées dans le traitement du diabète ; et l’adrénaline (0,24 mg), une hormone augmentant la pression artérielle, la fréquence et le volume d’éjection cardiaque.
Les auteurs ont choisi ces substances car (1) les trois premières sont largement prescrites, (2) l’insuline et l’adrénaline ont une action biologique facilement mesurable, (3) l’adalimumab permet de tester un anticorps monoclonal, ce type de molécule prenant une place croissante dans l’arsenal thérapeutique de nombreuses maladies. Dans une première expérience, à l’aide d’un endoscope, ils ont placé le dispositif L-SOMA dans l’estomac de huit porcs sous anesthésie générale et ont observé que l’activation du dispositif s’était produite en quatre minutes environ, ce qui laissait le temps au dispositif de se positionner correctement. Dans une seconde expérience, ils ont administré une capsule de L-SOMA à 31 porcs. Les concentrations sanguines des médicaments ont été mesurées, puis comparées aux concentrations obtenues après des injections sous-cutanées ou intra-musculaires chez des porcs témoins. L’insuline, l’analogue de GLP-1 et l’adrénaline étaient détectables dans le plasma de ces porcs dans les quinze minutes suivant l’administration par L-SOMA, contre une heure pour l’adalimumab, dont le poids moléculaire explique une plus lente biodisponibilité. Au total, les médicaments étaient détectables dans le sang de 90 % des animaux ayant reçu le dispositif. Les concentrations sanguines des différents médicaments étaient similaires entre les administrations par L-SOMA et les injections par voies sous-cutanée ou intramusculaire. Par exemple, sur une période d’échantillonnage de deux heures, la biodisponibilité de l’insuline administrée par L-SOMA était de 51 +/- 16 %, et de 57 +/- 8 % lorsqu’elle était administrée par voie sous-cutanée. Par ailleurs, l’administration d’insuline générait une diminution de la glycémie de même amplitude et avec le même délai dans les deux groupes. De même, l’élévation de la fréquence cardiaque induite par l’adrénaline était comparable. Ces résultats démontrent que ces protéines, administrées par L-SOMA, sont toujours biologiquement actives. |
Tolérance et sécurité : a-t-on vraiment envie d’ingérer une aiguille ? La présence dans le tube digestif d’un dispositif doté d’une aiguille soulève la question de la tolérance et de la sécurité.
Si la douleur est difficilement quantifiable chez ces animaux, les auteurs rapportent des habitudes alimentaires et des comportements normaux après ingestion du L-SOMA. L’observation endoscopique
a posteriori
n’a montré que des saignements mineurs et spontanément résolutifs, induits par l’aiguille du dispositif chez certains animaux. Par ailleurs, l’administration d’insuline via le dispositif pendant trois jours d’affilée, chez trois porcs, n’a pas montré de conséquences hémorragiques ou traumatiques, confirmant la sécurité du dispositif.
Enfin, pour pallier le fait que les porcs utilisés jusqu’ici étaient sous anesthésie générale et pour se rapprocher des conditions réelles d’utilisation, les chercheurs ont administré un dispositif semblable à L-SOMA à des chiens éveillés. Grâce à des radiographies répétées, ils ont observé que la capsule s’activait bien dans l’estomac et traversait l’intégralité du tractus gastro-intestinal. |
Conclusion et perspectives Cette étude a démontré que le dispositif L-SOMA était capable de délivrer divers médicaments de masses moléculaires différentes, avec une pharmacocinétique comparable avec celle d’une injection classique, et sans risques significatifs pour l’intégrité du tractus gastro-intestinal.
Concernant l’évacuation de la capsule, il a déjà été démontré que des objets pointus de moins d’un centimètre peuvent traverser le tractus gastro-intestinal en toute sécurité [
4
,
12
]. Le système de rétraction de l’aiguille permet de limiter d’autant plus le risque de lésions tissulaires pendant le passage du dispositif dans le tractus. Des études cliniques devront être menées pour évaluer les effets de L-SOMA chez l’homme et la femme adultes et les potentiels impacts des variations interindividuelles anatomiques et physiologiques sur l’action du dispositif.
Il est toutefois à noter que la dose d’adalimumab délivrée par le L-SOMA était de 4 mg alors que les posologies usuelles sont de l’ordre de 40 à 80 mg pour un adulte et par injection ; il est donc indispensable que le dispositif L-SOMA soit adapté en conséquence pour ce type de doses de principe actif. Parmi les solutions envisageables, il pourrait être possible d’augmenter l’activité spécifique, ou/et la concentration de la substance active ou de procéder à de multiples prises. La réponse immunitaire des muqueuses est souvent tolérogène, ce qui pourrait être un atout dans le cadre d’immunothérapies ou de vaccins visant à soigner les maladies auto-immunes ou inflammatoires. Par ailleurs, si une diffusion locale est à préférer pour des maladies intestinales telles que la maladie de Crohn, une biodisponibilité rapide est indispensable, comme dans le cas de l’insuline dans le traitement du diabète par exemple. Des études approfondies doivent donc être menées pour déterminer à quel type de maladie le dispositif pourrait être applicable. Le L-SOMA a donc un réel potentiel thérapeutique, étant moins invasif pour le patient et aussi efficace qu’une injection (par voie sous-cutanée ou intramusculaire) pour distribuer un médicament de façon systémique. Les questions qui restent en suspens sont celles de la possibilité d’augmenter la dose de médicament dans la capsule et du coût d’un tel dispositif. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Ahadian
S
,
Finbloom
JA
,
Mofidfar
M
,
et al
.
Micro and nanoscale technologies in oral drug delivery.
.
Adv Drug Deliv Rev.
2020;
;
157
:
:37.
–
62
.
2.
Durán-Lobato
M
,
Niu
Z
,
Alonso
MJ
.
Oral Delivery of Biologics for Precision Medicine.
.
Advanced Materials.
2020;
;
32
.
3.
Anselmo
AC
,
Gokarn
Y
,
Mitragotri
S
.
Non-invasive delivery strategies for biologics.
.
Nat Rev Drug Discov.
2018;
;
18
:
:19.
–
40
.
4.
Abramson
A
,
Caffarel-Salvador
E
,
Khang
M
,
et al.
An ingestible self-orienting system for oral delivery of macromolecules.
.
Science.
2019;
;
363
:
:611.
–
615
.
5.
Buckley
ST
,
Baekdal
TA
,
Vegge
A
,
et al
.
Transcellular stomach absorption of a derivatized glucagon-like peptide-1 receptor agonist.
.
Sci Translat Med.
2018;
;
7047
.
6.
Dhalla
AK
,
Al-Shamsie
Z
,
Beraki
S
,
et al
.
A robotic pill for oral delivery of biotherapeutics: safety, tolerability, and performance in healthy subjects.
.
Drug Deliv Transl Res.
2022;
;
12
:
:294.
–
305
.
7.
Banerjee
A
,
Ibsen
K
,
Brown
T
,
et al.
Ionic liquids for oral insulin delivery.
.
Proc Natl Acad Sci USA.
2018;
;
115
:
:7296.
–
7301
.
8.
Mathiowitz
Edith
,
Jacob
Jules S.
,
Jong
Yong S.
,
et al.
Biologically erodable microspheres as potential oral drug delivery systems.
.
Nature.
1997;
;
386
:
:410.
–
414
.
9.
Lamson
NG
,
Berger
A
,
Fein
KC
,
et al
.
Anionic nanoparticles enable the oral delivery of proteins by enhancing intestinal permeability.
.
Nat Biomed Eng.
2020;
;
4
:
:84.
–
96
.
10.
Boye
KS
,
Matza
LS
,
Walter
KN
,
et al.
Utilities and disutilities for attributes of injectable treatments for type 2 diabetes.
.
Eur J Health Econom.
2011;
;
12
:
:219.
–
230
.
11.
Abramson
A
,
Frederiksen
MR
,
Vegge
A
,
et al
.
Oral delivery of systemic monoclonal antibodies, peptides and small molecules using gastric auto-injectors.
.
Nat Biotechnol.
2022;
;
40
:
:103.
–
9
.
12.
Traverso
G
,
Schoellhammer
CM
,
Schroeder
A
,
et al.
Microneedles for drug delivery via the gastrointestinal tract.
.
J Pharm Sci.
2015;
;
104
:
:362.
–
367
.
|