| |
| Med Sci (Paris). 39(10): 738–743. doi: 10.1051/medsci/2023123.L’anesthésie, un processus commun à tout le vivant Lucia Sylvain-Bonfanti,1,2* Julien Page,1* Delphine Arbelet-Bonnin,1 Patrice Meimoun,1,3 Étienne Grésillon,2 François Bouteau,1 and Patrick Laurenti1$ 1Université Paris-Cité, laboratoire interdisciplinaire des énergies de demain (LIED UMR 8236)
,
Paris
,
France 2Université Paris-Cité, laboratoire dynamiques sociales et recomposition des espaces (LADYSS UMR 7533)
,
Paris
,
France 3Sorbonne université
,
Paris
,
France |
Vignette (© Patrick Laurenti).
La maîtrise des techniques d’anesthésie au
xix
e
siècle a rapidement révolutionné la médecine, au point d’en devenir d’un emploi banalisé. Du patch de lidocaïne appliqué avant une injection à une anesthésie générale par inhalation (éther, protoxyde d’azote, etc.) ou par injection (fentanyl, propofol, etc.), qui n’a pas expérimenté de nos jours une anesthésie ? Paradoxalement, les mécanismes qui sous-tendent son effet demeurent mal compris. Les avancées remarquables permises par l’anesthésie en médecine humaine ou en médecine vétérinaire ont peu à peu masqué, aux yeux du grand public comme à ceux des spécialistes, le fait que, loin d’être une spécificité des espèces animales (Metazoa), la capacité à être anesthésié est une caractéristique qui s’étend à l’ensemble des êtres vivants.
Après avoir fait rapidement le point sur les théories de l’anesthésie, nous donnerons un aperçu de l’étonnante diversité des espèces susceptibles d’être anesthésiées. Nous nous pencherons sur le regain d’intérêt récent pour l’anesthésie chez des espèces très éloignées du monde animal, en portant une attention particulière aux plantes. L’intérêt actuel pour ces nouveaux modèles suscite l’espoir d’avancées significatives, tant sur le développement de nouvelles molécules anesthésiques que sur notre compréhension théorique de ce phénomène commun à l’ensemble du vivant. |
L’anesthésie, un processus dont les mécanismes sont encore mal compris
Dès le
ix
e
siècle, des élixirs à base de plantes ont été utilisés pour éviter la douleur. Plus tard, le médecin botaniste allemand Valerius Cordus (1515-1544) synthétisera ce qu’il appellera l’« huile douce de vitriol », par distillation d’un mélange de vitriol (l’acide sulfurique) et d’« esprit de vin » (l’éthanol). Par la suite, le médecin philosophe suisse Paracelse (1493-1581) (de son vrai nom, Theophrast Bombast von Hohenheim) découvre les propriétés anesthésiantes de ce qui sera appelé éther. Mais ce n’est qu’en 1846 que le chirurgien américain William T. Morton (1819-1868) utilisera les effets anesthésiants rapides et réversibles de l’éther pour une intervention chirurgicale chez l’espèce humaine (
Homo sapiens
). Cette application a rapidement révolutionné la médecine. Pourtant, les mécanismes qui en sous-tendent les effets se sont avérés difficiles à expliquer [
1
].
Dans les années 1870, à la suite de ses travaux pionniers, Claude Bernard (1813-1878) proposa que les anesthésiques agissent par « semi-coagulation » des protéines [
2
]
1,
. Il fut cependant rapidement remarqué que l’efficacité des anesthésiques était corrélée à leur lipophilie. L’Allemand Hans Horst Meyer (1853-1939), en 1899, puis le Britannique Charles Ernest Overton (1865-1933), en 1901, proposèrent une autre théorie selon laquelle les anesthésiques agiraient de façon aspécifique, en se dissolvant dans la membrane lipidique des cellules [
1
,
2
]. Au cours des trois dernières décennies, cette théorie de la solubilité lipidique non spécifique a cependant été remise en cause, lorsqu’il fut montré que les anesthésiques agissaient en fait par l’intermédiaire de protéines spécifiques [
3
], notamment des canaux ioniques qui contrôlent l’excitabilité neuronale. Plus récemment, des études ont montré que les anesthésiques généraux, tels que le chloroforme, l’isoflurane, le diéthyl-éther, le xénon ou le propofol, contrôlent l’activité de ces canaux ioniques en activant une phospholipase impliquée dans la désagrégation des radeaux lipidiques membranaires dans lesquels ces canaux ioniques sont intégrés [
4
]. Les anesthésiques agissent également sur des courants calciques, des flux qui modulent l’inhibition (la potentialisation de la transmission du GABA [acide gamma-aminobutyrique]) ou l’excitation (l’inhibition des récepteurs NMDA [acide N-méthyl-D-aspartique]) synaptiques [
5
,
6
].
Notre compréhension de l’anesthésie reste cependant partielle, car les anesthésiques semblent avoir des effets sur de nombreuses autres protéines, récepteurs et canaux [
6
]. Par exemple, leurs propriétés d’immobilisation ne reposent peut-être pas uniquement sur les récepteurs GABA [
7
]. Une étude récente montre que l’effet anesthésique du xénon pourrait dépendre du spin de son noyau
2
[
8
], relançant le débat sur l’hypothèse controversé selon laquelle la conscience pourrait reposer sur des mécanismes quantiques [
9
]. Quoi qu’il en soit, les différents anesthésiques ne semblent agir, ni de la même façon, ni sur les mêmes cibles moléculaires. Définir les actions des anesthésiques aux niveaux moléculaire et cellulaire des réseaux neuronaux reste donc considéré comme la condition
sine qua non
pour comprendre l’ensemble complexe de leurs effets cliniques : inconscience, amnésie, analgésie et immobilité.
|
L’ensemble des êtres vivants est anesthésiable
Quelles que soit leurs cibles primaires, les anesthésiques ont pour effet général d’entraîner, chez les animaux, le blocage de la propagation des potentiels d’action en inhibant des canaux sodiques dépendants du voltage (NaV) [
10
] et des canaux calciques dépendants du voltage (CaV) qui contrôlent l’excitabilité cellulaire [
6
].
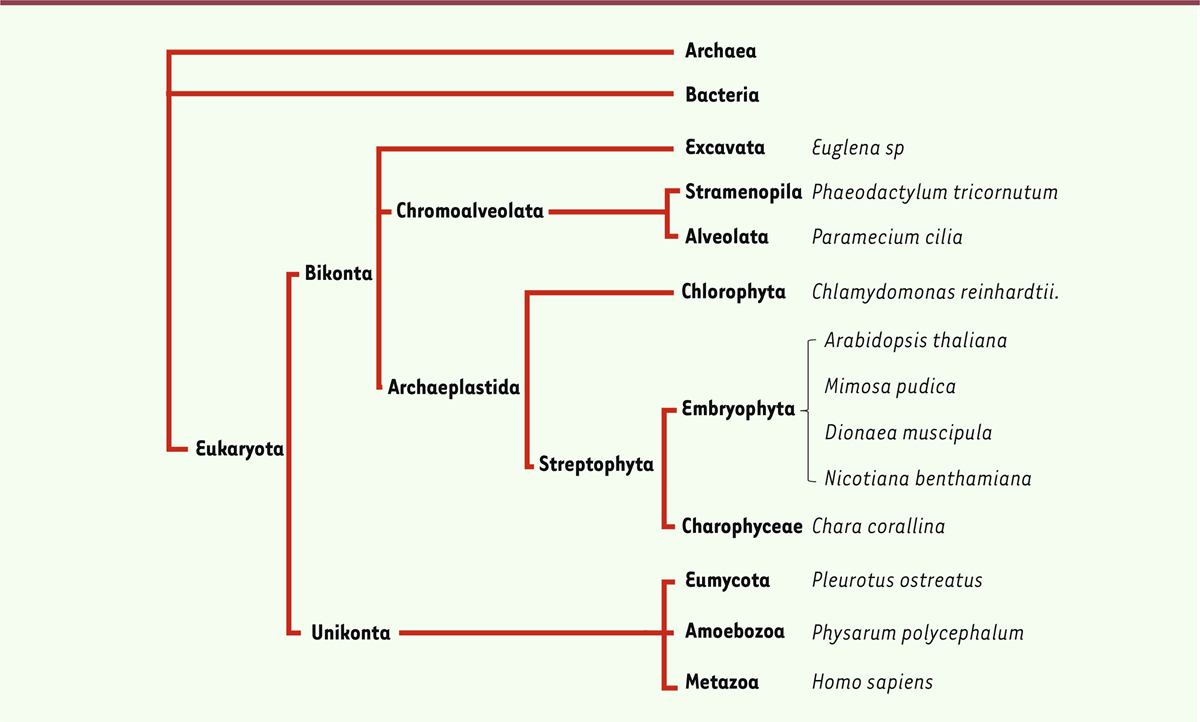
Cette famille de canaux dépendants du voltage, constitués de protéines à quatre domaines transmembranaires (4D-CaV/NaV), trouve ses racines très antérieurement dans l’arbre du vivant (
Figure 1
). Des orthologues des gènes les codant sont en effet retrouvés chez les Archaea (archées) et chez les Bacteria (bactéries) sous la forme de tétramères d’un canal constitué d’un seul domaine. Ils dérivent tous d’un canal ancestral commun, vraisemblablement un canal potassique dépendant du voltage [
11
–
13
]. Les gènes codant cette famille de canaux ne sont donc pas restreints aux animaux et sont largement distribués dans la diversité des Eukaryota (eucaryotes) [
14
–
16
]. Ils sont ainsi présents chez les principales lignées de phytoplanctons eucaryotes, y compris les membres unicellulaires des Archaeplastida, tels que des Chlorophyta, comme
Chlamydomonas sp.,
ou des Chromoalveolata, comme les
Phaeodactylum tricornutum
(diatomées), ou des Excavata, comme les
Euglena sp.
[
16
]. Chez les eucaryotes, la fonction ancestrale de ces canaux dépendants du voltage était liée au calcium. L’acquisition de la sensibilité au sodium est ensuite apparue chez les métazoaires, indépendamment de celle qui a eu lieu chez les bactéries [
17
].
 | Figure 1.
Relations phylogénétiques des espèces évoquées dans cette revue.
Les noms des espèces et des groupes d’espèces, mentionnés ici selon la nomenclature internationale (de même que lors de leur première évocation), ont été ensuite francisés dans le texte afin d’en alléger la lecture.
|
L’omniprésence des canaux Na
+
/Ca
2+
permet à l’ensemble des organismes vivants l’utilisation de signalisations fondées sur des flux électriques. Chez les bactéries, des influx de Ca
2+
sont induits par dépolarisation, comme c’est le cas des potentiels d’action des animaux [
18
]. De tels potentiels d’action ont aussi été enregistrés dans les biofilms que forment les bactéries [
19
], de même qu’une signalisation électrique à longue distance, qui pourraient coordonner l’activité métabolique et la croissance de ces biofilms [
20
]. Générer une signalisation reposant sur le Ca
2+
, et la capacité de la décoder, représentent donc une caractéristique ancienne et commune à l’ensemble des êtres vivants. Elle était présente chez le dernier ancêtre commun des eucaryotes (LECA pour
Last Eukaryotic Common ancestor
), bien avant la séparation entre Unikonta (unicontes) et Bikonta (bicontes)
3,
[
18
,
21
].
Ces observations montrant l’existence de canaux ioniques et leur capacité à transmettre une information chez différents organismes offrent ainsi un support permettant d’expliquer que toute forme de vie pourrait être anesthésiée [
1
]. Ces effets sont, bien sûr, difficiles à mettre en évidence chez des organismes dépourvus de noyaux. En revanche, chez les eucaryotes, l’effet des anesthésiques est plus facilement observable ou mesurable.
En dehors des animaux, les anesthésiques ont montré leur efficacité chez de nombreuses espèces d’eucaryotes, tant chez des unicontes comme les champignons (Eumycota) et les amibes (Amoebozoa) que chez des bicontes. Chez le champignon
Pleurotus ostreatus
, le chloroforme inhibe la signalisation électrique qui se propage le long de ses hyphes. C’est aussi le cas chez l’amibe géante syncitiale
Physarum polycephalum
[
22
]. Chez les bicontes, les anesthésiques abolissent également les mouvements rapides de certains Streptophyta, notamment des Embryophyta, comme les dionées
4,
Dionaea muscipula
et la sensitive
5
Mimosa pudica
. Ils agissent aussi sur la motilité de microorganismes unicellulaires de divers groupes, tels que les Chlorophyta, comme
Chlamydomonas reinhardtii
[
23
], les Alveolata, comme
Paramecium cilia
[
24
], ou les Excavata, comme
Euglena sp.
(observations non publiées).
|
La signalisation électrique chez les plantes
L’absence de canaux sodiques voltage-dépendants 4D-NaV canoniques a souvent été évoquée pour expliquer que la plupart des embryophytes
6,
et des eumycètes
7
ne présentent pas d’excitabilité électrique rapide [
25
]. La perte de fonction de ces canaux, chez des mutants de diatomée, réduit pourtant leur motilité [
25
] et leur absence, chez de nombreux eucaryotes très divergents, semble aussi coïncider avec la perte de leur motilité reposant sur leurs flagelles [
21
].
Chez les embryophytes, il existe plusieurs exemples de communications et de réponses dépendant du Ca
2+
et reposant sur une excitabilité électrique : potentiels d’action, dépolarisations transitoires (
slow wave potential
) et hyperpolarisations globales (
system potential
) [
26
]. Une question est alors de savoir comment cette communication peut être réalisée si les composants responsables du potentiel d’action canonique des animaux sont absents.
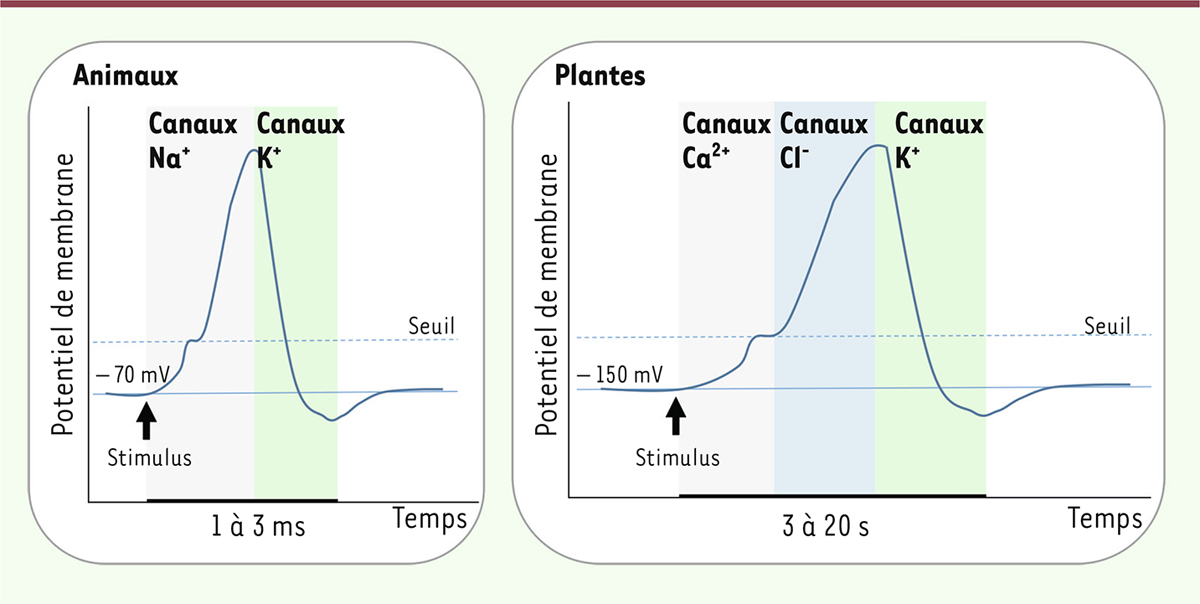
Les plantes, dont les potentiels d’action présentent des similitudes mais aussi des différences avec ceux enregistrés chez les animaux (
Figure 2
), font l’objet d’un regain d’intérêt récent [
27
]. Chez la Charophyta
Chara corallina,
le potentiel d’action, plus lent que le potentiel d’action typique des animaux, implique un influx de Ca
2+
à travers la membrane plasmique des cellules. La dépolarisation est provoquée par l’efflux d’ions chlore (Cl
-
) à travers des canaux Cl
-
qui dépendent du Ca
2+
[
28
]. Chez l’arabette (
Arabidopsis thaliana
), tout comme chez les cellules animales, l’amplitude et la durée du potentiel d’action dépendent de canaux K
+
sortants, de type Kv, qui permettent la repolarisation des cellules [
29
].
 | Figure 2.
Les potentiels d’action chez les animaux et les plantes
. Comparaison chez les animaux (panneau de gauche) et les plantes (panneau de droite) des potentiels d’actions, de la durée du signal et des canaux ioniques impliqués (figure modifiée d’après [
27
]).
|
Bien que plus rares que chez les animaux, des potentiels d’action rapides peuvent être enregistrés chez certaines plantes, comme la dionée. La stimulation des poils sensoriels de la dionée par ses proies entraîne une dépolarisation très rapide de la membrane plasmique des cellules du piège, et la propagation d’un potentiel d’action à travers le tissu de la glande qui tapisse l’intérieur du piège [
30
]. L’activation de canaux Cl
-
mécanosensibles, MSL10 (
mechanosensitive channel of small conductance
), induit la dépolarisation rapide du potentiel d’action [
30
] fournissant un autre exemple de substitution du Na
+
par le Cl
-
pour la dépolarisation électrique. Ces potentiels d’action constituent un mécanisme sophistiqué de comptage, étroitement lié à la signalisation du Ca
2+
: deux entraînent la fermeture du piège et emprisonnent la proie ; et cinq sont nécessaires pour produire des enzymes digestives. L’application de glutamate sur le piège provoque directement le signal calcique et le potentiel d’action. Cette excitabilité semble dépendre de l’expression du récepteur du glutamate DmGLR3.6 (Dm pour
Dionaea muscipula
) [
30
]. Deux récepteurs du glutamate, GLR3.3 et GLR3.6, ont été impliqués dans la signalisation électrique et calcique à longue distance chez l’arabette [
31
]. Notons enfin qu’à l’instar des animaux, le GABA semble également être impliqué dans la signalisation électrique à longue distance chez les plantes [
32
].
|
L’anesthésie chez les plantes
Il faut sans doute voir comme une conséquence de notre
cécité au végétal
, comme la décrivent Bouteau
et al.
[
33
], notre oubli que les effets des anesthésiques ont depuis bien longtemps été documentés chez les plantes. Claude Bernard a en effet montré dès 1878 que non seulement l’éther inhibait la germination des graines et la photosynthèse, mais aussi qu’il supprimait, de façon réversible, les mouvements rapides des feuilles de la sensitive, et des pièges de la dionée [
2
,
18
]. De même, Schetzer
et al.
[
30
] ont montré, en 2022, que le traitement de la dionée par l’éther inhibait la propagation du signal électrique calcique déclenchant la fermeture du piège et que les récepteurs du glutamate (GLR) en étaient les probables cibles.
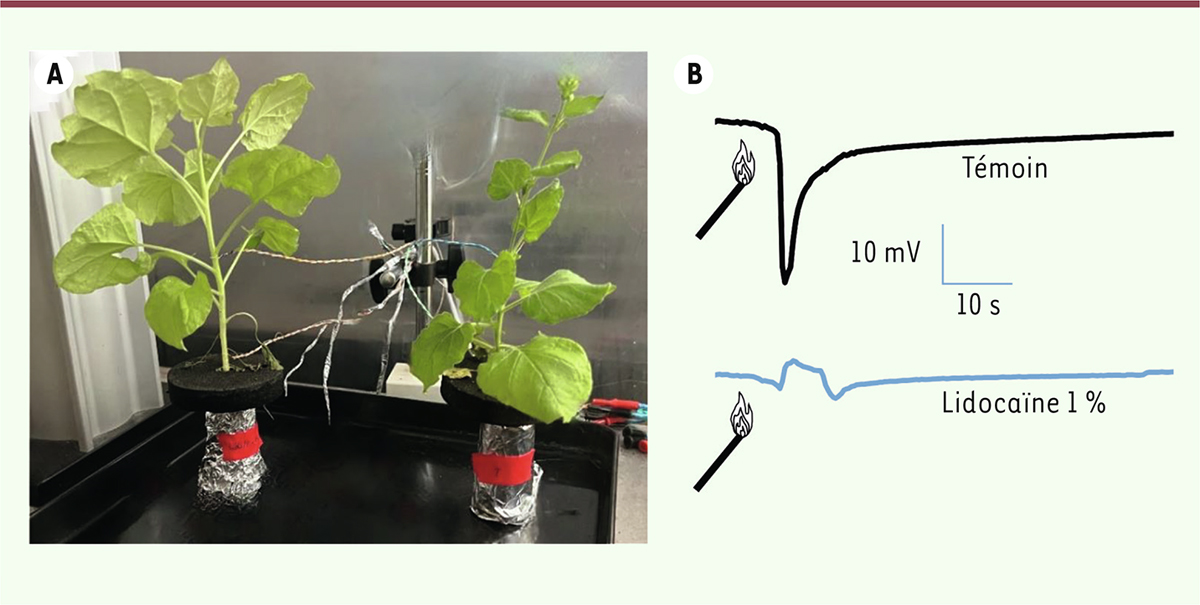
Récemment, nous nous sommes intéressés à la réponse électrique des plantes vis-à-vis de stress violents, tels qu’une piqûre ou une brûlure, et sur la possibilité d’abolir ces réponses par un traitement anesthésiant. En utilisant la lidocaïne, un anesthésique local utilisé chez les animaux, nous avons ainsi montré
(
Figure 3
)
chez le tabac (
Nicotiana benthamiana
) que cet anesthésique inhibe la signalisation électrique induite par une brûlure. La brûlure des feuilles est à l’origine de signaux électriques qui entraînent, tout comme les potentiels d’action, un influx rapide de Ca
2+
[
34
], suivi d’un efflux d’anions dépolarisants et d’un efflux de K
+
repolarisant [
35
]. Le prétraitement des racines de la plante avec de la lidocaïne pendant quelques heures inhibe la signalisation électrique à longue distance après brûlure.
 | Figure 3.
Inhibition par la lidocaïne de la signalisation électrique induite par la brûlure des feuilles de tabac (Nicotiana benthamiana). A.
Des électrodes sont insérées dans les tiges de jeunes plants de tabac afin d’enregistrer les signalisations électriques à longue distance induites par les brûlures. Le maintien des plants en hydroponie (sans terre) permet d’effectuer les mesures en absence ou en présence de lidocaïne.
B.
Réponse électrique à la brûlure en absence de lidocaïne (en haut) et après traitement par cette molécule (en bas).
|
|
La capacité des êtres vivant à être anesthésiés, simple défaut ou capacité adaptative ?
Les organelles subcellulaires, telles que les mitochondries et les chloroplastes, sont sensibles aux anesthésiques. Cela pourrait correspondre à la rétention de sensibilité des membranes et/ou de protéines des bactéries dont ces organelles sont issues [
36
]. L’excitabilité électrique, intimement associée à la génération de signaux Ca
2+
et soutenue par des canaux dépendants du voltage, est donc probablement une fonction ancienne qui a évolué vers des réseaux plus complexes, des réseaux neuromusculaires ou d’autres réseaux de signalisation sophistiqués et rapides que l’on retrouve chez les animaux [
36
].
L’étude de l’anesthésie dans des modèles alternatifs pourrait ainsi permettre de mieux en comprendre les mécanismes et de trouver de nouvelles cibles qui seraient partagées par les animaux. Mais au-delà de ces considérations d’applications potentielles, la perte de sensibilité induite par l’anesthésie, qui est une propriété commune à tous les organismes, demeure une question des plus fascinante de la biologie. En effet, ces observations conduisent à deux hypothèses. La première propose que l’anesthésie serait un simple effet indésirable, un défaut intrinsèque de la structure des canaux ioniques que la sélection naturelle n’a pas pu éliminer sans en altérer le fonctionnement normal. Cela constituerait une version de « l’hypothèse du péché originel », comme l’a formulée Jean-Claude Ameisen [
37
], pour expliquer le maintien, au cours de l’évolution, de la capacité de
suicide cellulaire
qui, elle aussi, implique la dérégulation de canaux ioniques chez les métazoaires comme chez les embryophytes [
38
–
40
]. Dans la seconde hypothèse, la capacité d’anesthésie aurait une origine qui serait profondément enracinée dans les lignées procaryotes et eucaryotes et aurait été conservée car elle conférerait aux cellules un avantage adaptatif.
L’étude de l’anesthésie chez des organismes très éloignés des animaux ouvre donc non seulement des perspectives pour la découverte de nouveaux traitements anesthésiants, mais elle devrait également permettre de mieux comprendre les capacités communes des cellules de l’ensemble du vivant. Outre la problématique de biologie et d’évolution, décrire l’action des anesthésiques sur des modèles aussi différents que les plantes ou les animaux nous semble un outil puissant pour discuter de ce qu’est véritablement la conscience et sa perte face aux effets des anesthésiques [
41
]. Nous formons ainsi l’espoir que cette compréhension du vivant, forgée sur des mécanismes communs, tels que la conscience, nous aidera à poser un regard nouveau sur l’ensemble des espèces, en cette période où les activités anthropiques font peser une menace de disparition sur la biodiversité.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Baluška
F
,
Yokawa
K
,
Mancuso
S
,
et al.
Understanding of anesthesia – Why consciousness is essential for life and not based on genes.
.
Commun Integr Biol.
2016;
;
9
:
:e1238118.
.
2.
Bancroft
WD
,
Richter
GH
.
Claude bernard’s theory of narcosis.
.
Proc Natl Acad Sci USA.
1930;
;
16
:
:573.
–
577
.
3.
Franks
NP
,
Lieb
WR
.
Do general anaesthetics act by competitive binding to specific receptors?
.
Nature.
1984;
;
310
:
:599.
–
601
.
4.
Pavel
MA
Petersen
EN
,
Wang
H
,
et al.
Studies on the mechanism of general anesthesia.
.
Proc Natl Acad Sci USA.
2020;
;
117
:
:13757.
–
66
.
5.
Platholi
J
,
Hemmings
HC
.
Effects of General anesthetics on Synaptic Transmission and Plasticity.
.
Curr Neuropharmacol.
2022;
;
20
:
:27.
–
54
.
6.
Timic
Stamenic T
,
Todorovic
SM
.
Thalamic T-Type Calcium Channels as Targets for Hypnotics and General anesthetics.
.
Int J Mol Sci.
2022;
;
23
:
:2349.
.
7.
Orser
BA
,
Canning
KJ
,
MacDonald
JF
.
Mechanisms of general anesthesia.
.
Curr Opin anesthesiol.
2002;
;
15
:
:427.
.
8.
Li
N
,
Lu
D
,
Yang
L
,
et al.
Nuclear Spin Attenuates the anesthetic Potency of Xenon Isotopes in Mice: Implications for the Mechanisms of anesthesia and Consciousness.
.
anesthesiology.
2018;
;
129
:
:271.
–
277
.
9.
Hameroff
S
,
Penrose
R
.
Consciousness in the universe: A review of the ‘Orch OR’ theory.
.
Phys Life Rev.
2014;
;
11
:
:39.
–
78
.
10.
Yanagidate
F
,
Strichartz
GR
.
Local anesthetics.
. In:
Stein
C
, editor.
analgesia. Handbook of Experimental Pharmacology.
.
Berlin, Heidelberg:
:
Springer;
,
2007
: pp.
:95.
–
127
.
11.
Catterall
WA
,
Zheng
N
.
Deciphering voltage-gated Na+ and Ca2+ channels by studying prokaryotic ancestors.
.
Trends Biochem Sci.
2015;
;
40
:
:526.
–
534
.
12.
Ren
D
,
Navarro
B
,
Xu
H
,
et al.
A Prokaryotic Voltage-Gated Sodium Channel. Science.
2001;
;
294
:
:2372.
–
2375
.
13.
Shimomura
T
,
Yonekawa
Y
,
Nagura
H
,
et al.
A native prokaryotic voltage-dependent calcium channel with a novel selectivity filter sequence.
.
eLife.
2020;
;
9
:
:e52828.
.
14.
Liebeskind
BJ
,
Hillis
DM
,
Zakon
HH
.
Evolution of sodium channels predates the origin of nervous systems in animals.
.
Proc Natl Acad Sci USA.
2011;
;
108
:
:9154.
–
9159
.
15.
Liebeskind
BJ
,
Hillis
DM
,
Zakon
HH
.
Phylogeny unites animal sodium leak channels with fungal calcium channels in an ancient, voltage-insensitive clade.
.
Mol Biol Evol.
2012;
;
29
:
:3613.
–
3616
.
16.
Pozdnyakov
I
,
Matantseva
O
,
Skarlato
S
.
Diversity and evolution of four-domain voltage-gated cation channels of eukaryotes and their ancestral functional determinants.
.
Sci Rep.
2018;
;
8
:
:3539.
.
17.
Liebeskind
BJ
,
Hillis
DM
,
Zakon
HH
.
Independent acquisition of sodium selectivity in bacterial and animal sodium channels.
.
Curr Biol.
2013;
;
23
:
:R948.
–
R949
.
18.
Bruni
GN
,
Weekley
RA
,
Dodd
BJT
,
et al.
Voltage-gated calcium flux mediates Escherichia coli mechanosensation.
.
Proc Natl Acad Sci USA.
2017;
;
114
:
:9445.
–
9450
.
19.
Masi
E
,
Ciszak
Marzena
,
Santopolo
L
,
et al.
Electrical spiking in bacterial biofilms.
.
J R Soc Interface.
2015;
;
12
:
:20141036.
.
20.
Martinez-Corral
R
,
Liu
J
,
Prindle
A
,
et al.
Metabolic basis of brain-like electrical signalling in bacterial communities.
.
Philos Trans R Soc B Bio. Sci.
2019;
;
374
:
:20180382.
.
21.
Edel
KH
,
Marchadier
E
,
Brownlee
C
,
et al.
The Evolution of Calcium-Based Signalling in Plants.
.
Curr Biol.
2017;
;
27
:
:R667.
–
R679
.
22.
Adamatzky
A
,
Gandia
A
.
Fungi anaesthesia.
.
Sci Rep.
2022;
;
12
:
:340.
.
23.
Nishikawa
A
,
Sakamoto
Y
,
Sakatoku
A
,
et al.
Induction of deflagellation by various local anesthetics in Chlamydomonas reinhardtii Dangeard (Chlamydomonadales, Chlorophyceae).
.
Phycol Res.
2010;
;
58
:
:79.
–
87
.
24.
Fujiu
K
,
Nakayama
Y
,
Yanagisawa
A
,
et al.
Chlamydomonas CAV2 Encodes a Voltage- Dependent Calcium Channel Required for the Flagellar Waveform Conversion.
.
Curr Biol.
2009;
;
19
:
:133.
–
139
.
25.
Helliwell
KE
,
Chrachri
A
,
Koester
JA
,
et al.
Alternative Mechanisms for Fast Na+/Ca2+ Signaling in Eukaryotes via a Novel Class of Single-Domain Voltage-Gated Channels.
.
Curr Biol.
2019;
;
29
:
(1503–11)
:e6.
.
26.
Farmer
EE
,
Gao
Y-Q
,
Lenzoni
G
,
et al.
Wound- and mechanostimulated electrical signals control hormone responses.
.
New Phytol.
2020;
;
227
:
:1037.
–
50
.
28.
Johnson
BR
,
Wyttenbach
RA
,
Wayne
R
,
et al.
Action Potentials in a Giant Algal Cell: A Comparative Approach to Mechanisms and Evolution of Excitability.
.
J Undergrad Neurosci Educ.
2002;
;
1
:
:A23.
–
A27
.
29.
Cuin
TA
,
Dreyer
I
,
Michard
E
.
The Role of Potassium Channels in Arabidopsis thaliana Long Distance Electrical Signalling: AKT2 Modulates Tissue Excitability While GORK Shapes Action Potentials.
.
Int J Mol Sci.
2018;
;
19
:
:926.
.
30.
Scherzer
S
,
Huang
S
,
Iosip
A
,
et al.
Ether anesthetics prevents touch-induced trigger hair calcium-electrical signals excite the Venus flytrap.
.
Sci Rep.
2022;
;
12
:
:2851.
.
31.
Toyota
M
,
Spencer
D
,
Sawai-Toyota
S
,
et al.
Glutamate triggers long-distance, calcium-based plant defense signaling.
.
Science.
2018;
;
361
:
:1112.
–
1115
.
32.
Xu
B
,
Sai
N
,
Gilliham M. The emerging role of GABA as a transport regulator and physiological signal.
.
Plant Physiol.
2021;
;
187
:
:2005.
–
16
.
33.
Bouteau
F
,
Grésillon
E
,
Chartier
D
,
et al.
Our sisters the plants? notes from phylogenetics and botany on plant kinship blindness.
.
Plant Signal Behav.
2021;
;
16
:
:2004769.
.
34.
Katicheva
L
,
Sukhov
V
,
Akinchits
E
,
et al.
Ionic Nature of Burn-Induced Variation Potential in Wheat Leaves.
.
Plant Cell Physiol.
2014;
;
55
:
:1511.
–
1519
.
35.
Katicheva
L
,
Sukhov
V
.
Bushueva
,
et al.
Evaluation of the open time of calcium channels at variation potential generation in wheat leaf cells.
.
Plant Signal Behav.
2015;
;
10
:
:e993231.
.
36.
Kelz
MB
,
Mashour
GA
.
The Biology of General anesthesia from Paramecium to Primate.
.
Curr Biol.
2019;
;
29
:
:R1199.
–
R1210
.
37.
Ameisen
JC
.
On the origin, evolution, and nature of programmed cell death: a timeline of four billion years.
.
Cell Death Differ.
2002;
;
9
:
:367.
–
393
.
38.
Okada
Y
,
Maeno
E
,
Mori
S
.
anion Channel Involved in Induction of Apoptosis and Necrosis.
. In:
Lauf
PK
,
Adragna
NC
, editors.
Cell Volume and Signaling. Advances in Experimental Medicine and Biology.
.
Boston, MA:
:
Springer, US;
,
2005
: pp.
:205.
–
9
.
39.
Bortner
CD
,
Cidlowski
JA
.
Cell Shrinkage and Monovalent Cation Fluxes.
.
Arch Biochem Biophys.
2007;
;
462
:
:176.
–
188
.
40.
Bouteau
F
,
Reboutier
D
,
Tran
D
,
et al.
Ion Transport in Plant Cell Shrinkage During Death.
.
Front Cell De. Biol.
2020
;
:8.
.
41.
Boussen
S
,
Cordier
PY
.
Conscience et anesthésie. anesth.
.
Réanimation.
2020;
;
6
:
:327.
–
36
.
|