| |
| Med Sci (Paris). 39(10): 722–731. doi: 10.1051/medsci/2023132.La brucellose du bouquetin des Alpes Un exemple de dix années de recherche et d’expertise Sébastien Lambert,1* Anne Thébault,2 Stéphane Anselme-Martin,3 Clément Calenge,4 Charlotte Dunoyer,5 Luca Freddi,6 Bruno Garin-Bastuji,5 Benoit Guyonnaud,3 Jean Hars,7 Pascal Marchand,8 Ariane Payne,9 Élodie Petit,9,10 Claire Ponsart,6 Erwan Quéméré,11 Carole Toïgo,12 Anne van de Wiele,13 Sophie Rossi,14 and Emmanuelle Gilot-Fromont10 1Interactions hôtes-agents pathogènes (IHAP), université de Toulouse, INRAe, école nationale vétérinaire de Toulouse (ENVT)
,
Toulouse
,
France 2Agence nationale de sécurité sanitaire, de l’alimentation, de l’environnement et du travail (Anses), direction de l’évaluation des risques
,
Maisons-Alfort
,
France 3Office français de la biodiversité (OFB), service départemental de Haute-Savoie
,
Sévrier
,
France 4Office français de la biodiversité (OFB), direction surveillance, évaluation, données, unité données et appui méthodologique
,
Auffargis
,
France 5Agence nationale de sécurité sanitaire, de l’alimentation, de l’environnement et du travail (Anses), direction de la stratégie et des programmes
,
Maisons-Alfort
,
France 6Agence nationale de sécurité sanitaire, de l’alimentation, de l’environnement et du travail (Anses)/université Paris-Est, laboratoire de santé animale, laboratoire de référence national, européen, et organisation mondiale de la santé animale (OMSA) pour les brucelloses animales
,
Maisons-Alfort
,
France 7Office français de la biodiversité (OFB), direction de la recherche et de l’appui scientifique, unité sanitaire de la faune
,
Gières
,
France 8Office français de la biodiversité (OFB), direction de la recherche et de l’appui scientifique, service anthropisation et fonctionnement des écosystèmes terrestres
,
Juvignac
,
France 9Office français de la biodiversité (OFB), direction de la recherche et de l’appui scientifique, service santé de la faune et fonctionnement des écosystèmes agricoles
,
Orléans
,
France 10Université de Lyon, VetAgro Sup, CNRS, laboratoire de biométrie et biologie évolutive UMR 5558
,
Marcy l’Étoile
,
France 11Institut national de recherche pour l’agriculture, l’alimentation et l’environnement (INRAE), institut Agro, institut français de recherche pour l’exploitation de la mer (IFREMER), UMR DECOD (dynamique et durabilité des écosystèmes : de la source à l’océan)
,
Rennes
,
France 12Office français de la biodiversité (OFB), direction de la recherche et de l’appui scientifique, service anthropisation et fonctionnement des écosystèmes terrestres
,
Gières
,
France 13Office français de la biodiversité (OFB), direction de la recherche et de l’appui scientifique, direction générale déléguée police, connaissance, expertise
,
Paris
,
France 14Office français de la biodiversité (OFB), direction de la recherche et de l’appui scientifique, unité sanitaire de la faune
,
Gap
,
France |
Vignette (S. Anselme-Martin, ONCFS/OFB).
La brucellose (ou fièvre de Malte) est une maladie infectieuse due à des bactéries du genre
Brucella
. Ces coccobacilles à Gram négatif intracellulaire facultatif, sont capables de se multiplier dans les cellules phagocytaires (notamment les macrophages)
1
, ce qui favorise leur persistance dans l’organisme [
1
,
2
] (→).
(→) Voir les Synthèses de V. Foulongne
et al
.,
m/s
n° 4, avril 2002, page 439, et de J.L. Mege et C. Capo,
m/s
n° 1, janvier 2010, page 83
Il s’agit d’une zoonose (maladie transmissible entre les animaux et les humains) d’importance majeure, avec plus de 500 000 cas humains déclarés chaque année dans le monde. Cette maladie peut provoquer des symptômes variés, tels que fièvre intermittente, frissons, sueurs, asthénie, myalgie, avortement, atteintes ostéoarticulaires, endocardite, orchite (infection des testicules), méningite.
Les bactéries du genre
Brucella
sont présentes chez de nombreuses espèces animales. La brucellose des ruminants est principalement causée par des bactéries des espèces
Brucella abortus
ou
Brucella melitensis
. Chez les ruminants, les principaux signes cliniques sont des avortements consécutifs à une placentite, des orchites et, en cas d’infection chronique, des arthrites. Le caractère zoonotique de la maladie, la prévalence historiquement importante chez les ruminants domestiques, et les conséquences économiques pour l’élevage (pertes de production et entraves aux échanges commerciaux), ont justifié la mise en place de mesures de lutte, obligatoires en France à partir des années 1970. Ces mesures ont permis d’obtenir une amélioration progressive de la situation sanitaire en France jusqu’à l’attribution du statut officiel d’« indemne de brucellose bovine » par la Commission européenne en 2005.
Pourtant, en novembre 2011, un enfant de 10 ans a présenté des symptômes non spécifiques dus à une infection par
B. melitensis
biovar 3, confirmée par hémoculture en janvier 2012 [
3
]. L’enquête épidémiologique réalisée n’a pas permis d’identifier immédiatement la source de l’infection (pas de voyage en zone non indemne, pas de consommation de lait cru ou de produits au lait cru provenant de zones non indemnes, pas d’exposition en laboratoire, pas de contacts directs avec des animaux, etc.). Il a donc été conclu à un cas autochtone d’origine indéterminée [
3
].
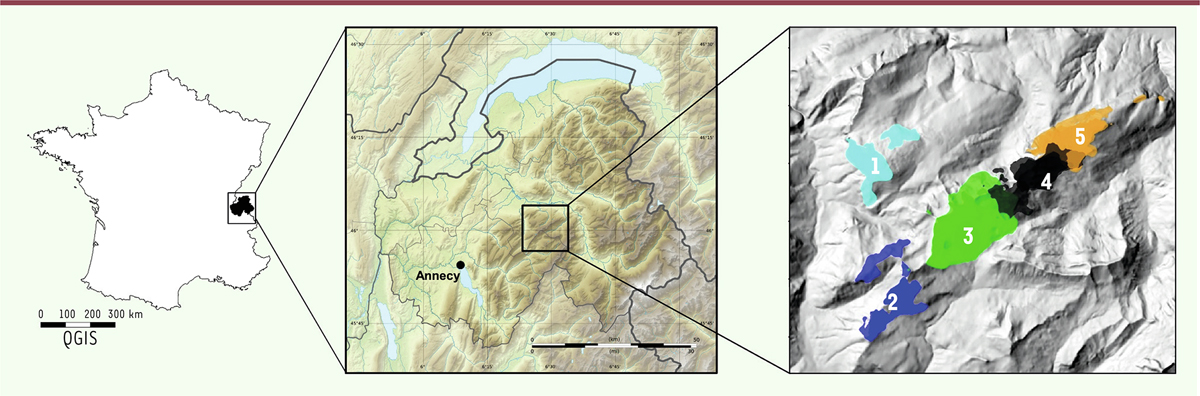
En janvier 2012, une vache de neuf ans a avorté à sept mois de gestation dans une exploitation de 21 vaches laitières, productrice de reblochon fermier, de la commune du Grand-Bornand, dans le massif du Bargy en Haute-Savoie (
Figure 1
) [
3
,
4
]. Suite à cet avortement, la vache a fait l’objet d’un premier dépistage sérologique dont les résultats se sont avérés positifs et ont été confirmés après plusieurs semaines [
4
]. En avril 2012,
B. melitensis
biovar 3 a été isolée dans le lait de cette vache [
3
,
4
]. Bien qu’aucune autre vache de l’élevage n’ait été trouvée positive dans les tests sérologiques, conformément à la réglementation, l’ensemble du troupeau a été abattu et les organes ont été prélevés pour examen après mise en culture et tests PCR (
polymerase chain reaction
).
B. melitensis
a alors été isolée en culture chez une seconde vache du troupeau, et quatre vaches supplémentaires ont été trouvées positives par PCR, sans qu’il soit possible d’isoler la bactérie [
3
,
4
].
 | Figure 1.
Localisation du massif du Bargy en Haute-Savoie et structuration socio-spatiale des bouquetins femelles en cinq sous-populations dans cinq secteurs.
Zone périphérique : secteurs 1 (« Leschaux-Andey ») et 2 (« Charmieux-Buclon »). Zone cœur : secteurs 3 (« Jallouvre-Peyre »), 4 (« Grand Bargy ») et 5 (« Petit Bargy »). Carte centrale adaptée de Flappiefh (commons.wikimedia.org, licence CC BY-SA-4.0). Carte de droite : d’après [
28
], mise à jour d’après [
14
].
|
Après la découverte de l’infection chez la vache ayant avorté, il s’est avéré que le jeune patient et plusieurs membres de sa famille avaient visité l’exploitation en octobre 2011. Ils y avaient consommé de la tome blanche, un fromage au lait cru non affiné [3, 5, 6]. En mai 2012, des tests sérologiques ont été effectués sur les parents et la sœur du patient. Seule sa sœur a présenté un résultat positif, sans présenter de symptômes [
3
]. Aucun autre cas n’a été détecté parmi les autres membres de la famille ayant consommé le fromage, excepté un adolescent de la famille qui a présenté en 2013 une arthrite de la hanche associée à des tests sérologiques positifs vis-à-vis de la brucellose [
5
,
6
].
L’origine de la contamination humaine avait donc été résolue. Il restait à déterminer l’origine de l’infection des bovins. Quarante élevages, voisins ou en lien direct avec l’élevage infecté, ont été examinés et aucun animal de ces élevages ne s’est révélé atteint de brucellose [3, 4, 7], de même qu’aucun ruminant domestique ayant pâturé en estive (les troupeaux paissent alors sur des pâturages de montagne) dans le massif du Bargy en 2012 (soit plus de 12 000 vaches, moutons et chèvres testés) [
4
,
7
]. L’hypothèse d’une contamination de la vache par la faune sauvage, et la transmission humaine par son lait, a alors été émise et étudiée par l’Office national de la chasse et de la faune sauvage (ONCFS, désormais Office français de la biodiversité – OFB).
Pour tester cette hypothèse, un dépistage a été mis en place chez les ruminants sauvages tués à la chasse : chamois (
Rupicapra rupicapra
), cerfs (
Cervus elaphus
), et chevreuils (
Capreolus capreolus
). Une surveillance clinique des bouquetins des Alpes (
Capra ibex
), espèce protégée, donc non chassée, a également été instaurée. En septembre 2012, une femelle chamois, tuée à la chasse, s’est avérée porteuse de
B. melitensis
biovar 3 [
8
]. Au mois d’octobre de la même année, deux bouquetins mâles présentant des arthrites, des lésions évocatrices de brucellose, ont été capturés (
Figure 2D
). Les résultats des tests sérologiques de ces deux bouquetins se sont avérés positifs ; ils ont été abattus. La présence de
B. melitensis
biovar 3 a ensuite été confirmée [
8
,
44
] (→).
(→) Voir l’Éditorial de A. Gautier, page 695 de ce numéro
 | Figure 2.
(A) Capture de bouquetin par télé-anesthésie
(B. Muffat-Joly, ONCFS/OFB) ;
(B) prise de sang sur un bouquetin anesthésié
(J. Hars, ONCFS/OFB) ;
(C) réalisation d’un test sérologique rapide au chevet d’un bouquetin anesthésié
(J. Hars, ONCFS/OFB) ;
(D) bouquetin porteur d’une arthrite brucellique, massif du Bargy, 2012
(S. Anselme-Martin, ONCFS/OFB).
|
Ces découvertes ont déclenché la mise en place de captures de bouquetins par télé-anesthésie dès l’automne 2012 (
Figure 2A
). À la fin de la saison de chasse de 2012-2013, parmi les animaux chassés et testés, seule la femelle chamois détectée en septembre 2012 s’est avérée positive sur les 55 animaux testés. Aucun des 30 cerfs et des 44 chevreuils testés n’était infecté [
7
,
8
]. En revanche, les tests réalisés sur 32 des 80 bouquetins capturés durant l’automne 2012 et le printemps 2013 se sont avérés positifs (
Tableau I
), ce qui représentait une séroprévalence apparente de 40 % [
7
,
8
]. Une séroprévalence aussi élevée n’avait jusqu’alors jamais été observée dans la faune sauvage en Europe [
8
–
10
].
Tableau I.
|
|
Nombre de bouquetins |
| Saison |
Mesure implémentée |
Total |
Séropositifs/testés |
| Aut. 2012 – Print. 2013 |
Capture avec abattage des séropositifs |
80 |
32/80 |
|
| Print. 2013 |
Abattage sans test préalable d’animaux avec signes cliniques |
4 |
2/2 |
|
| Aut. 2013 |
Abattage sans test préalable ciblé sur les animaux de plus de 5 ans |
233 |
- |
|
| Print. 2014 |
Abattage sans test préalable ciblé sur les animaux de plus de 5 ans |
18 |
5/17 |
|
| Print. 2014 |
Capture avec abattage des séropositifs |
61 |
30/61 |
|
| Recapture avec abattage des séropositifs |
10 |
1/10 |
|
| Print. 2015 – Aut. 2015 |
Capture avec euthanasie des séropositifs |
103 |
36/103 |
|
| Recapture avec euthanasie des séropositifs |
22 |
2/22 |
|
| Aut. 2015 |
Abattage sans test préalable d’animaux non marqués |
70 |
6/13 |
|
| Print. 2016 – Aut. 2016 |
Capture avec euthanasie des séropositifs |
20 |
4/20 |
| Recapture avec euthanasie des séropositifs |
15 |
1/15 |
|
| Print. 2017 |
Capture avec euthanasie des séropositifs |
22 |
6/22 |
| Recapture avec euthanasie des séropositifs |
5 |
0/5 |
|
| Aut. 2017 |
Abattage sans test préalable d’animaux non marqués en zone cœur |
5 |
1/5 |
| Print. 2018 |
Capture avec euthanasie des séropositifs |
34 |
6/34 |
| Recapture avec euthanasie des séropositifs |
14 |
0/14 |
|
| Aut. 2018 |
Abattage sans test préalable d’animaux non marqués en zone cœur |
5 |
0/5 |
|
| Print. 2019 |
Capture avec euthanasie des séropositifs |
42 |
3/42 |
| Recapture avec euthanasie des séropositifs |
6 |
1/6 |
|
| Aut. 2019 |
Abattage sans test préalable d’animaux non marqués en zone cœur |
2 |
1/2 |
|
| Print. 2020 |
Capture avec euthanasie des séropositifs |
18 |
0/18 |
| Recapture avec euthanasie des séropositifs |
3 |
0/3 |
|
| Print. 2021 |
Capture avec euthanasie des séropositifs |
31 |
3/31 |
| Recapture avec euthanasie des séropositifs |
5 |
0/5 |
|
| Print. 2022 – Aut. 2022 |
Capture avec euthanasie des séropositifs |
97 |
5/97 |
| Recapture avec euthanasie des séropositifs |
38 |
1/38 |
| Aut. 2022 |
Abattage sans test préalable d’animaux non marqués en zone cœur |
61 |
3/52 |
|
| Print. 2023 |
Capture avec euthanasie des séropositifs |
50 |
4/50 |
| Recapture avec euthanasie des séropositifs |
19 |
0/19 |
Récapitulatif des mesures de gestion appliquées dans la population de bouquetins du Bargy de 2012 à 2023 et résultats des tests sérologiques
(d’après [
33
]). Aut : automne ; Print : printemps.
|
Les souches de
B. melitensis
isolées chez l’enfant de 10 ans et chez les bovins, le chamois et les bouquetins, étaient extrêmement proches génétiquement. Ces souches étaient également très proches de celles qui avaient été isolées en 1999 du dernier foyer domestique dans le massif du Bargy (commune du Reposoir) [
9
]. L’hypothèse la plus probable était alors la possible transmission de la brucellose des ruminants domestiques (vaches, moutons ou chèvres) aux ruminants sauvages, contemporaine ou antérieure au dernier foyer de 1999. Pourtant, entre 1999 et 2012, en l’absence de suivi épidémiologique des populations d’ongulés et de signes cliniques ou de mortalité remarquables, l’infection n’a pas été détectée. La bactérie se serait donc maintenue dans la faune sauvage, en particulier dans la population de bouquetins, avant de contaminer l’élevage bovin détecté en 2012 [
7
,
9
].
Ce cas constitue le premier cas décrit de persistance de
B. melitensis
dans une population de bouquetins. En 2013, un défi inédit était alors lancé : comment gérer un foyer actif de brucellose, zoonose majeure dont l’éradication est obligatoire, chez une espèce protégée et emblématique de la protection de la nature en Europe, en plein cœur d’un bassin de production de fromages au lait cru ? Ce défi a justifié la mise en place de travaux de recherche et d’expertise qui se sont fondés sur le suivi de la population de bouquetins, réalisé en particulier par les agents de l’ONCFS/OFB à l’aide de captures (
Figure 2A
), de tirs, de suivis télémétriques (par GPS [
global positioning system
] ou VHF [
very high frequency
]) et d’observations des animaux marqués (capturés au moins une fois) et non marqués (jamais capturés). Ce suivi a notamment permis la réalisation de tests sérologiques et bactériologiques en laboratoire à partir des prélèvements réalisés sur le terrain (
Figure 2B
). En 2015, le laboratoire national de référence pour la brucellose de l’Agence nationale de sécurité sanitaire, de l’alimentation, de l’environnement et du travail (Anses) a validé un test sérologique rapide, utilisable directement sur le terrain (
Figure 2C
) [
11
], simplifiant ainsi la mise en place de la surveillance et de certaines mesures de gestion. Parallèlement, un suivi de la dynamique de la population de bouquetins, ainsi que des mouvements des animaux, a été réalisé.
|
Le système brucellose-bouquetins Âge et séroprévalence
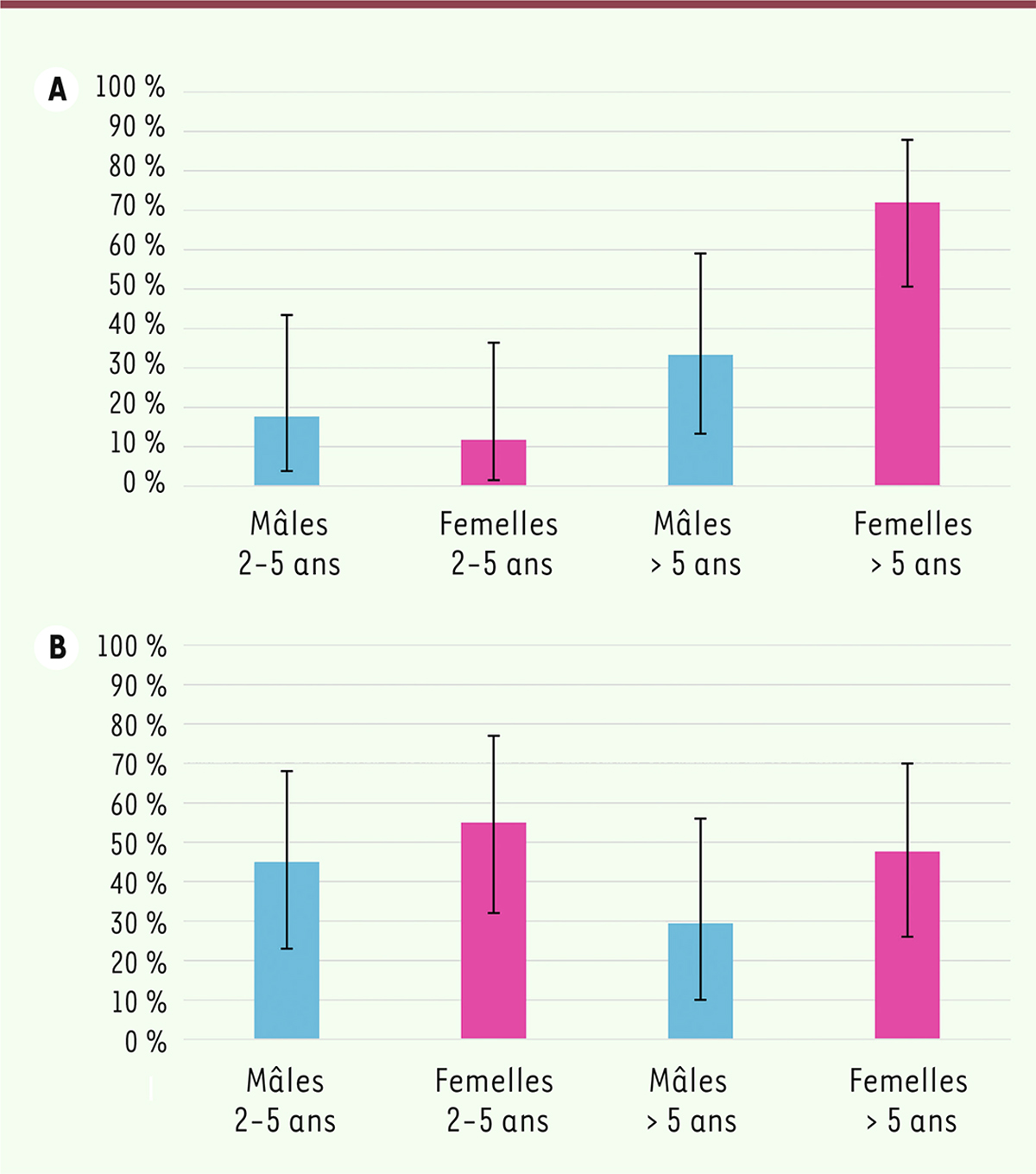
La séroprévalence vis-à-vis de la bactérie évaluée en 2012-2013, était plus élevée chez les bouquetins de plus de cinq ans que chez les bouquetins plus jeunes (
Figure 3A
) [
8
]. L’hypothèse d’une voie de contamination majoritairement vénérienne a donc été émise, les bouquetins plus âgés étant ceux qui participent majoritairement à la reproduction. Un abattage massif a donc ciblé ces animaux. Pourtant, parmi les animaux capturés au printemps 2014, la séroprévalence apparente chez les jeunes bouquetins a augmenté significativement (
Figure 3B
) [
12
,
13
]. Cette augmentation apparente a tout d’abord été interprétée comme une contamination par voie vénérienne des jeunes bouquetins restés vivants et entrés précocement en reproduction en 2014, du fait de l’élimination préférentielle des animaux plus âgés en 2013 [
12
,
13
]. En fait, cette augmentation apparente était artificielle, due à un biais d’échantillonnage lié à la structuration spatiale de la population, mise en évidence par la suite [
14
,
15
].
 | Figure 3.
Répartition de la séroprévalence dans la population de bouquetins du massif du Bargy
, en fonction de l’âge et du sexe des animaux (et intervalle de confiance à 95 %) en 2012-2013 (
A
) et 2014 (
B
) (figure adaptée de [
13
]). L’augmentation apparente de la séroprévalence chez les jeunes bouquetins en 2014 par rapport à 2012-2013 est due à des différences d’échantillonnage liées à la structure spatiale (inconnue à l’époque), les jeunes bouquetins de 2014 ayant été majoritairement échantillonnés dans les secteurs les plus atteints (zone cœur) [
14
,
15
]. L’axe des ordonnées représente la séroprévalence (pourcentage des bouquetins séropositifs parmi la population).
|
Structuration socio-spatiale des femelles et de la séroprévalence
Lors de la découverte de l’infection des bouquetins, leur répartition dans le massif du Bargy était inconnue. Un suivi des animaux (marqués par colliers GPS) initié dès 2013 a permis de démontrer en 2015 l’existence d’une structuration socio-spatiale des femelles : elles vivent en effet en sous-populations quasi-indépendantes, dans cinq secteurs différents [
14
,
15
] (
Figure 1
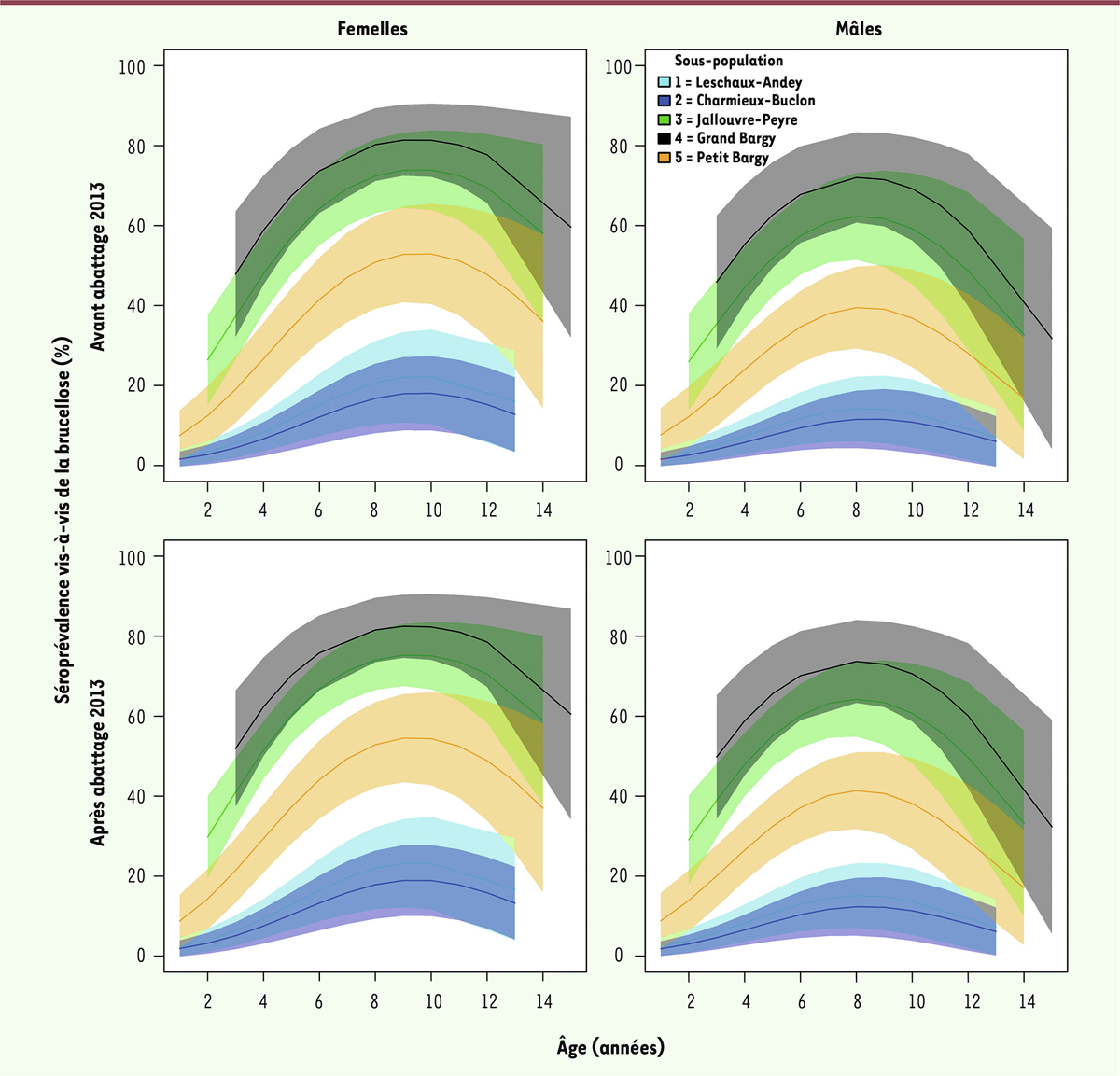
). Les mâles, quant à eux, ne sont pas organisés spatialement comme les femelles. Ils ont tendance à se déplacer dans l’ensemble du massif (et occasionnellement dans le massif voisin des Aravis pour quelques-uns d’entre eux), notamment au moment du rut. Cette structuration socio-spatiale des femelles a été reliée à des niveaux de séroprévalence contrastés entre les secteurs, que ce soit chez les mâles ou chez les femelles (
Figure 4
) [
14
,
15
]. Entre 2012 et 2015, les secteurs dits de « Jallouvre-Peyre » et du « Grand Bargy », au centre du massif, montraient les séroprévalences les plus élevées, suivis de près par le secteur du « Petit Bargy » [
14
,
15
]. Ces trois secteurs ont, par la suite, été regroupés dans ce qui a été appelé « la zone cœur ». Les secteurs de « Charmieux-Buclon » et de « Leschaux-Andey », à l’ouest du massif (appelé « zone périphérique »), avaient, en revanche, une séroprévalence plus faible [
14
,
15
]. Cette découverte de la structuration spatiale de la séroprévalence a conduit à envisager un rôle épidémiologique majeur des femelles, et un rôle mineur de la voie vénérienne [
14
,
15
], contrairement à l’hypothèse initiale. En effet, si la voie vénérienne jouait un rôle majeur, les déplacements des mâles dans l’ensemble du massif auraient conduit à une séroprévalence homogène entre les sous-populations.
 | Figure 4.
Séroprévalence vis-à-vis de la brucellose en fonction de la sous-population dans laquelle ont été capturés les bouquetins, de l’âge et du sexe des animaux et de l’année
(avant abattage d’automne 2013 : séroprévalence lors des captures à l’automne 2012 et au printemps 2013 ; après abattage d’automne 2013 : séroprévalence lors des captures au printemps 2014 et au printemps-automne 2015). La séroprévalence augmente avec l’âge des animaux, avant de diminuer pour les animaux les plus âgés. La séroprévalence est légèrement plus élevée chez les femelles que chez les mâles. Les séroprévalences chez les femelles et chez les mâles sont les plus élevées dans les sous-populations de Jallouvre-Peyre et du Grand Bargy, suivis de près par celle du Petit Bargy (« zone cœur »). Les séroprévalences les plus faibles sont retrouvées dans la zone périphérique (Leschaux-Andey et Charmieux-Buclon) (voir carte des secteurs
Figure 1
). Il n’y a pas de différence significative de la séroprévalence avant et après abattage (figure adaptée de [
14
,
15
]). L’axe des ordonnées représente la séroprévalence (pourcentage des bouquetins séropositifs parmi la population).
|
Aspects lésionnels et bactériologiques
Au début du suivi sanitaire de la population de bouquetins (entre 2012 et 2014), environ un tiers des animaux séropositifs abattus et autopsiés étaient porteurs de lésions, majoritairement des orchites et des arthrites (
Figure 2D
) [
16
,
17
]. Les analyses bactériologiques réalisées sur leurs organes ont montré que les individus ne présentant pas de lésions pouvaient néanmoins être porteurs de la bactérie, et donc être potentiellement contaminants [
16
,
17
].
B. melitensis
a été isolée dans des écouvillons génitaux, les testicules, les mamelles, ainsi que les nœuds lymphatiques associés [
16
–
19
]. La bactérie a également été détectée dans le placenta et le fœtus d’une femelle infectée [
18
,
19
]. Ces résultats laissaient suspecter l’existence de voies de transmission similaires à celles des ruminants domestiques : la voie horizontale, par les produits d’avortements et de mises-bas ; la voie vénérienne ; et la voie verticale, de la mère à son cabri [
16
–
19
]. Entre 2012 et 2017, 58 % des animaux séropositifs étaient porteurs de la bactérie [
18
,
19
]. La probabilité que l’analyse bactériologique donne un résultat positif (la mise en évidence de la présence de la bactérie) diminuait avec l’âge de l’animal, indiquant que les jeunes bouquetins séropositifs étaient plus à risque d’héberger et d’excréter la bactérie, avec la première gestation chez les femelles, et la maturité sexuelle chez les mâles [
18
,
19
].
Co-infections et génétique
La population du Bargy est la seule population connue de bouquetins des Alpes dans laquelle
B. melitensis
s’est maintenue à des niveaux élevés pendant plusieurs années, alors que, dans les rares autres populations où des cas avaient été détectés, l’infection s’est éteinte naturellement [10, 20-22]. La population du Bargy a donc été supposée particulièrement réceptive à la brucellose, possiblement en lien avec la circulation antérieure d’un agent infectieux qui aurait favorisé la transmission de la brucellose (en affectant la reproduction ou l’immunité). Les caractéristiques génétiques de la population de bouquetins ont également été questionnées. Celle-ci est en effet issue de la réintroduction dans les alpages du massif du Bargy de 14 individus, eux-mêmes issus d’une population très peu diversifiée génétiquement [
23
].
Plusieurs agents infectieux, classiquement présents chez les ruminants, ont été détectés dans cette population. Le seul lien qui a pu être mis en évidence entre ces agents infectieux et la brucellose a été que les mâles séropositifs vis-à-vis de
B. melitensis
étaient plus à risque d’être séropositifs vis-à-vis de
Mycoplasma agalactiae
, l’agent étiologique de l’agalactie contagieuse des petits ruminants [
24
], ce qui pouvait expliquer la réponse immunitaire des mâles différente de celle des femelles [
25
].
La diversité génétique des bouquetins du Bargy a été confirmée comme étant très faible, mais elle est équivalente à celle observée dans les autres populations de bouquetins des Alpes (eu égard à l’histoire récente de cette espèce, passée près de l’extinction et donc peu diversifiée génétiquement, avant d’être réintroduite dans tout l’arc alpin) [
26
]. Une association a été démontrée entre le statut sérologique des individus et le gène
SLC11A1
(
solute carrier family 11 member A1
) qui code NRAMP (
natural resistance-associated macrophage protein
), une protéine d’activation des macrophages [
26
]. Chez les bouquetins du Bargy, deux allèles de ce gène sont présents : A324 et A330. L’allèle rare A330, présent à une fréquence plus faible dans la population du Bargy que dans les autres populations alpines étudiées, est associé à une plus faible séroprévalence, notamment chez les individus homozygotes [
26
]. Toutefois, l’influence de ce gène sur la circulation de l’infection et le rôle potentiel de la protéine NRAMP dans la résistance des bouquetins des Alpes à l’infection par
B. melitensis
restent à démontrer, comme cela a été mis en évidence chez le buffle domestique (
Bubalus bubalis
) [
27
].
Au final, ni la présence de co-infections, ni la comparaison des caractéristiques génétiques de cette population par rapport à d’autres, n’ont permis d’expliquer pourquoi elle a été la seule, à ce jour, à permettre le développement et la persistance de
B. melitensis
.
Hétérogénéité de transmission
Un modèle épidémiologique, établi grâce aux données collectées entre 2012 et 2018, a permis d’estimer les probabilités de transmission associées aux différentes voies de transmission, aux différentes classes d’animaux (classes d’âge, de sexe) et selon les secteurs dans lesquels vivent les animaux [
19
,
28
].
Les évènements de transmission liés à la voie horizontale (par les avortements et les mises-bas) ont été évalués à environ 60 % des cas, la voie verticale à environ 20 % des cas, et la voie vénérienne aux 20 % restants [
19
,
28
]. Les évènements de transmission s’avèrent liés à des femelles infectieuses dans 88 % des cas en moyenne, confirmant leur rôle épidémiologique prépondérant [
19
,
28
]. Les évènements de transmission liés à des jeunes femelles (entre 2 et 5 ans) représentent environ 33 % des cas en moyenne (principalement par avortements lors de la première gestation post-infection), contre 55 % pour les femelles de plus de cinq ans (principalement par les produits de mise-bas lors des gestations suivantes) [
19
,
28
]. Chez les mâles (12 % des cas), les plus âgés (plus de cinq ans) ont plus de risque de transmettre l’infection, étant donné leur accès privilégié à la reproduction (mâles dominants), tandis que les plus jeunes jouent un rôle négligeable (environ 0,01 %) [
19
,
28
]. Enfin, la majorité (environ 87 %) des évènements de transmission ont lieu dans la zone cœur [
19
,
28
]. La transmission entre animaux vivant dans des secteurs différents est rendue possible par le déplacement des mâles (sensibles ou infectieux) d’un secteur à l’autre, en particulier par voie vénérienne au moment du rut [
19
,
28
].
|
Évaluation de mesures de gestion Euthanasie des séropositifs, tirs et abattages massifs
Les travaux d’expertise collective, coordonnés par l’Anses, ont impliqué de nombreux groupes d’experts afin d’apporter des éléments scientifiques aux autorités en charge de la gestion sanitaire [10, 11, 29-35]. Dès juillet 2013, l’avis de l’Anses a été sollicité, notamment sur les mesures de gestion à mettre en place dans la population de bouquetins pour lutter contre la brucellose [
29
]. Par transposition des mesures appliquées chez les ruminants domestiques, la première option envisagée par les autorités a été un abattage total de la population de bouquetins. Les experts réunis par l’Anses, chargés d’évaluer cette mesure et d’identifier de potentielles alternatives, ont estimé qu’un abattage massif des bouquetins réduirait effectivement de façon significative et rapide le risque de transmission de la brucellose des bouquetins aux cheptels domestiques [
29
]. Ils ont cependant remis en question la faisabilité d’un tel abattage dans la faune sauvage. Ils ont aussi souligné que cette méthode ne permettrait pas la réalisation simultanée d’un suivi sanitaire des animaux abattus, ce qui constituait une limite majeure, sans compter les conséquences sur la conservation de cette population, ni les risques de perturbation de la population et de la transmission de la brucellose [
29
]. Les experts se sont également interrogés sur la réalité de l’urgence d’une telle mesure, face à un risque de transmission aux animaux domestiques toutefois minime (un seul cas de transmission aux ruminants domestiques, alors que la brucellose circule chez les bouquetins probablement depuis au moins 1999) et au manque de connaissances sur la dynamique épidémiologique en 2013 [
29
]. Parmi les alternatives, les experts ont notamment identifié deux options d’abattage sélectif, sur la base de l’âge des animaux ou de leur statut sérologique [
29
]. La première consistait en un abattage massif sans test sérologique mais ciblé sur les individus âgés de plus de cinq ans [
29
] ; la seconde était l’abattage des individus séropositifs lors de captures [
29
]. Cette dernière méthode devait permettre de réaliser un suivi sanitaire, mais elle ne permettait qu’une réduction progressive du risque de transmission, en raison de la difficulté que pose la capture de ces animaux qui vivent en montagne, dans des milieux escarpés.
Suite à cet avis, et au vu des résultats de la campagne de captures de 2012-2013 (
Figure 3A
), les autorités ont décidé un abattage massif ciblé sur les animaux de plus de cinq ans. Deux-cent cinquante et un bouquetins ont donc été tués, entre l’automne 2013 et le printemps 2014 (
Tableau I
) [
12
,
13
]. À l’issue de cette action, au printemps 2014, la séroprévalence apparente parmi les bouquetins capturés n’était pas statistiquement significativement différente de celle évaluée auparavant, en 2012-2013 [
12
,
13
], et aucune différence significative de la séroprévalence corrigée pour la structure d’échantillonnage entre 2012-2013, 2014 et 2015 n’a été observée [
14
,
36
]. Il n’y a donc pas eu d’effet mesurable immédiat de cet abattage massif sur la séroprévalence. Il n’y a pas non plus eu d’effet sur la structuration spatiale ou sur l’organisation sociale des bouquetins [
14
]. Cependant, en réduisant fortement la densité de la population, il est probable qu’il a contribué à diminuer le risque de transmission. Les conséquences à plus long terme sur la dynamique de la population, sur sa structure socio-spatiale, et sur la transmission de la brucellose, restent cependant à déterminer.
Le bouquetin des Alpes étant une espèce protégée en France, avec une valeur patrimoniale forte liée à son histoire, l’abattage massif a fait l’objet de nombreuses controverses, notamment en raison de l’absence d’efficacité apparente observée en 2014. Des associations de protection de la nature ont saisi l’Anses fin 2014, en demandant notamment de réévaluer les mesures de gestion à mettre en place [
10
].
Au cours de cette nouvelle expertise, une évaluation à la fois qualitative et quantitative des scénarios de gestion a été réalisée. Pour l’évaluation quantitative, un premier modèle épidémiologique individu-centré a été développé afin d’estimer une probabilité d’extinction de la brucellose sur cinq ans [
10
]. D’après ce modèle, l’absence de mesure de gestion ne permet pas l’extinction de la brucellose (probabilité inférieure à 2,5 %) et l’efficacité d’un abattage massif (avec un maximum de 90 % de la population) a été jugée comme incertaine, en particulier au vu des résultats obtenus après l’abattage massif de 2013 et des résultats du modèle. En revanche, une stratégie combinant un nombre de captures important (environ 100 animaux), avec euthanasie des animaux séropositifs et le marquage des animaux séronégatifs, avec un abattage à 90 % des bouquetins non marqués l’année suivante, a été jugée, de manière qualitative, comme ayant de meilleures chances de réussite, même si d’après l’évaluation quantitative, la probabilité d’obtenir l’extinction de la brucellose avec ce scénario était inférieure à 2,5 % [
10
]. Les meilleurs scénarios hypothétiques étaient ceux dans lesquels l’abattage sélectif des séropositifs était combiné avec une vaccination des séronégatifs, avec 150 à 200 animaux capturés chaque année pendant cinq ans. L’utilisation de la vaccination était néanmoins soumise à conditions (voir plus loin).
En 2015, 125 animaux ont été capturés, dont 38 étaient séropositifs et ont été euthanasiés, et 70 bouquetins non marqués ont été abattus sans test préalable (
Tableau I
). Une diminution significative de la séroprévalence corrigée a alors été observée entre 2015 et 2016 [
36
]. Les effets des différentes mesures, mises en place entre 2012 et 2015, y compris l’abattage massif de 2013, ont probablement contribué à cette diminution, sans qu’il soit possible de déterminer leurs effets respectifs [
36
].
Dès 2016, suite aux résultats obtenus concernant la structuration spatiale de la population et de la séroprévalence suggérant un rôle épidémiologique majeur des femelles [
14
,
15
], les mesures ont été orientées principalement vers des captures et l’euthanasie des animaux séropositifs, ciblées surtout sur les femelles de la zone cœur. Entre 2016 et 2022, la séroprévalence corrigée a diminué, avant de se stabiliser à un niveau faible, aux alentours de 5 % [33, 37, 38]. Depuis 2019, la séroprévalence n’est plus différente statistiquement entre la zone périphérique et la zone cœur [
33
,
37
].
Un nouveau modèle épidémiologique, développé à partir des travaux initiés par l’Anses en 2015, et fondé sur les données recueillies entre 2012 et 2018, a permis de quantifier l’hétérogénéité de la transmission entre classes d’âge, de sexe et entre secteurs. Ce modèle a également permis de confirmer que les scénarios de gestion ciblés sur les femelles (qui transmettent l’infection dans la majorité des cas) et sur la zone cœur (où ont lieu la majorité des évènements de transmission) étaient effectivement plus efficaces que les scénarios de gestion non ciblés [
19
,
39
]. Ce modèle a aussi permis de montrer l’intérêt de réaliser un nombre limité (quelques dizaines) de tirs sans test préalable, en plus de l’euthanasie des animaux séropositifs lors des captures, en particulier lorsque ces tirs sont ciblés sur les femelles non marquées de la zone cœur [
39
,
40
]. En plus de permettre d’abaisser encore la séroprévalence, ces tirs permettent également d’améliorer le suivi sanitaire des animaux dans les zones où il est difficile, voire impossible, de les capturer.
À l’automne 2021, suite à la découverte d’un nouveau foyer dans un élevage bovin [
30
], l’Anses a de nouveau été sollicitée pour évaluer l’efficacité de différents scénarios de gestion. Parmi ces scénarios, l’euthanasie des séropositifs, lors des captures, combinée au tir de 20 femelles ou de 50 individus (mâles et femelles) par an, ont été évalués, par modélisation, comme étant les scénarios les plus favorables [
31
]. Les scénarios d’abattage massif seul ou après un effort de capture important ont montré une efficacité similaire ou légèrement supérieure, mais associés à des inconvénients majeurs (absence de suivi concomitant, incertitude vis-à-vis de la perturbation de la population et de la transmission de la brucellose, impacts sur la conservation de la population) [
31
], comme souligné à maintes reprises dans les avis de l’Anses [10, 29, 32]. En 2022, 135 bouquetins ont été capturés (6 étaient séropositifs et ont été euthanasiés) et 61 animaux ont été abattus en zone cœur, sans test préalable (
Tableau I
) [
33
]. Lors des captures de 2023 qui ont suivi ces opérations, 69 bouquetins ont été capturés, dont quatre séropositifs qui ont été euthanasiés (
Tableau I
). Bien que la séroprévalence corrigée pour 2023 reste à estimer, la séroprévalence apparente reste du même ordre de grandeur (aux alentours de 5 %) que les années précédentes et n’est pas significativement différente de celle de 2022.
Vaccination
Dès 2013, l’utilisation de la vaccination comme mesure de lutte contre la brucellose a été évoquée [
29
]. L’évaluation qualitative et quantitative de l’Anses, en 2015, a montré que les scénarios incluant la vaccination, en complément des mesures d’abattage sélectif, étaient ceux qui avaient les meilleures chances de parvenir à l’extinction de la brucellose dans le massif [
10
]. Cependant, les experts ont précisé qu’une évaluation de l’innocuité de la vaccination était nécessaire avant sa mise en place sur le terrain [
10
]. Chez les ruminants domestiques, la souche vaccinale (vaccin vivant atténué) peut en effet être excrétée et transmise aux animaux non vaccinés [
41
]. En plus de l’innocuité du vaccin, il était donc également nécessaire d’évaluer les possibilités d’excrétion et de diffusion de la souche vaccinale [
34
].
Afin d’évaluer ces deux aspects, une étude expérimentale a été réalisée sur des bouquetins en captivité en 2017 [
42
,
43
]. Neuf de ces bouquetins qui ont été vaccinés ont développé une réaction sérologique forte mais aussi une dissémination de la souche vaccinale dans la sphère uro-génitale plus importante et plus longue, comparé à ce qui a été observé chez la chèvre domestique (cousine du bouquetin, à laquelle le vaccin testé était normalement destiné) [
42
,
43
]. Aucun bouquetin n’a développé de lésions de brucellose [
42
,
43
]. En revanche, des animaux non vaccinés mais en contact avec les animaux vaccinés ont également développé une infection par la souche vaccinale ou une réaction sérologique [
42
,
43
]. Certains bouquetins vaccinés ont donc excrété la souche vaccinale et l’ont transmise à des bouquetins non vaccinés en contact [
42
,
43
].
Saisie début 2018 sur la pertinence d’une vaccination, l’Anses a conclu, compte tenu de ces résultats, que l’utilisation de la vaccination n’était pas recommandée [
35
]. En effet, dans le cas d’une utilisation de la vaccination dans la population du Bargy, une telle diffusion entre animaux vaccinés et non vaccinés aurait un impact négatif important sur la surveillance et la gestion sanitaire, fondées sur les tests sérologiques [
35
]. L’utilisation de la vaccination n’a par ailleurs pas montré d’avantages majeurs par rapport aux autres mesures de gestion, d’après les derniers travaux de modélisation, pour des tailles de captures annuelles de 50 animaux [
19
,
39
]. La vaccination ne présente donc pas un rapport coûts-bénéfices favorable à son utilisation dans la population du Bargy.
|
Lors de la découverte de
B. melitensis
dans la population de bouquetins du Bargy en 2012, la brucellose chez les bouquetins était très mal connue, et cette population n’était pas suivie. Depuis, les travaux de recherche ont permis de mieux comprendre les caractéristiques cliniques, génétiques, et épidémiologiques de cette infection chez les bouquetins, ainsi que le fonctionnement de la population du Bargy. Les travaux d’expertise et de modélisation ont par ailleurs permis d’évaluer l’efficacité de différentes mesures de gestion, pour venir scientifiquement en aide à la prise de décision par les autorités sanitaires. Ces évaluations ont été mises à jour au cours du temps, afin de prendre en compte les nouvelles connaissances générées chaque année par les suivis populationnels et épidémiologiques et les travaux associés.
Cette situation inédite a fait travailler en parallèle la recherche et l’évaluation, même si ces deux activités n’évoluent pas dans le même pas de temps. Elle a montré l’importance, dans ces contextes inconnus, d’une gestion adaptative, permettant de réorienter les mesures en fonction des nouvelles données de la surveillance et de la recherche, ces trois notions étant étroitement liées.
Jusqu’à présent, les travaux de recherche se sont principalement focalisés sur la population de bouquetins du massif du Bargy, la seule population fortement impactée. Cependant, la découverte d’un nouveau cas bovin en 2021 [
30
], de cas sporadiques chez le chamois dans le Bargy [
7
,
31
], et d’une femelle bouquetin infectée en 2022 dans le massif voisin (les Aravis) [
33
], pourrait justifier d’étendre les travaux de recherche à d’autres espèces (domestiques et sauvages), voire à d’autres zones géographiques.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Foulongne
V
,
Michaux-Charachon
S
,
O’Callaghan
D
,
et al.
Systèmes de sécrétion des protéines de type IV et virulence bactérienne.
.
Med Sci (Paris).
2002;
;
18
:
:439.
–
447
.
2.
Mege
JL
,
Capo
C
.
La polarisation des macrophages, le nœud gordien des infections bactériennes ?
.
Med Sci (Paris).
2010;
;
26
:
:83.
–
88
.
3.
Mailles
A
,
Rautureau
S
,
Le Horgne
JM
,
et al.
Re-emergence of brucellosis in cattle in France and risk for human health.
.
Euro Surveill.
2012;
;
17
:
:1.
–
3
.
4.
Rautureau
S
,
Dufour
B
,
Jaÿ
M
,
et al.
Deux cas de brucellose bovine en 2012 appellent à la vigilance.
.
Bulletin épidémiologique, santé animale et alimentation.
2013;
;
59
:
:11.
–
4
.
5.
Garin-Bastuji
B
,
Rautureau
S
,
Hars
J
,
et al.
Investigations autour d’un cas humain de brucellose en Haute-Savoie.
.
Clermont-Ferrand:
:
Journées Nationales d’Infectiologie;
,
2013
.
6.
Mailles
A
,
Garin-Bastuji
B
,
Lavigne
JP
,
et al.
Human brucellosis in France in the 21st century: results from national surveillance 2004–2013.
.
Med Mal Infect.
2016;
;
46
:
:411.
–
418
.
7.
Garin-Bastuji
B
,
Hars
J
,
Drapeau
A
,
et al.
Reemergence of Brucella melitensis in wildlife.
.
France. Emerg Infect Dis.
2014;
;
20
:
:1570.
–
1571
.
8.
Hars
J
,
Rautureau
S
,
Jaÿ
M
,
et al.
Un foyer de brucellose chez les ongulés sauvages du massif du Bargy en Haute-Savoie.
.
Bull Epidémiol Santé Anim Alim.
2013;
;
60
:
:2.
–
7
.
9.
Mick
V
,
Le Carrou
G
,
Corde
Y
,
et al.
Brucella melitensis in France: persistence in wildlife and probable spillover from Alpine ibex to domestic animals.
.
PLoS One.
2014;
;
9
:
:e94168.
.
10.
ANSES.
.
Mesures de maîtrise de la brucellose chez les bouquetins du Bargy.
.
Rapport ANSES;
,
2015
:
:194.
p.
11.
ANSES.
.
Note d’appui scientifique et technique de l’ANSES relatif au dépistage des bouquetins infectés de brucellose sur le terrain.
.
Rapport ANSES;
,
2014
:
:8.
p.
12.
Hars
J
,
Vaniscotte
A
,
Game
Y
,
et al.
Surveillance et gestion d’un foyer de brucellose chez le bouquetin dans le massif du Bargy (Haute-Savoie).
.
Revue ONCFS Faune sauvage.
2015;
;
306
:
:11.
–
20
.
13.
Hars
J
,
Rautureau
S
,
Vaniscotte
A
,
et al.
La brucellose des bouquetins du massif du Bargy (Haute-Savoie): où en est-on en 2015 ?
.
Bull. Epidémiol. Santé Anim Alim.
2015;
;
70
:
:14.
–
18
.
14.
Marchand
P
,
Freycon
P
,
Herbaux
JP
,
et al.
Sociospatial structure explains marked variation in brucellosis seroprevalence in an Alpine ibex population.
.
Sci Rep.
2017;
;
7
:
:15592.
.
15.
Marchand
P
,
Petit
E
,
Calenge
C
,
et al.
Brucellose des bouquetins du massif du Bargy : des secteurs plus ou moins impactés en lien avec la structuration socio-spatiale des femelles.
.
Revue ONCFS Faune sauvage.
2018
;
:45.
–
51
.
16.
Freycon
P
.
Rôle du bouquetin Capra ibex dans l’épidémiologie de la brucellose à Brucella melitensis en Haute-Savoie.
[Th. Méd. Vét.]. Université Claude Bernard - Lyon I.
.
2015
.
17.
Freycon
P
,
Game
Y
,
Hars
J
,
et al.
Lesional aspects of Brucella melitensis in Capra ibex.
.
Bull Acad Vet France.
2017;
;
170
:
:1.
–
5
.
18.
Lambert
S
,
Gilot-Fromont
E
,
Freycon
P
,
et al.
High shedding potential and significant individual heterogeneity in naturally-infected Alpine ibex (Capra ibex) with Brucella melitensis.
.
Front Microbiol.
2018;
;
9
:
:1.
–
15
.
19.
Lambert
S
.
Transmission and management of brucellosis in a heterogeneous wild population of Alpine ibex (Capra ibex).
.
Université Claude Bernard Lyon 1.
.
2019
.
20.
Garin-Bastuji
B
,
Oudar
J
,
Richard
Y
,
et al.
Isolation of Brucella melitensis biovar 3 from a chamois (Rupicapra rupicapra) in the southern French alps.
.
J Wildl Dis.
1990;
;
26
:
:116.
–
118
.
21.
Ferroglio
E
,
Tolari
F
,
Bollo
E
,
et al.
Isolation of Brucella melitensis from Alpine ibex.
.
J Wildl Dis.
1998;
;
34
:
:400.
–
402
.
22.
Gauthier
D
,
Hars
J
,
Rossi
S
.
Brucellosis in free ranging chamois (Rupicapra rupicapra) and its relationships with domestic breeding. Third conference of the European Wildlife Disease Association.
.
Edinburgh;
:
Scotland:
,
1998
.
23.
Gauthier
D
,
Villaret
JC
.
La réintroduction en France du bouquetin des Alpes.
.
Rev Ecol (Terre & Vie).
1990;
;
45
:
:97.
–
120
.
24.
Briolay
T
.
Etude de la brucellose des bouquetins du massif du Bargy.
.
IUT Génie Biologique, Lyon 1.
,
2016
:
:48.
p.
25.
Folstad
I
,
Karter
AJ
.
Parasites, bright males, and the immunocompetence handicap.
.
Am Nat.
1992;
;
139
:
:603.
–
622
.
26.
Quéméré
E
,
Rossi
S
,
Petit
E
,
et al.
Genetic epidemiology of the Alpine ibex reservoir of a persistent and virulent brucellosis outbreak.
.
Sci Rep.
2020;
;
10
:
:1.
–
10
.
27.
Borriello
G
,
Capparelli
R
,
Bianco
M
,
et al.
Genetic resistance to Brucella abortus in the water buffalo (Bubalus bubalis).
.
Infect Immun.
2006;
;
74
:
:2115.
–
2120
.
28.
Lambert
S
,
Gilot-Fromont
E
,
Toïgo
C
,
et al.
An individual-based model to assess the spatial and individual heterogeneity of Brucella melitensis transmission in Alpine ibex.
.
Ecol Modell.
2020;
;
425
:
:109009.
.
29.
ANSES.
.
Mesures à prendre sur les bouquetins pour lutter contre la brucellose sur le massif du Bargy, Haute-Savoie.
.
Rapport ANSES;
,
2013
:
:46.
p.
30.
ANSES.
.
Investigations épidémiologiques suite à la détection d’un foyer de brucellose bovine en Haute-Savoie.
.
Rapport ANSES;
,
2022
:
:21.
p.
31.
ANSES.
.
Evaluation de l’efficacité de différents scénarios de lutte contre la brucellose dans les populations des bouquetins dans le massif du Bargy.
.
Rapport ANSES;
,
2021
:
:39.
p.
32.
ANSES.
.
Evaluation approfondie et réactualisée de mesures de maîtrise du foyer de brucellose chez les bouquetins du Bargy.
.
Rapport ANSES;
,
2017
:
:69.
p.
33.
ANSES.
.
Modalités de surveillance et de lutte contre la brucellose des bouquetins dans les massifs du Bargy et des Aravis et aux modalités de surveillance des cheptels de ruminants estivant dans le massif des Aravis.
.
Rapport ANSES;
,
2023
:
:39.
p.
34.
ANSES.
.
Définir et évaluer bibliographiquement les critères préalables à une approche vaccinale contre la brucellose chez les bouquetins du massif du Bargy.
.
Rapport ANSES;
,
2016
:
:29.
p.
35.
ANSES.
.
Pertinence de la vaccination des bouquetins du Bargy contre la brucellose.
.
Rapport ANSES;
,
2019
:
:114.
p.
36.
Calenge
C
,
Lambert
S
,
Petit
E
,
et al.
Estimating disease prevalence and temporal dynamics using biased capture serological data in a wildlife reservoir: the example of brucellosis in Alpine ibex (Capra ibex).
.
Prev Vet Med.
2021;
;
187
:
:1.
–
12
.
38.
Rossi
S
,
Petit
E
,
Marchand
P
,
et al.
Evolution du foyer de brucellose chez le bouquetin des Alpes dans le massif du Bargy, Haute Savoie, entre 2012 et 2020.
.
Bull Epidémiol Santé Anim Alim.
2012;
;
2021
:
:10.
.
39.
Lambert
S
,
Thébault
A
,
Rossi
S
,
et al.
Targeted strategies for the management of wildlife diseases: the case of brucellosis in Alpine ibex.
.
Vet Res.
2021;
;
52
:
:1.
–
16
.
40.
Richard
C
.
Rôle de la modélisation dans la lutte contre la brucellose au sein de la population de bouquetins du massif du Bargy.
.
Université Claude Bernard Lyon 1.
,
2021
.
41.
Zundel
E
,
Verger
JM
,
Grayon
M
,
et al.
Conjunctival vaccination of pregnant ewes and goats with Brucella melitensis Rev 1 vaccine: safety and serological responses.
.
Ann Rech Vet.
1992;
;
23
:
:177.
–
188
.
42.
Ponsart
C
,
Riou
M
,
Locatelli
Y
,
et al.
Expérimentation visant à comparer le niveau d’innocuité du vaccin Rev. 1 conjonctival chez le bouquetin des Alpes (Capra ibex) et la chèvre domestique (Capra hircus).
.
Rapport ANSES/ONCFS/INRA/MNHN.
,
2017
:
:56.
p.
43.
Ponsart
C
,
Riou
M
,
Locatelli
Y
,
et al.
Brucella melitensis Rev. 1 vaccination generates a higher shedding risk of the vaccine strain in Alpine ibex (Capra ibex) compared to the domestic goat (Capra hircus).
.
Vet Res.
2019;
;
50
:
:1.
–
13
.
44.
Gautier
A
.
One Health, un objet et un horizon de la santé.
.
Med Sci (Paris).
2023;
;
39
:
:695.
–
6
.
|