| |
| Med Sci (Paris). 39(10): 716–718. doi: 10.1051/medsci/2023120.Du nouveau concernant la vie sexuelle des méduses Maud Ginestet1 and Jean-René Huynh1* 1Collège de France, université Paris sciences et lettres (PSL), CNRS, Inserm, centre interdisciplinaire de recherche en biologie (CIRB)
,
Paris
,
France MeSH keywords: |
La reproduction permet à tous les organismes multicellulaires, des plantes aux vertébrés, de transmettre leur génome à leur descendance. Pour certains, cette reproduction est asexuée et la descendance est génétiquement identique à l’individu parent. En revanche, d’autres organismes se reproduisent de manière sexuée, ce qui implique de combiner deux copies du génome, issues de deux individus parents. Chaque parent ne transmet qu’une seule copie de son génome à sa descendance qui reçoit donc exactement deux copies. Ainsi, le descendant est diploïde, avec une copie du génome venant de sa mère et l’autre de son père. La reproduction sexuée repose sur des cellules spécialisées, les gamètes (ovules pour la femelle, spermatozoïdes pour le mâle), qui sont le produit d’une double division cellulaire nommée méiose. Chaque gamète possède une seule copie du génome, mais cette copie est elle-même un mélange des deux copies présentes chez cet individu parent. Par exemple, chez
Homo sapiens
, les quarante-six chromosomes sont répartis lors de la méiose en deux lots de vingt-trois chromosomes, formant ovules ou spermatozoïdes. Mais les vingt-trois chromosomes d’un spermatozoïde ou d’un ovule donné sont un mélange des chromosomes des parents de l’individu qui produit ces gamètes c’est-à-dire un mélange des chromosomes des grands-parents du futur fœtus, en cas de fécondation réussie.
|
Le rôle des cassures de l’ADN dans le déroulement de la méiose
Le mélange des deux copies du génome d’un individu pour produire ses gamètes nécessite d’abord de « casser » les chromosomes. C’est l’enzyme Spo11, présente chez de nombreuses espèces, qui génère les cassures double-brin de l’ADN lors de la méiose [
1
] (
→
).
(→) Voir la Synthèse de F. Baudat et B. de Massy,
m/s
n° 2, février 2004, page 213
La plupart du temps, les cassures double-brin de l’ADN sont dangereuses pour les cellules. Elles s’accumulent, par exemple, dans les cellules cancéreuses. Cependant, pendant la méiose, ces cassures ont lieu dans un cadre contrôlé, et chaque chromosome cassé est réparé à l’aide de l’autre copie du génome se trouvant sur le chromosome homologue. Pour qu’une telle réparation ait lieu, il faut toutefois que les deux copies soient suffisamment proches l’une de l’autre dans le noyau de la cellule. Selon les organismes, ce rapprochement des chromosomes homologues, ou appariement, peut avoir lieu à différents moments de la méiose. Chez la mouche du vinaigre
Drosophila melanogaster
ou le ver rond
Caenorhabditis elegans
, l’appariement des chromosomes homologues a lieu avant la formation des cassures. À l’inverse, chez la souris
Mus musculus
ou le poisson-zèbre
Danio rerio,
ce sont les cassures qui déclenchent l’appariement des chromosomes [
2
]. Laquelle de ces deux modalités est ancestrale, c’est-à-dire est apparue la première au cours de l’évolution ?
Tous les organismes modèles étudiés jusqu’à présent en laboratoire sont des bilatériens, ce qui signifie qu’ils possèdent un plan de symétrie unique (plan sagittal) qui divise le corps en deux moitiés, droite et gauche, constituant approximativement des images en miroir l’une de l’autre. Or, ce groupe d’animaux présente une grande diversité de mécanismes méiotiques, et ne permet pas de répondre à la question posée. Une stratégie pour tenter d’y répondre est d’étudier des organismes non-bilatériens, tels que les cnidaires, des animaux à symétrie radiale. Si les cnidaires partagent un caractère avec les bilatériens, ce caractère était probablement présent chez l’ancêtre commun à ces deux branches du monde vivant. Il s’agirait donc d’un caractère ancestral. Comment un cnidaire à symétrie radiale réalise-t-il donc la méiose ? En particulier, les cassures double-brin de l’ADN sont-elles nécessaires à l’appariement des chromosomes chez les cnidaires ou bien sont-elles une conséquence de cet appariement ? |
Clytia hemisphaerica
, un nouveau modèle pour l’étude de la méiose
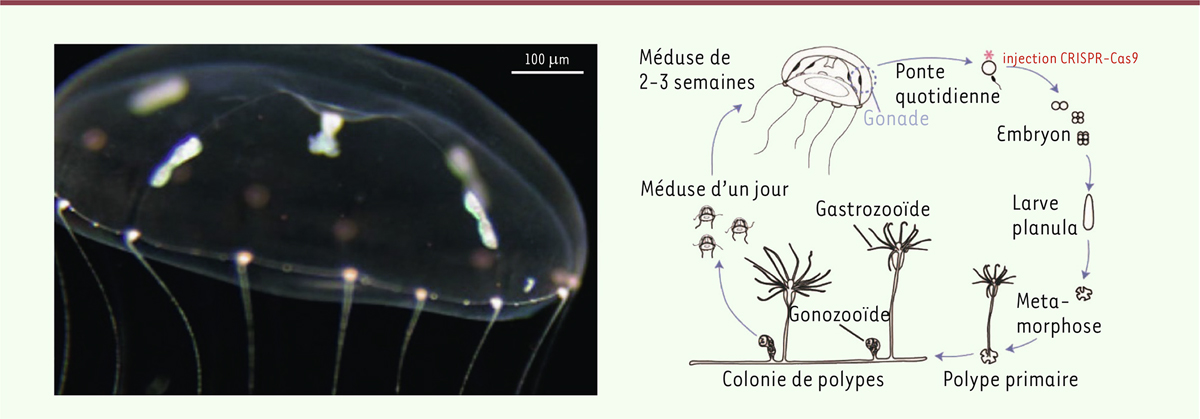
La méduse
Clytia hemisphaerica
, appartenant au groupe des cnidaires, a été identifiée en mer Méditerranée, dans la baie de Villefranche-sur-Mer, dans les années 2000, et est devenue depuis un modèle pour des recherches expérimentales en biologie du dévelopement [
3
]. Elle possède un cycle de vie à deux phases (
Figure 1
). Une phase est végétative : un polype fixé au fond marin se reproduit de manière asexuée, formant ainsi une colonie dont tous les individus sont des clones du parent. L’autre phase est sexuée : de petites méduses sont relâchées chaque jour par la colonie et peuvent se déplacer librement dans l’eau. Ces méduses, dont les cellules sont capable de réaliser une méiose, produisent des gamètes mâles et femelles qui peuvent, après la fécondation, donner naissance à un nouveau polype. Chaque méduse est dotée de quatre gonades, sièges de la méiose. À l’instar des végétaux,
Clytia hemisphaerica
a donc l’étonnante capacité de se reproduire à la fois de manière sexuée et asexuée !
 | Figure 1.
Cycle de vie de la méduse Clytia hemisphaerica
(d’après [
3
,
4
]).
|
La première étape de cette étude a été de produire des marqueurs permettant d’identifier les cellules en méiose chez
Clytia hemisphaerica
et d’observer le comportement des chromosomes pendant la méiose. À l’échelle cellulaire, les premières étapes de la méiose se sont révélées très similaires à celles décrites dans les autres espèces [
4
]. Lors de la première division cellulaire, les trente chromosomes de cette méduse s’apparient, puis les chromosomes homologues de chaque paire se séparent et se répartissent entre les deux cellules filles, qui ne conservent donc que quinze chromosomes chacune. Lors de la seconde division, la quantité d’ADN de la cellule mère est divisée par deux dans les cellules filles, mais chacune conserve le même nombre de chromosomes (quinze) que dans la cellule mère. Les deux copies du génome parental sont mélangées lors de ces deux divisions.
|
Étude moléculaire et fonctionnelle des cassures double brin de l’ADN réalisées par l’enzyme Spo11
La nouveauté de cette étude tient à la comparaison fonctionnelle entre espèces, rendue possible par la génération d’une des premières lignées mutantes de
Clytia hemisphaerica
. Le gène codant l’enzyme Spo11 a été inactivé en utilisant la technique CRIPSR-Cas9, empêchant ainsi la production des cassures double-brin dans l’ADN pendant la méiose.
Les méduses mutantes dépourvues de Spo11 présentent des défauts de méiose [
4
]. En effet, les chromosomes ne peuvent pas s’apparier en absence de
Spo11
. Alors que chez les méduses de génotype « sauvage », les trente chromosomes s’apparient pour former quinze paires lors de la méiose, chez les méduses mutantes, aucune paire de chromosomes ne se forme, et on distingue toujours 30 chromosomes individuels lors de la méiose (
Figure 2
). En conséquence, la première division de méiose échoue souvent et ne produit qu’une seule cellule ayant gardé les deux copies des chromosomes. À l’issue de la seconde division de méiose, elle aussi perturbée, les gamètes ont souvent deux ou même plus (trois ou quatre) copies du génome, alors que les gamètes des méduses non mutantes pour
Spo11
n’en ont qu’une seule. Étonnamment, ces méduses mutantes sont fertiles, ce qui n’est pas le cas de la plupart des mutants dépourvus de Spo11 dans d’autres espèces. Les gamètes des méduses mutantes, avec par exemple deux copies des chromosomes, ont la capacité de donner naissance à une larve après la fécondation par un gamète mâle normal, possédant seulement une copie des chromosomes. Cette larve, qui contient trois copies des chromosomes (triploïde), est capable de former un polype, puis une nouvelle colonie.
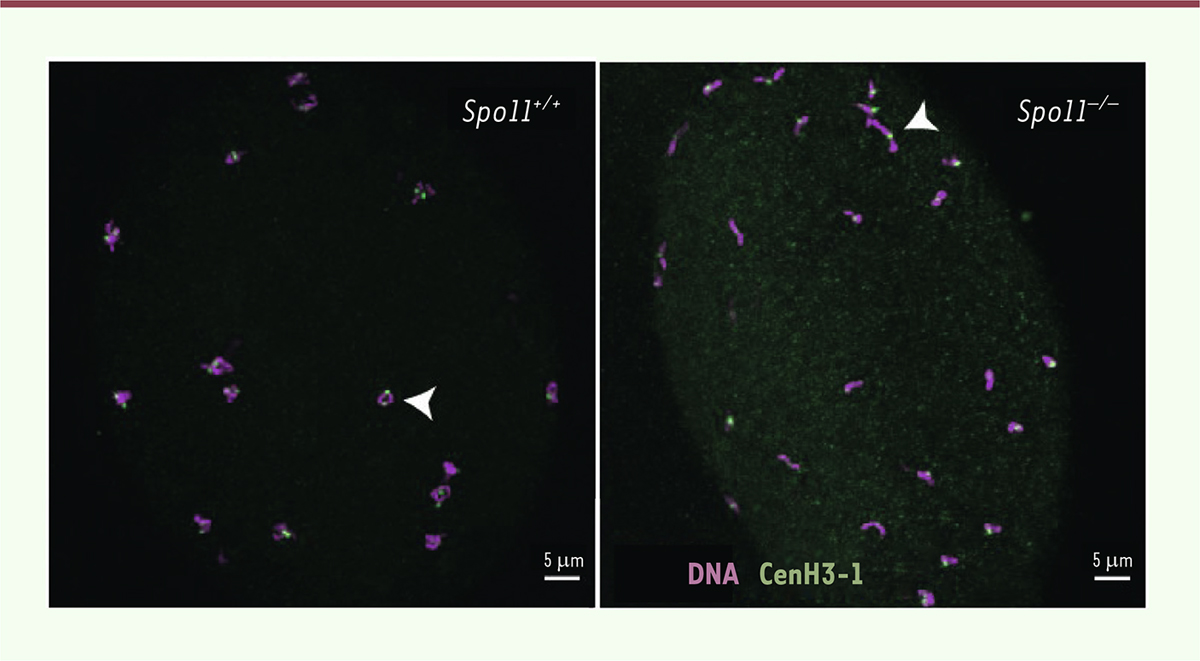
 | Figure 2.
Ovocytes de méduse Clytia hemisphaerica de génotype «sauvage», ou de méduse mutante dépourvue de l’enzyme Spo11.
Chez la méduse témoin, pourvue de Spo11 (à gauche), on observe 15 paires de chromosomes, alors que chez celle qui en est dépourvue (à droite), on observe environ 30 chromosomes non appariés (têtes de flèche). Les photographies ont été prises en microscopie confocale. L’ADN apparaît en violet (coloration Hoechst) et les centromères, un par chromosome, en vert (immunomarquage de l’histone centromérique CENH3-1).
|
|
Cette étude réalisée chez
Clytia hemisphaerica
montre que les cassures double brin de l’ADN produites par l’enzyme Spo11 sont nécessaires à l’appariement des chromosomes, puis à leur ségrégation correcte lors de la première division de méiose. Cela est vrai également chez le poisson-zèbre et la souris, mais pas chez la mouche du vinaigre ou le ver rond
C. elegans
[
3
]. L’état ancestral de ce caractère semble donc être que l’appariement des chromosomes dépend de la présence de cassures double-brin de l’ADN, car ce caractère est partagé par les cnidaires et les bilatériens. L’hypothèse la plus probables est donc que certains invertébrés aient perdu ce caractère au cours de l’évolution.
Clytia hemisphaerica
est, quant à ce caractère, plus proche de la souris et de l’homme que de la drosophile.
De plus,
Clytia hemisphaerica
est particulièrement résistante à la polyploïdie. Les méduses polyploïdes sont non seulement viables, mais semblent aussi fertiles en donnant naissance à des larves contenant un nombre variable de copies du génome (deux, trois ou quatre copies, d’après des résultats préliminaires). Comment les cellules germinales, qui possèdent un trop grand nombre de chromosomes, et surtout, un nombre impair de copies, parviennent-elles tout de même à réaliser la méiose ? Les futurs descendants de ces méduses mutantes sont attendus impatiemment au laboratoire pour tenter de répondre à cette question !
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions Catriona Munro et Evelyn Houliston (Sorbonne université, CNRS, observatoire de Villefranche-sur-Mer) pour leur participation à cette étude.
|
1.
Baudat
F
,
de Massy
B
.
SPO11: une activité de coupure de l’ADN indispensable à la méiose.
.
Med Sci (Paris).
2004;
;
20
:
:213.
–
218
.
2.
Rubin
T
,
Macaisne
N
,
Huynh
JR
.
Mixing and matching chromosomes during female meiosis.
.
Cells.
2020;
;
9
:
:696.
.
3.
Houliston
E
,
Momose
T
,
Manuel
M
.
Clytia hemisphaerica: a jellyfish cousin joins the laboratory.
.
Trends Genet.
2010;
;
26
:
:159.
–
167
.
4.
Munro
C
,
Cadis
H
,
Pagnotta
S
,
et al
.
Conserved meiotic mechanisms in the cnidarian Clytia hemisphaerica revealed by Spo11 knockout.
.
Sci Adv.
2023;
;
9
:
:eadd2873.
.
|