| |
| Med Sci (Paris). 39(10): 712–715. doi: 10.1051/medsci/2023119.La signalisation NOD2 au cœur des interactions entre microbiote et croissance linéaire dans un modèle murin de malnutrition juvénile Amélie Joly1* and François Leulier1 1Institut de génomique fonctionnelle de Lyon (IGFL), école normale supérieure de Lyon, CNRS UMR5242, université Claude Bernard Lyon-1
,
Lyon
,
France MeSH keywords: Animaux, Souris, Microbiote, Transduction du signal |
En 2020, près de 150 millions d’enfants âgés de moins de 5 ans souffraient encore de sous-nutrition à travers le monde [
1
]. Ces enfants présentent notamment un retard de croissance linéaire, c’est-à-dire une taille trop petite pour leur âge. Chez les mammifères, la croissance linéaire est contrôlée par l’axe hormonal somatotrope
via
l’hormone de croissance (
growth hormone,
GH) et l’IGF-1 (
insulin-like growth factor 1
). La sous-nutrition chronique entraîne un état de résistance à la GH, et est associée à de plus faibles concentrations sériques d’IGF-1 [
2
]. Récemment, la sous-nutrition a également été associée à un retard de maturation du microbiote intestinal [
3
]. Nous avions précédemment montré que des souris axéniques, qui sont dépourvues de microbiote, ont un retard de croissance par rapport à des souris dites « conventionnelles » (
i.e.
, possédant un microbiote complexe), qu’elles soient malnutries ou nourries avec un régime alimentaire standard [
4
]. De plus, la mono-colonisation de l’intestin de souris axéniques malnutries par la bactérie probiotique
Lactiplantibacillus plantarum
(souche Lp
WJL
) mime les effets bénéfiques d’un microbiote complexe sur la croissance linéaire et sur l’axe somatotrope de ces souris [
4
]. Depuis, nous avons complété ce résultat en explorant les effets d’un traitement quotidien par voie orale avec la souche probiotique Lp
WJL
chez des souris conventionnelles en condition de malnutrition [
5
]. Nous avons ensuite étudié les mécanismes par lesquels cette bactérie particulière affecte la croissance de son hôte [
5
].
|
Une supplémentation avec la bactérie probiotique Lp
WJL
améliore la croissance linéaire de souris juvéniles en condition de malnutrition
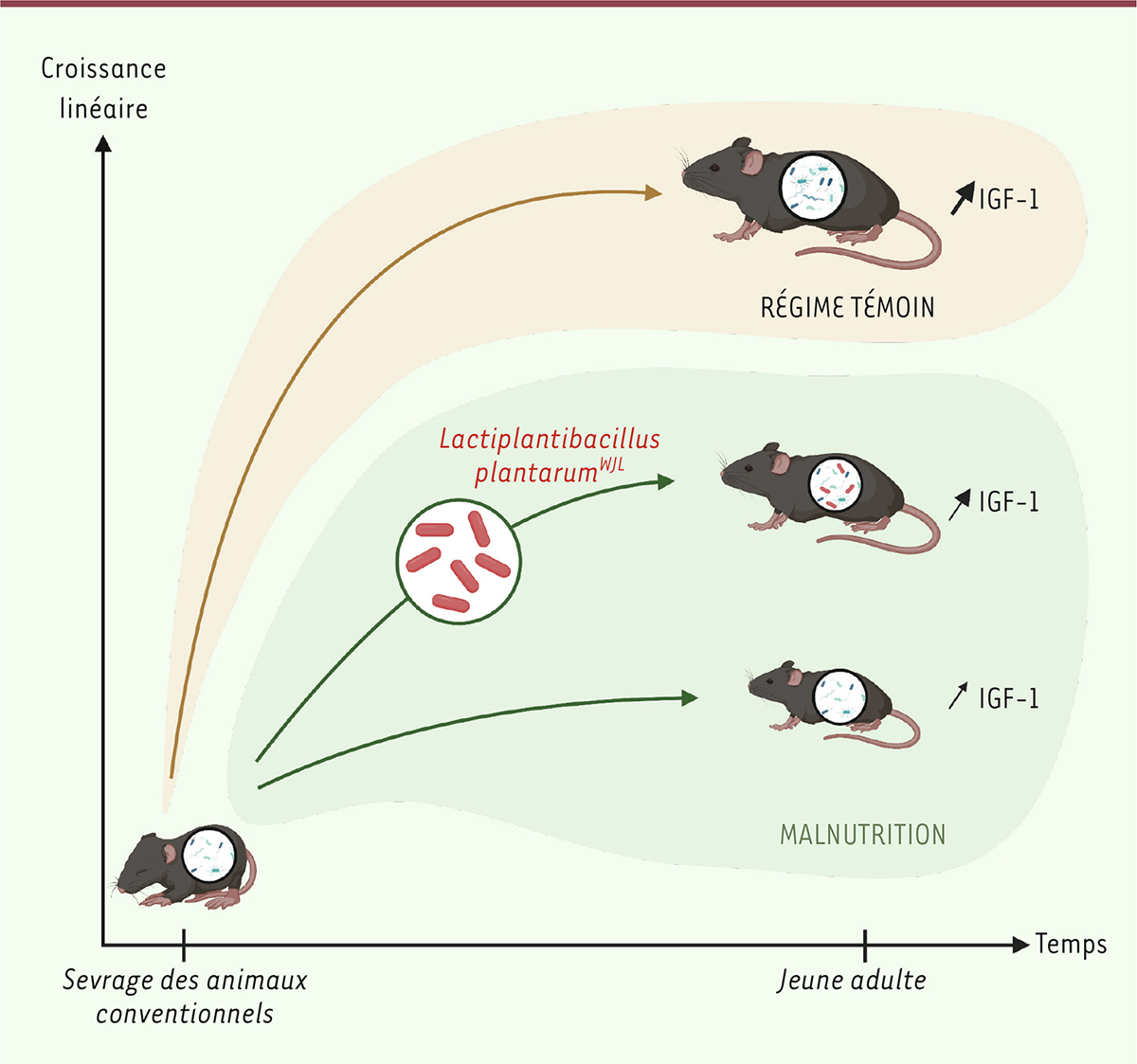
Afin de modéliser la sous-nutrition chronique chez des souris conventionnelles, nous avons utilisé, après le sevrage, un régime alimentaire à faible teneur en protéines et en lipides par comparaison à un régime isocalorique témoin. Les souris malnutries présentent un retard de croissance en poids et en taille par rapport aux souris témoins, et ce retard de croissance est accompagné d’une réduction de la production d’IGF-1 et de la signalisation IGF-1 dans le foie.
Pour étudier l’effet de la bactérie probiotique Lp
WJL
dans ce contexte, des souris malnutries ont été traitées par ingestion quotidienne de 10
8
UFC (unité formant colonie) de cette bactérie ou d’un placebo pendant cinq semaines après le sevrage. Le traitement avec la bactérie probiotique Lp
WJL
suffit à améliorer la croissance linéaire des animaux malnutris. En effet, les souris malnutries traitées avec Lp
WJL
sont en moyenne 3,5 % plus grandes que celles traitées avec le placebo et 10 % plus lourdes, mais toujours plus petites et plus légères que des souris bien nourries. Le traitement avec Lp
WJL
entraîne également une augmentation de la production hépatique d’IGF-1, compensant partiellement les effets délétères de la malnutrition sur l’axe hormonal somatotrope (
Figure 1
).
 | Figure 1.
La bactérie probiotique Lactiplantibacillus plantarum WJL (Lp
WJL
) restaure partiellement la croissance linéaire des jeunes souris malnutries.
Des souris dites « conventionnelles » sont nourries, pendant 5 semaines après le sevrage, avec un règime alimentaire tèmoin ou avec un règime alimentaire mimant la malnutrition infantile. Les souris malnutries prèsentent un retard de croissance par rapport aux souris tèmoins. Ce retard est moindre pour les souris auxquelles on a administrè quotidiennement une solution de bactèrie Lp
WJL
dans le creux de la joue. La taille des flèches noires est proportionnelle au taux d’IGF-1 sèrique (figure crèèe avec le logiciel Biorender.com).
|
Étonnamment, les effets bénéfiques de Lp
WJL
semblent spécifiques à cette souche de bactérie. En effet, un traitement des souris malnutries avec une autre souche de
L. plantarum
(souche Lp
NIZO2877
) n’améliore pas leur croissance en taille ou en poids, ni le fonctionnement de l’axe somatotrope. Les fondements moléculaires de cette spécificité de souche dans la réponse des souriceaux au traitement par
L. plantarum
restent à explorer.
|
L’effet bénéfique de l’apport de Lp
WJL
est lié à la détection de molécules de la paroi bactérienne par le récepteur NOD2
Le fait que les effets bénéfiques de
L. plantarum
soient restreints à une souche particulière de cette bactérie suggère l’existence d’un dialogue moléculaire spécifique avec les cellules de l’hôte. Or, les parois des bactéries sont des déterminants cruciaux dans les interactions moléculaires entre l’hôte et ses microbes commensaux [
6
]. En effet, nous avons précédemment montré que les effets bénéfiques de Lp
WJL
sur la croissance de la larve de drosophile en condition de malnutrition étaient associés à la détection de fragments de paroi de la bactérie par son hôte [
7
]. Nous avons donc supposé que la détection de la paroi de Lp
WJL
pouvait également être au cœur des interactions moléculaires permettant à cette bactérie de promouvoir la croissance des jeunes souris. Pour tester cette hypothèse, des souris juvéniles conventionnelles malnutries ont été traitées avec des bactéries Lp
WJL
inactivées par la chaleur, ou avec des extraits purifiés de paroi de Lp
WJL
. Dans les deux cas, la croissance linéaire et la signalisation de l’axe somatotrope ont été améliorées par rapport à celles des jeunes souris traitées avec un placebo.
Les molécules de la paroi des bactéries peuvent être détectées par des récepteurs impliqués dans l’immunité innée [
8
]. En utilisant un système cellulaire rapporteur, nous avons testé
in vitro
la capacité de bactéries Lp
WJL
inactivées par la chaleur ou d’extraits purifiés de paroi de Lp
WJL
à activer plusieurs de ces récepteurs. Nous avons observé que ces dérivés de Lp
WJL
étaient capables d’activer le récepteur NOD2 (
nucleotide-binding oligomerization domain 2
). Nous avons donc émis l’hypothèse que ce récepteur était impliqué dans les effets bénéfiques de Lp
WJL
sur l’hôte. Pour tester cette hypothèse
in vivo
, nous avons étudié la réponse de souris mutantes privées du récepteur NOD2 (souris
Nod2
-/-
) et soumises à un régime de malnutrition et à un traitement par Lp
WJL
ou par un placebo. Contrairement aux souris de génotype sauvage, les souris
Nod2
-/-
malnutries traitées avec Lp
WJL
ou avec le placebo ont une croissance similaire et des taux sériques d’IGF-1 comparables. Ce résultat montre que la présence d’un récepteur NOD2 fonctionnel sur les cellules de l’hôte est nécessaire aux effets bénéfiques de Lp
WJL
chez les souris malnutries.
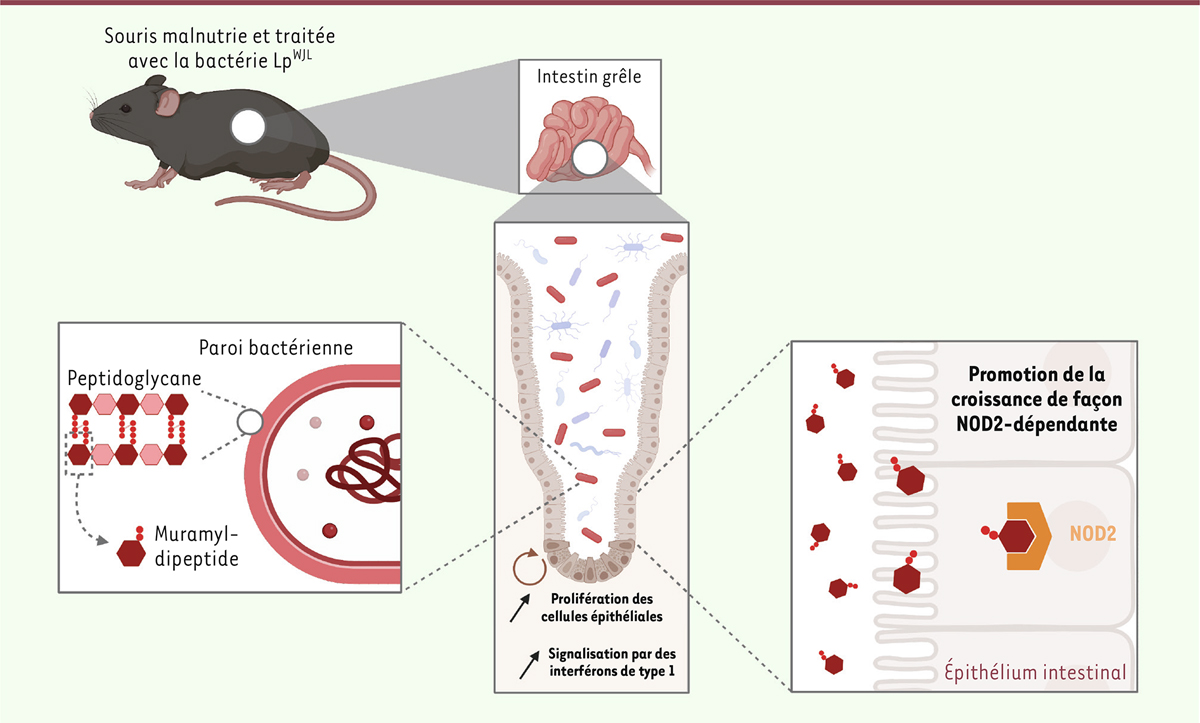
Un composant spécifique de la paroi bactérienne, le muramyldipeptide présent dans les polymères de peptidoglycanes [
8
], se lie au récepteur NOD2, ce qui déclenche une signalisation intracellulaire. Des souris malnutries traitées avec du muramyldipeptide ont une meilleure croissance et des taux sériques d’IGF-1 plus élevés que des souris traitées avec un placebo. L’activation du récepteur NOD2 par ce composant de la paroi bactérienne est donc suffisante pour induire une amélioration de la croissance chez les animaux malnutris (
Figure 2
).
 | Figure 2.
Des molécules issues de la paroi de la bactérie se lient au récepteur de l’immunité innée NOD2 présent sur les cellules de l’épithélium intestinal pour promouvoir la croissance des souris.
La paroi bactérienne est composée de peptidoglycanes, qui sont des polymères de polysaccharides liès par des liaisons osidiques et branchés entre eux par des ponts peptidiques. Le muramyldipeptide (MDP) est un dérivé du peptidoglycane naturellement produit et relargué par les bactéries en cours de division, qui peut être reconnu par le récepteur de l’immunité NOD2. L'administration de MDP ou des fragments de paroi purifiée de la bactérie Lp
WJL
à des souris malnutries suffit à améliorer leur croissance linéaire. La présence du récepteur NOD2 dans les cellules de l’épithélium intestinal est nécessaire à l'effet bénéfique de Lp
WJL
sur la croissance (figure créée avec le logiciel Biorender.com).
|
|
L’action de Lp
WJL
sur l’homéostasie de l’épithélium intestinal dépend de l’activité de NOD2 dans ce tissu
L’épithélium intestinal est constitué d’une seule couche de cellules recouvrant les villosités et les cryptes intestinales, et directement au contact des molécules dérivées des nutriments et des bactéries du microbiote qui se trouvent dans la lumière intestinale. Cet épithélium est en permanence renouvelé à partir de cellules souches situées à la base des cryptes intestinales. Nous avons constaté une diminution du nombre de cellules en train de proliférer dans l’épithélium intestinal des jeunes souris malnutries (indiquant une baisse de son taux de renouvellement), qui peut être en partie corrigée par un traitement de ces souris avec Lp
WJL
. En analysant le transcriptome des cellules intestinales du jéjunum de souris malnutries traitées avec Lp
WJL
ou avec un placebo, nous avons constaté une augmentation de l’expression de nombreux gènes associés à la signalisation par l’interféron de type 1 (IFN-1) chez celles traités avec Lp
WJL
.
La stimulation de NOD2 dans l’épithélium intestinal contribue à la survie et au renouvellement des cellules souches épithéliales d’une part [
9
], et induit une réponse IFN-1 d’autre part [
10
]. Nous avons donc recherché comment ces paramètres étaient affectés chez les souris
Nod2
-/-
malnutries traitées avec Lp
WJL
. Chez ces souris, contrairement aux souris de génotype sauvage, nous n’avons pas observé d’augmentation de la prolifération des cellules épithéliales en réponse au traitement par Lp
WJL
, ni d’induction de la réponse IFN-1. Ces résultats confirment le rôle clé de NOD2 dans la réponse de l’hôte à la présence de Lp
WJL
dans l’intestin (
Figure 2
).
|
L’amélioration de la croissance linéaire chez les souris juvéniles malnutries implique la détection de Lp
WJL
par NOD2 dans l’épithélium intestinal
Afin de vérifier que les effets bénéfiques de la bactérie Lp
WJL
sur l’hôte impliquent un dialogue entre NOD2 et Lp
WJL
dans l’intestin, nous avons sélectivement inactivé le gène codant le récepteur NOD2 dans les cellules de l’épithélium intestinal des souris par ingénierie génétique en utilisant le système cre-lox. Les animaux mosaïques obtenus (seules leurs cellules intestinales sont porteuses de l’inactivation de
Nod2
) ont ensuite été alimentés avec un régime de malnutrition et traités avec Lp
WJL
ou avec un placebo pendant la période juvénile. Nous avons constaté l’absence d’effets bénéfiques de Lp
WJL
sur la croissance linéaire, le taux sérique d’IGF-1, la prolifération cellulaire dans l’épithélium intestinal, et la signalisation IFN-1 chez ces souris. Ce résultat indique que les effets bénéfiques de Lp
WJL
sur les souris en condition de malnutrition juvénile nécessitent l’activité du récepteur NOD2 dans l’épithélium intestinal (
Figure 2
).
|
Cette étude montre qu’un traitement avec la bactérie probiotique
Lactiplantibacillus plantarum
WJL (ou avec des fragments de sa paroi bactérienne) permet d’accroître la croissance linéaire des animaux dans un modèle murin de malnutrition juvénile, alors que d’autres souches de cette espèce bactérienne n’ont pas d’effet sur la croissance. La souche WJL de
L. plantarum
participe également à l’amélioration d’autres paramètres physiologiques, tels que la production d’insuline ou la tolérance au glucose de l’hôte. La présence de NOD2, un récepteur impliqué dans l’immunité innée capable de détecter des molécules issues de la paroi des bactéries, dans les cellules de l’épithélium intestinal est nécessaire aux effets bénéfiques de
L. plantarum
WJL. En nous fondant sur l’ensemble des résultats obtenus chez la souris, nous suggérons que, couplé à une stratégie de renutrition adaptée, un traitement avec des bactéries probiotiques telles que
L. plantarum
WJL pourrait alléger le fardeau de la malnutrition chez les enfants.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Global Nutrition Report: Stronger commitments for greater action.
.
Bristol, UK:
:
Development initiatives;
,
2022
.
2.
Fazeli
PK
,
Klibanski
A
.
Determinants of GH resistance in malnutrition.
.
J Endocrinol.
2014;
;
220
:
:R57.
–
R65
.
3.
Smith
MI
,
Yatsunenko
T
,
Manary
MJ
,
et al.
Gut microbiomes of Malawian twin pairs discordant for kwashiorkor.
.
Science.
2013;
;
339
:
:548.
–
554
.
4.
Schwarzer
M
,
Makki
K
,
Storelli
G
,
et al.
Lactobacillus plantarum strain maintains growth of infant mice during chronic undernutrition.
.
Science.
2016;
;
351
:
:854.
–
857
.
5.
Schwarzer
M
,
Gautam
UK
,
Makki
K
,
et al
.
Microbe-mediated intestinal NOD2 stimulation improves linear growth of undernourished infant mice.
.
Science.
2023;
;
379
:
:826.
–
33
.
6.
Chapot-Chartier
M-P
,
Kulakauskas
S
.
Cell wall structure and function in lactic acid bacteria.
.
Microb Cell Factories.
2014;
;
13
:
:S9.
.
7.
Erkosar
B
,
Storelli
G
,
Mitchell
M
,
et al.
Pathogen virulence impedes mutualist-mediated enhancement of host juvenile growth via inhibition of protein digestion.
.
Cell Host Microb.
2015;
;
18
:
:445.
–
455
.
8.
Caruso
R
,
Warner
N
,
Inohara
N
,
Núñez
G
.
NOD1 and NOD2: signaling, host defense, and inflammatory disease.
.
Immunity.
2014;
;
41
:
:898.
–
908
.
9.
Nigro
G
,
Rossi
R
,
Commere
P-H
,
et al.
The cytosolic bacterial peptidoglycan sensor Nod2 affords stem cell protection and links microbes to gut epithelial regeneration.
.
Cell Host Microbe.
2014;
;
15
:
:792.
–
798
.
10.
Pandey
AK
,
Yang
Y
,
Jiang
Z
,
et al.
NOD2, RIP2 and IRF5 play a critical role in the type I interferon response to Mycobacterium tuberculosis.
.
PLoS Pathog.
2009;
;
5
:
:e1000500.
.
|