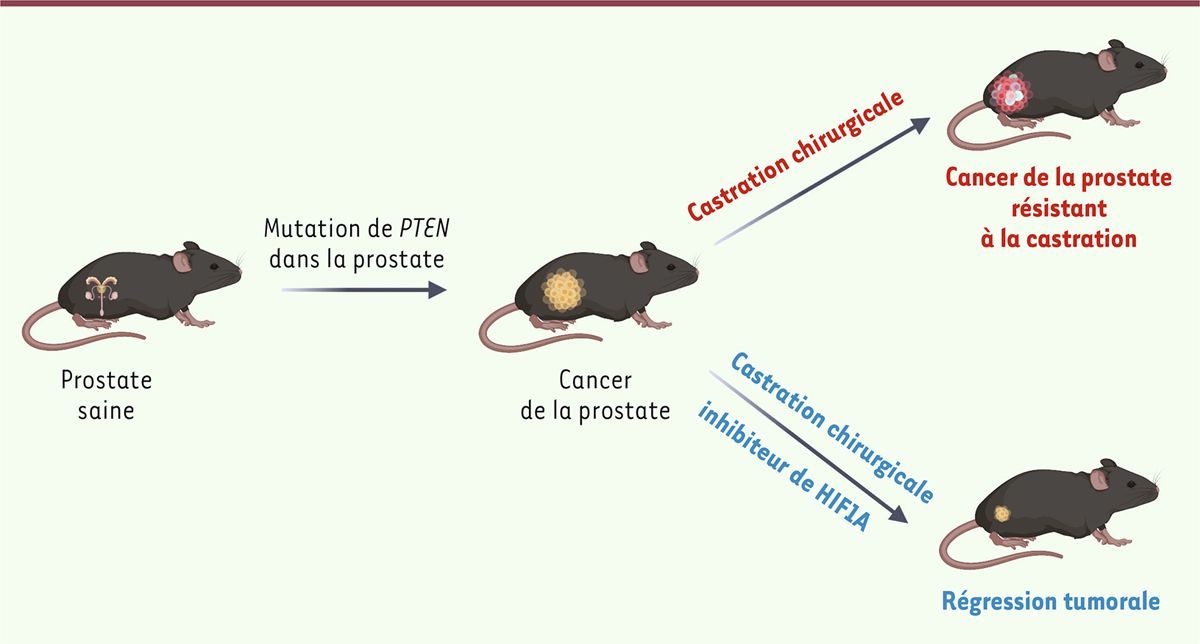
Le cancer de la prostate est le deuxième cancer le plus fréquent dans le monde [ 1 ] et la cinquième cause de décès par cancer [ 2 ]. Pour les tumeurs localisées, les options curatives comprennent l’exérèse chirurgicale de la prostate, la radiothérapie externe ou la curiethérapie à faible dose. Cependant, ces traitements induisent souvent des effets secondaires, tels que l’impuissance, l’incontinence et l’infertilité [ 3 ]. La pierre angulaire du traitement médical des formes localisées à haut risque, ou des maladies cancéreuses avancées, repose sur la privation androgénique, qui consiste à supprimer la voie de signalisation des androgènes en atteignant des taux de testostérone très faibles (équivalents à ceux observés après une exérèse chirurgicale des deux testicules). L’hormonothérapie anti-cancéreuse (inhibiteurs compétitifs du récepteur des androgènes) ou les traitements par anti-androgènes de deuxième génération (qui inhibent en plus la liaison du récepteur à l’ADN) permettent de contrôler une partie des tumeurs prostatiques, mais environ 30 % des patients rechutent après le traitement de première intention, et la quasi-totalité des patients au stade métastatique progresse vers un état d’indépendance androgénique, appelé cancer de la prostate résistant à la castration, de mauvais pronostic [ 1 , 4 ].
PTEN , un gène suppresseur de tumeur impliqué dans la progression de la maladie cancéreuse localisée vers cet état de résistance à la castration, est muté dans 12 % des cancers de la prostate sensibles à la castration, localisés ou métastatiques, et chez plus de 40 % des patients avec un cancer de la prostate résistant à la castration [ 5 ]. Pour élucider les mécanismes de résistance aux traitements anti-androgéniques, nous avons produit des souris génétiquement modifiées Pten (i)pe-/- , chez lesquelles le gène Pten est sélectivement inactivé dans les cellules épithéliales de la prostate après la puberté. Ces souris développent des cancers de la prostate qui reproduisent la maladie cancéreuse humaine, avec d’abord une phase de lésions intraépithéliales néoplasiques, et, après une phase de latence, l’apparition d’adénocarcinomes invasifs [ 6 , 7 ]. Nous avons montré que les lésions pré-néoplasiques de ces souris sont hypoxiques, et que le facteur de transcription inductible par l’hypoxie HIF1A est impliqué dans l’évolution maligne de leurs tumeurs [ 8 ].
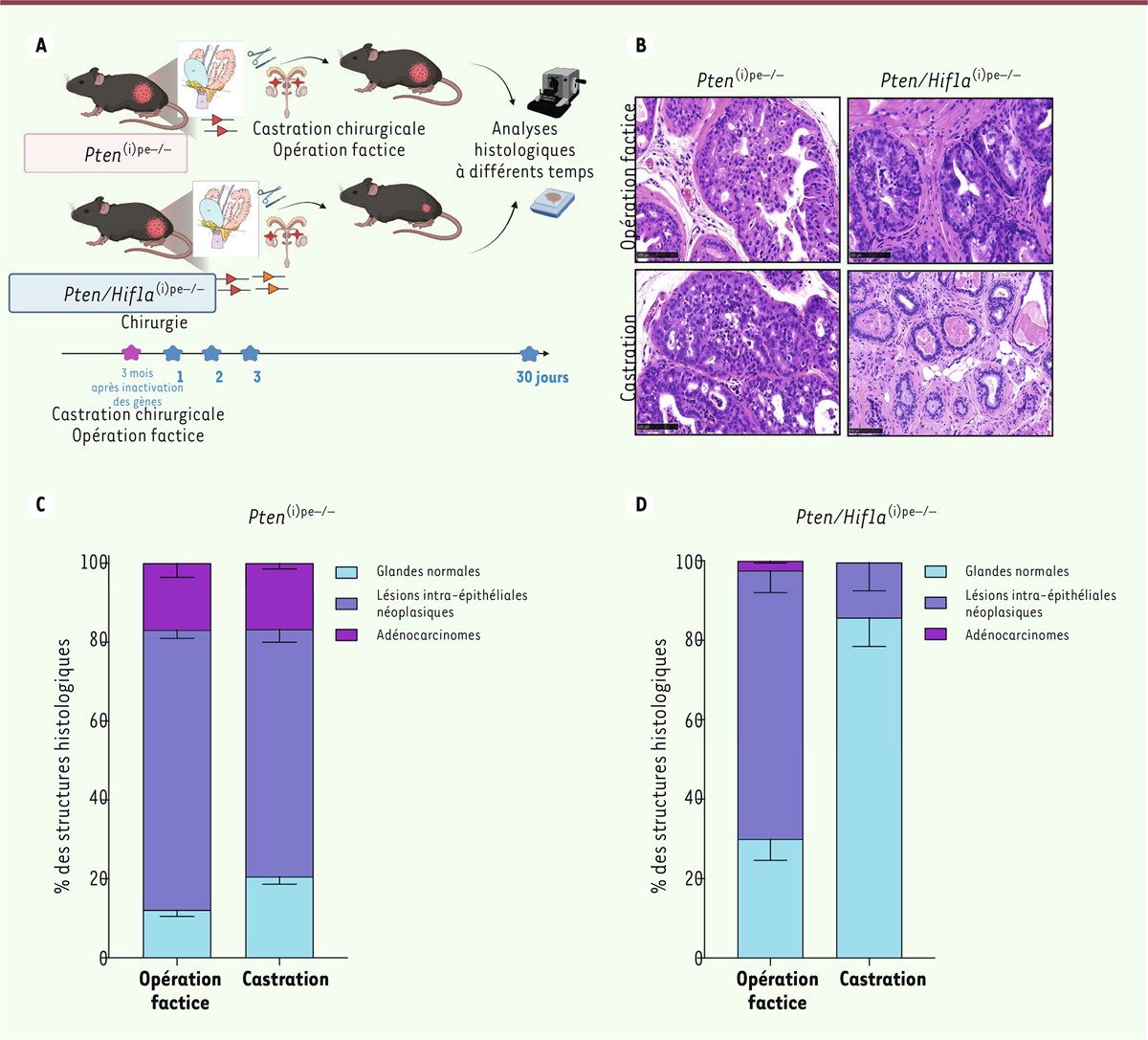
Pour étudier l’effet de la privation androgénique, des souris Pten (i)pe-/- porteuses de tumeurs de la prostate ont subi une castration chirurgicale (ablation des testicules) ou une opération factice sans ablation des testicules. L’analyse histologique des tumeurs a révélé la même proportion de lésions intraépithéliales néoplasiques et d’adénocarcinomes dans les deux groupes de souris, qu’elles aient subi une castration ou pas ( Figures 1A, B, C ) [ 9 ]. Ces tumeurs sont donc résistantes à la castration. Pour caractériser les fondements moléculaires de la survie des cellules épithéliales prostatiques après la privation d’androgènes, une analyse des transcriptomes de cellules uniques de tumeurs prostatiques a été effectuée. Elle a montré que la voie de signalisation de l’hypoxie, et particulièrement de HIF1A, est suractivée après privation androgénique. L’analyse a révélé que des cellules luminales de l’épithélium prostatique des souris Pten (i)pe/- présentent des sensibilités différentes à la privation d’androgène. En effet, alors que la plupart des cellules luminales-A, caractérisées par une forte expression de gènes cibles des androgènes (tels que Pbsn [ probasin ] , Nkx3-1 [ NK3 homeobox 1 ] , Tgm4 [ transglutaminase 4 ]), et représentant moins de 10 % des cellules, sont éliminées par la castration, les cellules luminales-C, caractérisées par l’expression des gènes marqueurs de cellules souches Tacstd2 (gène codant le transducteur de signal calcique associé aux tumeurs 2) , Krt4 (gène codant la cytokératine-4), Ly6a (gène codant le lymphocyte antigen 6 family member A ), sont résistantes à la castration, en accord avec la récente découverte de la résistance intrinsèque des cellules luminales exprimant Tacstd2 à la castration [ 10 ]. Les cellules luminales-C persistantes sont caractérisées par l’activation des voies de signalisation liées à l’inflammation. Nous avons également constaté que la privation androgénique augmente l’expression des cytokines dans les lésions néoplasiques et stimule l’infiltration prostatique par des cellules myéloïdes, favorisant ainsi un environnement immunosuppressif. Enfin, la transglutaminase 2, dont la présence dans les biopsies de prostate au moment du diagnostic est corrélée à un taux de survie plus faible chez les patients atteints de cancer de la prostate [ 8 ], était davantage exprimée après la castration des souris, ce qui suggère que la privation androgénique, en induisant une plasticité cellulaire, ne serait pas bénéfique à tous les patients.
| Figure 1.
A.
Schéma des expériences menées pour déterminer l’effet de privation androgénique chez les souris Pten
(i)pe-/-
et les souris Pten/Hif1a
(i)pe-/-
.
B.
Coupes transversales de la prostate de souris Pten
(i)pe-/-
et de souris Pten/Hif1a
(i)pe-/-
, opérées trois mois après l’inactivation des gènes et analysées un mois plus tard. Barres d’échelle = 100µm.
C, D
. Graphiques montrant les pourcentages de prostates saines, et de prostates contenant des lésions intraépithéliales néoplasiques ou des adénocarcinomes chez des souris Pten
(i)pe-/-
(C)
et chez des souris Pten/Hif1a
(i)pe-/-
(D)
opérées trois mois après l’inactivation des gènes et analysées un mois plus tard (n = 3 souris pour chaque génotype).
|
Afin de déterminer le rôle de HIF1A dans les cellules épithéliales prostatiques lors de la castration, nous avons produit des souris Pten/Hif1a (i)pe-/- , qui présentent des tumeurs prostatiques dépourvues de PTEN et HIF1A. Nous avons montré que la castration de ces souris a un effet antitumoral rapide (induction d’apoptose dès deux jours après la privation androgénique, puis régression des tumeurs un mois après), et durable (persistant au moins cinq mois) ( Figures 1A, B, D ) [ 9 ]. De plus, en administrant un inhibiteur pharmacologique de HIF1A (le PX-478) aux souris Pten (i)pe-/- en plus de la privation androgénique par castration chirurgicale, nous avons également observé des réponses thérapeutiques durables ( Figure 2 ). Enfin, nous avons montré que le PX-478 augmente la mort cellulaire, quantifiée par les niveaux de caspase 3 clivée (CC3) et de poly (ADP-ribose) polymérase clivée (CPARP) dans les cellules humaines de cancer de la prostate résistant à la castration, et que les signaux d’apoptose étaient renforcés lorsque le PX-478 était combiné à l’enzalutamide, un inhibiteur de la voie de signalisation des androgènes utilisé chez les patients présentant un cancer de la prostate métastatique.
Les résultats de ces travaux de recherche dans des modèles murins de cancer de la prostate soulignent l’importance d’analyser la signalisation tumorale de HIF1A chez les patients dont la maladie cancéreuse progresse après la privation androgénique, et ouvrent la voie à l’évaluation clinique des inhibiteurs de HIF1A chez les hommes présentant un cancer de la prostate résistant à la castration.