| |
| Med Sci (Paris). 39(10): 706–708. doi: 10.1051/medsci/2023116.Spécialisation fonctionnelle des populations de macrophages dans les amygdales palatines Élodie Segura1* 1Institut Curie, Inserm U932
,
Paris
,
France MeSH keywords: Humains, Tonsille palatine, Macrophages |
Les macrophages jouent un rôle central dans l’homéostasie tissulaire et la défense contre les microorganismes pathogènes. Les résultats d’un ensemble d’études réalisées dans des modèles murins au cours de la dernière décennie ont profondément transformé notre compréhension de ces cellules. Ces travaux ont montré que plusieurs populations de macrophages co-existent dans chaque tissu [
1
,
2
]. Les macrophages dits « résidents » ont une durée de vie longue et peuvent se renouveler par prolifération
in situ
. Ils sont initialement issus de cellules précurseurs embryonnaires, mais sont remplacés au cours de la vie (ou après un épisode inflammatoire) par différenciation de monocytes circulant dans le sang. De plus, des macrophages à durée de vie courte sont présents dans la peau et les muqueuses, et sont constamment remplacés par recrutement de monocytes. Cependant, l’existence de ces différentes populations est mal documentée dans l’espèce humaine. Dans la mesure où l’homme et la souris diffèrent considérablement dans leur exposition aux stimulus environnementaux, des différences notables pourraient exister entre ces deux espèces, ce qui souligne l’importance d’étudier les populations de macrophages présentes dans les tissus humains. Nous avons pris comme objet d’étude un organe lymphoïde de la gorge : les amygdales palatines [
3
].
|
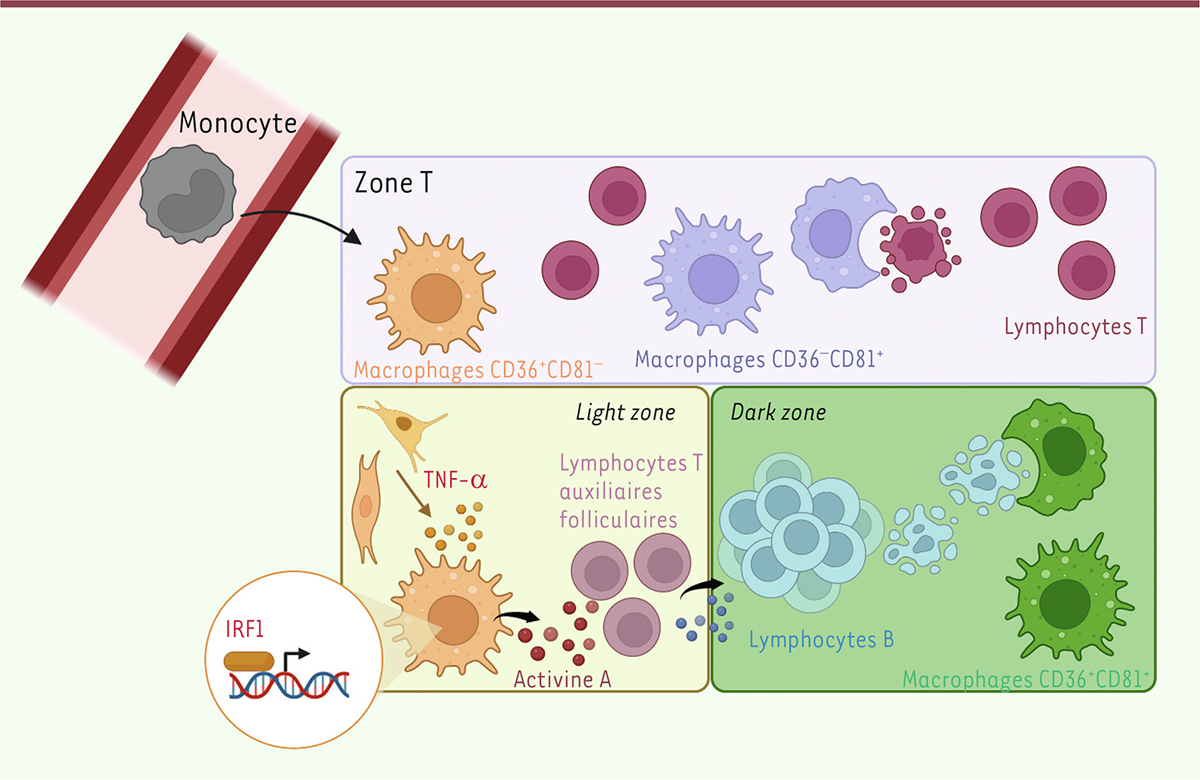
Les amygdales humaines contiennent trois populations de macrophages dont les cycles de vie sont différents
L’analyse transcriptomique de cellules individuelles (ou scRNA-seq pour
single-cell RNA-sequencing
) nous a permis d’identifier trois populations différentes de macrophages dans les amygdales, et de valider des marqueurs de surface (CD36 et CD81) permettant de les distinguer et de les isoler par cytométrie en flux. Une analyse approfondie a ensuite permis de conclure que les macrophages CD36
+
CD81
-
sont vraisemblablement dérivés de monocytes circulants, tandis que les macrophages CD36
-
CD81
+
, qui auraient une origine embryonnaire, sont capables de proliférer. Enfin, les macrophages CD36
+
CD81
+
semblent appartenir à la catégorie des macrophages résidents ayant une origine monocytaire.
Chez la souris, le recrutement de monocytes dans les tissus est déclenché soit par des signaux inflammatoires, soit par des produits de la flore microbienne [
2
]. Les échantillons d’amygdale que nous avons analysés ne présentaient pas de signes cliniques d’inflammation. Néanmoins, l’amygdale étant constamment exposée à des microbes ou à des particules inhalées, nous avons formulé l’hypothèse que la présence de macrophages dérivés de monocytes dans cet organe pourrait être due à l’existence d’une faible inflammation basale. Pour tester cette hypothèse, nous souhaitions comparer des amygdales normales avec des amygdales sans aucune réaction immunitaire ou inflammatoire, ce qui n’était pas possible chez l’homme. Nous avons donc comparé les transcriptomes de cellules immunitaires d’amygdales d’un singe macaque infecté par le virus de la grippe depuis cinq jours, d’un macaque infecté par ce virus depuis 14 jours, et d’un macaque non infecté. Nous avons ainsi pu observer trois populations de macrophages similaires à celles que nous avions détectées dans l’amygdale humaine, ainsi qu’une population de monocytes. Cependant, les monocytes et les macrophages dérivés de monocytes étaient absents de l’amygdale du macaque non infecté, ce qui suggère que le recrutement de monocytes dans l’amygdale n’est pas constitutif, mais qu’il est associé à l’existence d’une réponse immunitaire.
|
Les populations de macrophages de l’amygdale ont des fonctions distinctes
La comparaison des transcriptomes des trois populations de macrophages de l’amygdale, qui montrait un enrichissement en ARN messagers codant des cytokines dans les macrophages CD36
+
CD81
-
, et une plus forte expression de gènes potentiellement impliqués dans l’homéostasie tissulaire et la capture de cellules mortes dans les deux autres catégories de macrophages, suggérait que ces populations avaient des fonctions différentes. Nous avions précédemment montré que les macrophages de l’amygdale humaine étaient capables de stimuler les lymphocytes T auxiliaires folliculaires, qui contribuent à la différenciation des lymphocytes B en cellules productrices d’anticorps [
4
]. En mettant en présence des macrophages issus de chacune des trois populations, des lymphocytes T auxiliaires folliculaires de la même amygdale, nous avons découvert que seuls les macrophages CD36
+
CD81
-
étaient capables de stimuler la production de molécules effectrices par les lymphocytes T auxiliaires folliculaires. De plus, seuls ces macrophages sécrètent la cytokine activine A, qui joue un rôle crucial dans le dialogue avec les lymphocytes T auxiliaires folliculaires [
5
].
Cependant, ces résultats d’expériences
ex vivo
seraient sans pertinence physiologique si ces deux populations de cellules ne se rapprochaient pas
in situ
. Nous avons donc analysé la localisation des différentes populations de macrophages dans l’amygdale grâce à deux techniques d’imagerie complémentaires. L’architecture de l’amygdale comporte principalement des zones riches en lymphocytes T et des follicules riches en lymphocytes B, ces derniers comprenant une zone d’interaction avec les lymphocytes T auxiliaires folliculaires («
light zone
») et une zone où ont lieu les mutations somatiques conduisant à la production des anticorps («
dark zone
»). Nous avons localisé les macrophages CD36
+
CD81
-
principalement dans la
light zone
et dans la zone riche en lymphocytes T, tandis que les macrophages CD36
-
CD81
+
sont situés dans la zone riche en lymphocytes T. Enfin, les macrophages CD36
+
CD81
+
sont présents essentiellement dans la
dark zone
.
Ces résultats indiquent que les macrophages CD36
+
CD81
-
sont spécialisés pour la stimulation des réponses humorales, tandis que les macrophages CD36
+
CD81
+
pourraient être spécialisés dans l’élimination des lymphocytes B devenus apoptotiques au cours du processus d’hypermutation. Enfin, les macrophages CD36
-
CD81
+
semblent être l’équivalent des macrophages résidents de la zone riche en lymphocytes T, lesquels, chez la souris, ont pour fonction d’éliminer les lymphocytes T apoptotiques [
6
].
|
La spécialisation fonctionnelle des macrophages de courte durée de vie est due à la conjonction de facteurs intrinsèques et de signaux solubles
Nous avons cherché à comprendre les mécanismes moléculaires de la spécialisation des macrophages CD36
+
CD81
-
, en étudiant plus particulièrement leur capacité à sécréter l’activine A. Par une analyse bio-informatique des profils transcriptomiques des populations de macrophages et des cellules stromales de l’amygdale, nous avons identifié un mécanisme potentiel : la production de TNF-a (
tumor necrosis factor alpha
) par les cellules stromales. Des expériences
in vitro
utilisant des macrophages produits en culture à partir de monocytes (et ainsi, vierges de toute stimulation immunitaire antérieure) nous ont permis de confirmer le rôle du TNF-a. Cependant, l’exposition des macrophages CD36
-
CD81
+
et CD36
+
CD81
-
au TNF-a
ex vivo
ne suffisait pas à déclencher leur sécrétion d’activine A, et nous avons alors formulé l’hypothèse que des facteurs de transcription pourraient être impliqués dans cette sécrétion. En analysant les réseaux transcriptionnels dans les trois populations de macrophages de l’amygdale, nous avons identifié le facteur de transcription IRF1 (
interferon regulatory factor 1
) comme un candidat potentiel. Nous avons alors réprimé expérimentalement son expression dans des macrophages produits en culture à partir de monocytes, en y introduisant des petits ARN en épingle à cheveux (ou shRNA pour
small hairpin RNA
,), qui permettent l’extinction du gène cible : la franche diminution de la sécrétion d’activine A par les macrophages n’exprimant plus IRF1 a confirmé le rôle essentiel de ce facteur de transcription dans la sécrétion de cette cytokine.
Cette étude a donc permis de caractériser les populations de macrophages de l’amygdale humaine, et de mettre en évidence une spécialisation fonctionnelle corrélée à leur localisation. En outre, elle a permis de mieux comprendre les propriétés fonctionnelles des macrophages de courte durée de vie dans les tissus. Nous proposons le scénario suivant : les monocytes seraient recrutés dans les organes lymphoïdes « à la demande », lors d’une réaction immunitaire, afin de fournir une population de macrophages spécialisée dans le soutien de lymphocytes T folliculaires auxiliaires et des réponses humorales, tandis que les autres populations de macrophages seraient des populations « résidentes » impliquées dans le maintien de l’homéostasie tissulaire, en particulier dans l’élimination des cellules apoptotiques (
Figure 1
). Ainsi, les macrophages de l’amygdale jouent-ils des rôles différents et complémentaires, permettant le développement optimal de la réponse immunitaire humorale.
 | Figure 1.
Spécialisation fonctionnelle des populations de macrophages dans l’amygdale palatine.
Trois populations de macrophages existent dans l’amygdale humaine. Les macrophages CD36
+
CD81
-
sont vraisemblablement dérivés des monocytes circulant dans le sang. Ces macrophages sont spécialisés dans le dialogue avec les lymphocytes T auxiliaires folliculaires dans la «
light zone
» du follicule B. Ce dialogue implique en particulier la sécrétion de la cytokine activine A, grâce à l’action concertée du TNF-α produit par les cellules stromales et du facteur de transcription IRF1. Les macrophages CD36
-
CD81
+
sont situés dans les zones de l’amygdale riches en lymphocytes T, où ils pourraient permettre d’éliminer les lymphocytes T apoptotiques. Les macrophages CD36
+
CD81
+
sont présents dans la «
dark zone
» des follicules B, où ils permettraient l’élimination des lymphocytes B apoptotiques. Ainsi ces trois populations de macrophages possèdent-elles des fonctions différentes et complémentaires (figure créé avec Biorender.com).
|
|
L’auteure déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Blériot
C
,
Chakarov
S
,
Ginhoux
F
.
Determinants of resident tissue macrophage identity and function.
.
Immunity.
2020;
;
52
:
:957.
–
70
.
2.
Guilliams
M
,
Thierry
GR
,
Bonnardel
J
,
et al
.
Establishment and maintenance of the macrophage niche.
.
Immunity.
2020;
;
52
:
:434.
–
51
.
3.
Alaoui
L
,
Villar
J
,
Leclere
R
,
et al
.
Functional specialization of short-lived and long-lived macrophage subsets in human tonsils.
.
J Exp Med.
2023;
;
220
:
:e20230002.
.
4.
Durand
M
,
Walter
T
,
Pirnay
T
,
et al.
Human lymphoid organ cDC2 and macrophages play complementary roles in T follicular helper responses.
.
J Exp Med.
2019;
;
216
:
:1561.
–
1581
.
5.
Locci
M
,
Wu
JE
,
Arumemi
F
,
et al
.
Activin A programs the differentiation of human TFH cells.
.
Nat Immunol.
2016;
17
:
:8.
2016;
17 : 976–84.
.
6.
Baratin
M
,
Simon
L
,
Jorquera
A
,
et al.
T cell zone resident macrophages silently dispose of apoptotic cells in the lymph node.
.
Immunity.
2017;
;
47
:
:349.
–
62 e5
.
|