| |
| Med Sci (Paris). 39(10): 700–702. doi: 10.1051/medsci/2023114.La grande traversée de l’ocytocine pour calmer la douleur Étienne Clauss-Creusot,1 Pascal Darbon,1 and Alexandre Charlet1* 1CNRS, université de Strasbourg, Institut des neurosciences cellulaires et intégratives (INCI), UPR3212
,
Strasbourg
,
France MeSH keywords: Humains, Ocytocine, Gestion de la douleur, Douleur, usage thérapeutique, traitement médicamenteux |
L’ocytocine contrôle la douleur
L’ocytocine, un neuropeptide constitué de neuf acides aminés, est connue comme « l’hormone de l’amour ». Elle est plus généralement impliquée dans la promotion du bien-être en contrôlant, par exemple, les interactions sociales, le niveau d’anxiété ou la douleur [
1
]. L’ocytocine est synthétisée dans l’hypothalamus, une région du cerveau qui fait le lien entre le système nerveux et le système endocrinien [
1
], par au moins deux types de neurones ocytocinergiques : les neurones magnocellulaires, qui peuvent secréter l’ocytocine dans le sang, où elle agit comme une hormone, et les neurones parvocellulaires, qui la libèrent uniquement dans le système nerveux central, où elle agit alors comme un neuromodulateur. Ces deux types de neurones participent à l’action analgésique de l’ocytocine, par une combinaison d’actions « périphérique » et « centrale ». En effet, les neurones parvocellulaires vont, d’une part, stimuler la sécrétion d’ocytocine dans le sang par les neurones magnocellulaires, et, d’autre part, libérer de l’ocytocine directement dans la moelle épinière. Ainsi, l’action analgésique de l’ocytocine s’exerce à la fois sur l’activité des nocicepteurs périphériques situés dans les ganglions rachidiens et dans la peau, qu’elle atteint par voie sanguine [
2
], et directement sur les neurones de la moelle épinière [
3
].
|
La substance grise péri-aqueducale est impliquée dans le contrôle de la douleur
La douleur est une expérience sensorielle et émotionnelle complexe. Elle émane de l’intégration d’informations nociceptives par la moelle épinière et les centres supra-spinaux. En réponse, un système de contrôle descendant permet de moduler (atténuer ou exacerber) la douleur perçue en agissant sur la moelle épinière [
4
]. Ces contrôles sont exercés par un ensemble de structures cérébrales, notamment la substance grise péri-aqueducale ventrolatérale (vlPAG), située autour de l’aqueduc du mésencéphale et qui joue également un rôle clef dans la modulation des comportements défensifs [
5
]. L’activation de la vlPAG active des neurones dont les axones se projettent dans la région rostro-ventrale du myélencéphale, laquelle, par l’intermédiaire d’interneurones de la moelle épinière, exerce une action inhibitrice sur les neurones «
wide dynamic range »
1,
(WDR) de la couche V, qui sont impliqués dans le contrôle de la transmission de l’information nociceptive [
5
].
|
vlPAG et ocytocine : une nouvelle histoire d’amour ?
En combinant l’utilisation de vecteurs viraux et d’une lignée transgénique de rats, nous avons mis en évidence la présence de fibres ocytocinergiques et de récepteurs de l’ocytocine dans la vlPAG [
6
]. Les neurones synthétisant l’ocytocine qui projettent leurs axones vers la vlPAG constituent une population spécifique de neurones parvocellulaires peuplant le noyau paraventriculaire de l’hypothalamus. Les axones de ces neurones sont présents tout le long de l’axe rostro-ventral de la vlPAG et au contact des neurones exprimant le récepteur de l’ocytocine (
Figure 1
) [
6
].
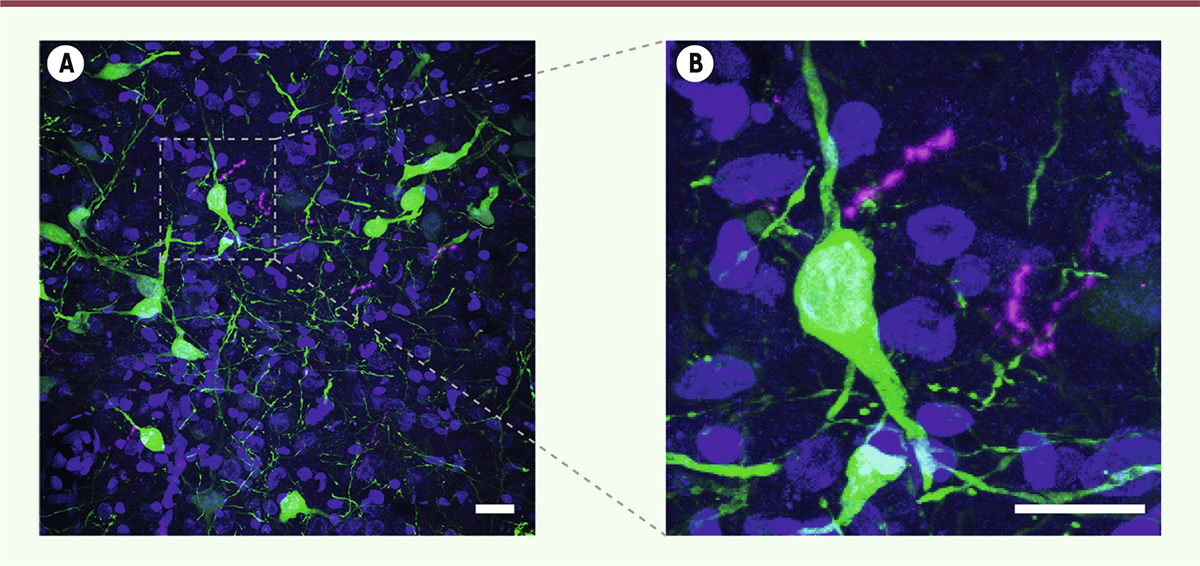
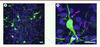 | Figure 1.
Dans la substance grise péri-aqueducale, les fibres ocytocinergiques provenant des neurones parvocellulaires de l’hypothalamus (en violet) sont situées à proximité des neurones exprimant le récepteur de l’ocytocine (en vert).
L’activation de ces neurones par l’ocytocine atténue la douleur chez le rat. Les noyaux des cellules sont colorés en bleu. Barre d’échelle: 20µm (© Charlet lab).
|
De plus, des expériences d’électrophysiologie
ex vivo
ont permis de vérifier que les récepteurs de l’ocytocine des neurones de la vlPAG sont fonctionnels : l’application d’agonistes du récepteur sur ces neurones augmente la fréquence de leurs potentiels d’action. Afin de mimer la libération physiologique d’ocytocine, nous avons alors dépolarisé spécifiquement les axones des neurones parvocytocine présents dans la vlPAG par une technique d’optogénétique (voir
Encadré 1
). Nous nous sommes assurés de la libération effective d’ocytocine par cette technique en utilisant conjointement un nouveau senseur de cette molécule, le GRAB
ocytocine
(voir
Encadré 2
) [
6
]. L’enregistrement
in vivo
de l’activité électrique des neurones de la vlPAG a montré que la stimulation des fibres ocytocinergiques entraîne l’activation d’environ un quart d’entre eux, et un enregistrement complémentaire dans la moelle épinière dans les mêmes conditions de stimulation a montré une inhibition des neurones « w
ide dynamic range
» [
6
]. Il existe donc un circuit ocytocinergique à partir du noyau paraventriculaire de l’hypothalamus, qui permet de réduire l’activité de certains neurones de la moelle épinière par une action intermédiaire sur des neurones de la vlPAG.
|
1 L’optogénétique
L’optogénétique désigne une technique de stimulation (ou d’inhibition) de l’activité neuronale fondée sur l’expression artificielle d’un canal ionique «photoactivable», c’est-à-dire activable par une stimulation lumineuse. L’injection d’un vecteur viral permet, dans une population choisie de neurones, l’expression de ce canal ionique. Une stimulation lumineuse permet l’ouverture du canal, ce qui entraîne un flux entrant d’ions (ici, de cations) dans le neurone, et modifie donc son activité électrique (ici, dans le sens d’une augmentation, par dépolarisation) [
7
].
|
Il restait à comprendre l’implication de ce circuit dans le contrôle effectif de la douleur. Deux modèles murins (rat) ont été utilisés : l’un de sensibilisation inflammatoire périphérique, l’autre de douleur neuropathique. Les sensibilités douloureuses de modalités mécanique (pression) et thermique (chaleur) ont été évaluées chez ces animaux avant et après stimulation de la libération d’ocytocine dans la vlPAG par optogénétique. Nous avons ainsi pu montrer que l’activation des neurones ocytocinergiques de l’hypothalamus dont les axones se projettent dans la vlPAG entraîne une analgésie transitoire chez les rattes femelles et chez les rats mâles [
6
].
|
Un nouveau circuit neuronal est donc impliqué dans le fort pouvoir analgésique de l’ocytocine. Une population spécifique de neurones parvocellulaires dans le noyau paraventriculaire de l’hypothalamus projette ses axones vers la vlPAG, où ils libèrent de l’ocytocine. L’activation de certains neurones de la vlPAG par l’ocytocine diminue à son tour l’activité des neurones de la moelle épinière codant l’intensité nociceptive (
Figure 2
).
In fine
, l’activation des neurones parvocellulaires produisant l’ocytocine induira une analgésie, comme nous l’avons montré en analysant la réponse de rattes femelles et de rats mâles souffrant de douleurs inflammatoires ou de neuropathie à des stimulus douloureux.
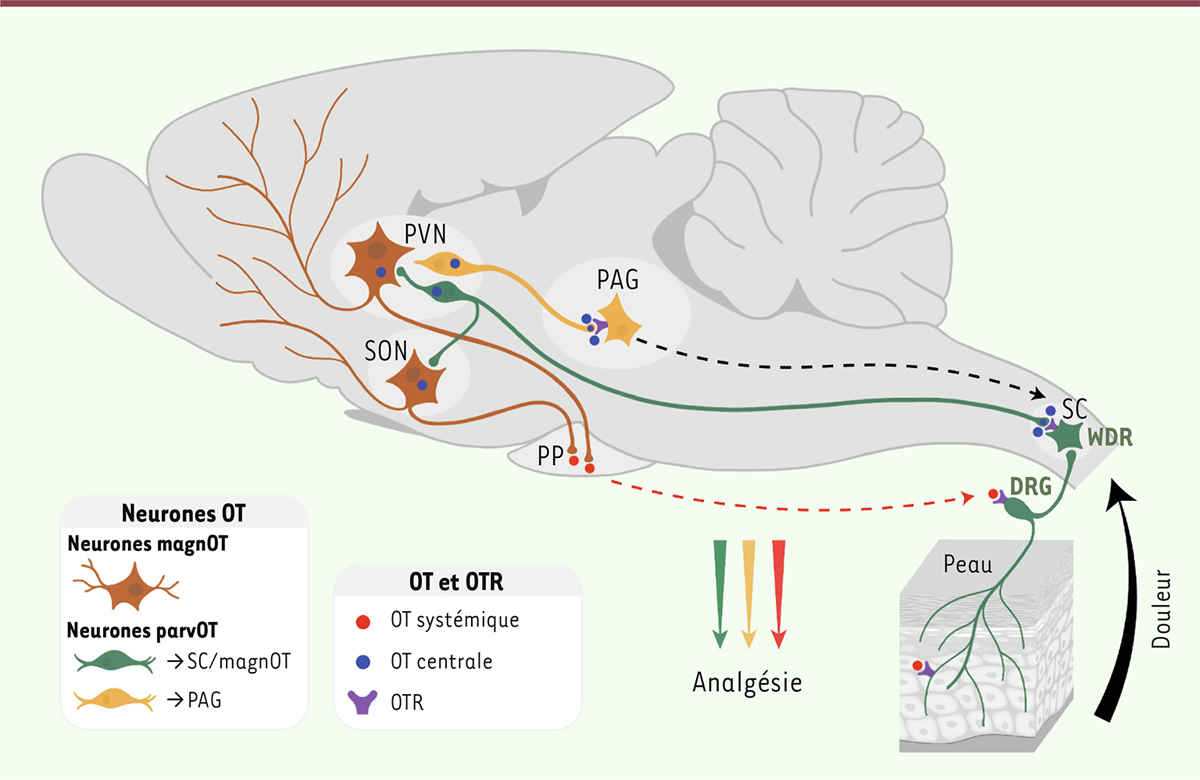
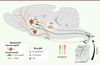 | Figure 2.
Deux populations distinctes de neurones parvocellulaires promeuvent une analgésie par la libération d’ocytocine dans le sang, la moelle épinière et la substance grise périaqueducale ventrolatérale.
Nous faisons l’hypothèse que les stimulus douloureux activent deux populations de neurones parvocellulaires (parvOT) distinctes du noyau paraventriculaire de l’hypothalamus (PVN). Il en résulte une libération d’ocytocine (OT) dans diverses régions du système nerveux central d’une part, et dans la circulation sanguine (par activation des neurones magnocellulaires, magnOT) d’autre part, ce qui a pour effet d’atténuer la nociception. DRG: ganglions rachidiens; PAG: substance grise périaqueducale; OTR: récepteur de l’ocytocine; PP: neurohypophyse; SC: moelle épinière; SON: noyau supraoptique de l’hypothalamus; WDR: neurones «wide dynamic range».
|
|
2 Un senseur d’ocytocine : GRAB
ocytocine
GRAB
ocytocine
est un récepteur de l’ocytocine modifié (
G-protein-coupled receptor activation-based, GRAB
), couplé à une protéine fluorescente (
green fluorescent protein
, GFP). Lorsqu’une molécule d’ocytocine se lie à ce récepteur, il change de conformation, ce qui augmente l’intensité de la fluorescence de la GFP. Ce récepteur va donc agir comme un senseur d’ocytocine, ce qui permet, en induisant son expression dans certaines zones cérébrales, d’y mesurer la libération d’ocytocine [
8
].
|
Cependant, malgré l’accumulation de preuves des bénéfices de l’ocytocine sur la douleur ou ses comorbidités [
1
–
3
,
7
,
9
], son utilisation médicale se heurte à deux obstacles : sa capacité à également activer les récepteurs de la vasopressine, ce qui peut entraîner des effets indésirables cardio-vasculaires, et sa demi-vie trop brève (une quinzaine de minutes au maximum), qui se traduit par un effet de courte durée, à l’image de l’analgésie mesurée dans notre étude chez le rat.
Une stratégie pourrait être de synthétiser des agonistes du récepteur de l’ocytocine ayant une plus forte sélectivité pour ce dernier, tout en ayant une durée de vie plus longue. Récemment, un agoniste non-peptidergique de l’ocytocine, LIT-001, a été synthétisé. Il possède une sélectivité pour le récepteur de l’ocytocine un peu plus faible que l’ocytocine, mais présente l’avantage de ne (presque) pas se lier au récepteur central de la vasopressine (récepteur V1a). L’injection intra-péritonéale de LIT-001 chez le rat entraîne une analgésie d’une durée de cinq heures environ, et la molécule peut être détectée dans l’organisme jusqu’à cinq heures après l’injection [
10
]. S’il reste nécessaire de perfectionner ce nouvel outil pharmacologique, il ouvre une réelle perspective de modulation de l’activité du circuit ocytocinergique dans un but médical.
Dans un contexte où les médicaments analgésiques des paliers 2 et 3 utilisés actuellement sont essentiellement opioïdergiques, comprendre le circuit par lequel l’ocytocine diminue la sensation douloureuse et développer, à partir de cette connaissance, de nouvelles molécules efficaces, ouvre des perspectives thérapeutiques. En effet, l’activation d’un circuit physiologique du contrôle de la douleur par une molécule ayant peu d’effets indésirables est une alternative prometteuse à l’utilisation des opiacés. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Jurek
B
,
Neumann
ID
.
The oxytocin receptor: from intracellular pathway to behavior.
.
Physiol Rev.
2018;
;
98
:
:1805.
–
1908
.
2.
Moreno-López
Y
,
Martínez-Lorenzana
G
,
Condés-Lara
M
,
et al.
Identification of oxytocin receptor in the dorsal horn and nociceptive dorsal root ganglion neurons.
.
Neuropep.
2013;
;
47
:
:117.
–
123
.
3.
Eliava
M
,
Melchior
M
,
Knobloch-Bollmann
SH
,
et al.
A new population of parvocellular oxytocin neurons controlling magnocellular neuron activity and inflammatory pain processing.
.
Neuron.
2016;
;
89
:
:1291.
–
1304
.
4.
Lau
BK
,
Vaughan
CW
.
Descending modulation of pain: the GABA disinhibition hypothesis of analgesia.
.
Curr Opin Neurobiol.
2014;
;
29
:
:159.
–
164
.
5.
Martines
I
,
Tavares
I
.
Reticular formation and pain: the past and the future.
.
Front Neuroanat.
2017;
;
11
:
:51.
.
6.
Iwasaki
M
,
Lefevre
A
,
Althammer
F
,
et al
.
An analgesic pathway from parvocellular oxytocin neurons to the periaqueductal gray in rats.
.
Nat Commun.
2023;
;
14
:
:1066.
.
7.
Rost
BR
,
Schneider-Warme
F
,
Schmitz
D
,
et al.
Optogenetic tools for subcellular applications in neuroscience.
.
Neuron.
2017;
;
96
:
:572.
–
603
.
8.
Qian
T
,
Wang
H
,
Wang
P
,
et al
.
A genetically encoded sensor measures temporal oxytocin release from different neuronal comportments.
.
Nat Biotech.
2023
. doi:
10.1038/s41587-022-01561-2
.
9.
Wahis
J
,
Baudon
A
,
Althammer
F
,
et al
.
Astrocytes mediate the effect of oxytocin in the central amygdala on neuronal activity and affective states in rodents.
.
Nat Neurosci.
2021;
;
24
:
:529.
–
41
.
10.
Hilfiger
L
,
Zhao
Q
,
Kerspern
D
,
et al
.
A nonpeptide oxytocin receptor agonist for a durable relief of inflammatory pain.
.
Sci Rep.
2022;
;
10
:
:3017.
.
|