| |
| Med Sci (Paris). 39(10): 697–700. doi: 10.1051/medsci/2023113.La minipuberté Une période critique pour le développement fonctionnel cérébral Konstantina Chachlaki,1,2* Kevin Le Duc,2,3 Laurent Storme,2,3 and Vincent Prévot1,2** 1Univ. Lille, Inserm, CHU Lille, laboratoire du développement et de la plasticité du cerveau neuroendocrine, Lille Neuroscience et cognition, UMR_S1172
,
Lille
,
France 2Fédérations hospitalo-universitaires (FHU) « 1 000 Premiers jours de vie », Univ. Lille, Inserm, CHU de Lille
,
Lille
,
France 3Département de néonatalogie, hôpital Jeanne de Flandre, CHU de Lille
,
Lille
,
France MeSH keywords: Humains, Encéphale, Puberté, croissance et développement |
Les premiers mois de la vie d’un enfant tiennent une place particulière dans son développement. La croissance et la maturation fonctionnelle des différents organes pendant cette période mettent en jeu des processus dynamiques qui sont influencés par divers stimulus provenant de son environnement. Dans l’hypothalamus, une région du cerveau impliquée dans le contrôle de fonctions vitales (appétit, croissance, sommeil, reproduction, etc.), l’activation d’une petite population de neurones produisant l’hormone gonadolibérine (
gonadotropin releasing hormone
, GnRH) entraîne une première activation, transitoire, de l’axe endocrinien hypothalamo-hypophyso-gonadique (axe gonadotrope) peu après la naissance, un phénomène connu sous le nom de minipuberté [
1
].
|
La minipuberté : une période critique pour le développement de l’axe gonadotrope
La GnRH est une neurohormone peptidique sécrétée par un petit nombre de neurones (environ 2 000 dans l’espèce humaine) situés dans la région hypothalamique du cerveau [
2
]. Ces neurones projettent leurs axones vers l’éminence médiane de l’hypothalamus, où ils libèrent la GnRH dans la circulation sanguine du système porte hypothalamo-hypophysaire, qui relie l’hypothalamus neuroendocrinien à l’adénohypophyse. La GnRH transportée par le sang atteint ainsi l’hypophyse, où elle stimule des cellules gonadotropes produisant l’hormone lutéinisante (LH) et l’hormone folliculostimulante (FSH). La LH et la FSH sont ensuite libérées dans la circulation générale pour stimuler la croissance des gonades, la gamétogenèse et la production des hormones stéroïdiennes gonadiques : principalement la testostérone chez les hommes et les œstrogènes chez les femmes. Ces stéroïdes gonadiques participent à une boucle de rétroaction (positive ou négative) à différents étages de l’axe gonadotrope (
Figure 1
).
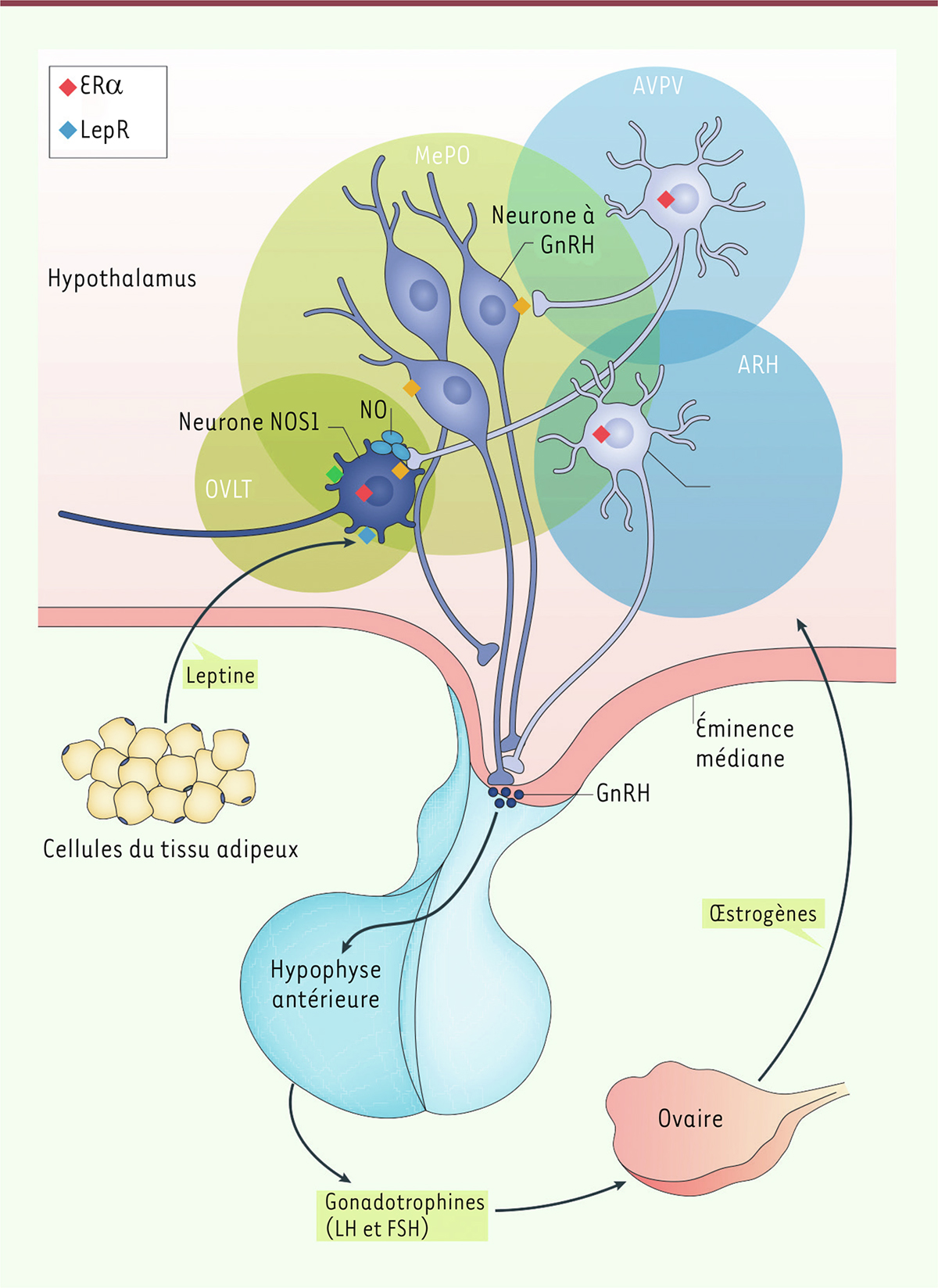
 | Figure 1.
L’axe endocrinien hypothalamo-hypophyso-gonadique.
Les corps cellulaires des neurones produisant la neurohormone GnRH sont répartis dans la région préoptique et tubérale de l’hypothalamus et envoient leurs axones dans l’éminence médiane, où la GnRH est libérée dans les vaisseaux sanguins du système porte hypothalamo-hypophysaire pour être acheminée vers l’adénohypophyse. La GnRH y stimule la sécrétion des gonadotrophines: l’hormone lutéinisante (LH) et l’hormone folliculo-stimulante (FSH). La LH et la FSH sont à leur tour libérées dans la circulation sanguine et agissent dans les gonades (ovaire ou testicule) pour stimuler la production de gamètes, ainsi que la sécrétion d’hormones stéroïdiennes (œstrogènes chez la femme, testostérone chez l’homme). Dans le cerveau, les stéroïdes gonadiques influencent la sécrétion de GnRH par le biais de boucles de rétroaction neuroendocriniennes. Ces hormones, ainsi que d’autres véhiculant des signaux métaboliques, telles que la leptine, sont perçues par un réseau de neurones transmettant l’information aux neurones produisant la GnRH (qui eux n’expriment pas les récepteurs de ces hormones). NOS1: enzyme neuronale synthétisant le monoxyde d’azote (NO); LepR: récepteur de la leptine; ERα: récepteur a des œstrogènes; OVLT: organum vasculosum laminae terminalis; MePO: noyau préoptique médian; AVPC: noyau antéro-ventral périventriculaire; ARH: noyau arqué de l’hypothalamus (figure adaptée de [
13
]).
|
Dans le sexe féminin, les taux de FSH circulante atteignent un pic entre les âges de un et trois mois après la naissance [
1
]. Ce pic postnatal de gonadotrophine active la production d’œstradiol grâce à une augmentation de l’activité de l’aromatase dans les ovaires immatures, ce qui est important pour la fonction ultérieure de reproduction [
1
] (
Figure 2
). Le déclenchement de la minipuberté semble lié au câblage des neurones produisant la GnRH, qui leur permet de recevoir l’information sur le milieu intérieur et l’environnement [
3
] (
→
).
(→) Voir la Nouvelle de A. Sharif et V. Prévot,
m/s
n° 5, mai 2022, page 428
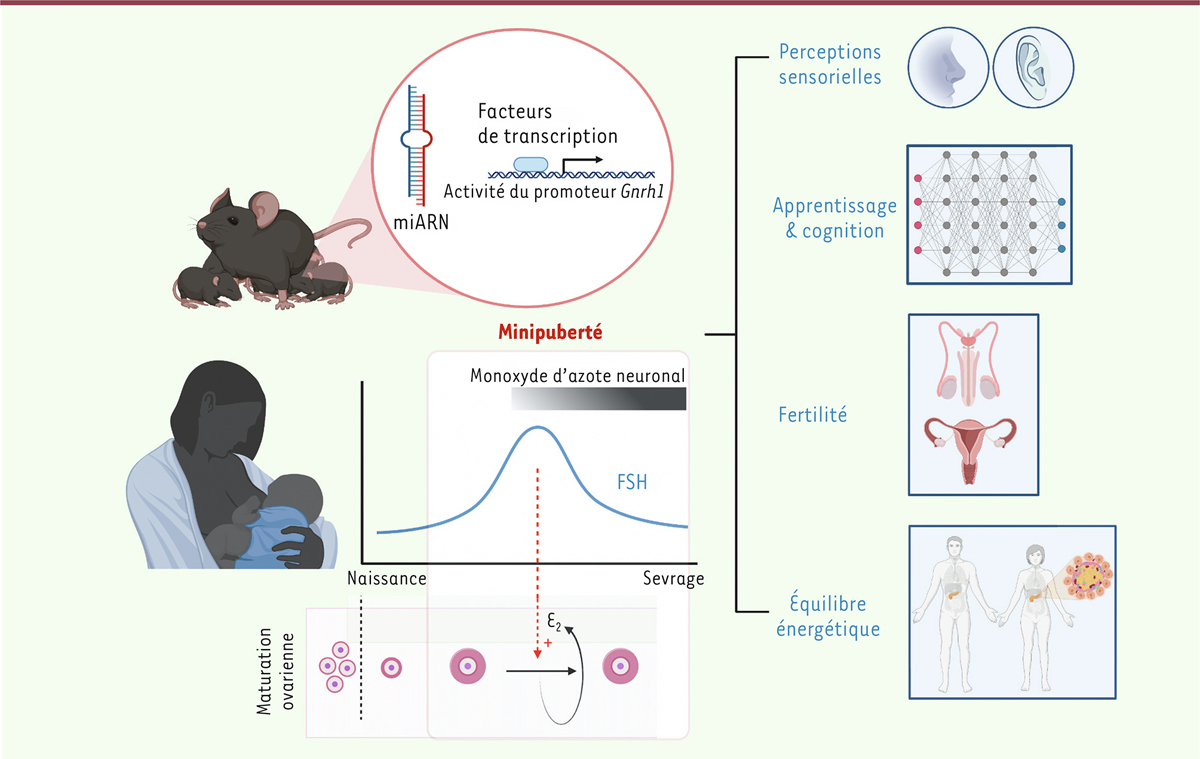
 | Figure 2.
La minipuberté est une période critique pour le développement fonctionnel du cerveau et de l’organisme.
Pendant la minipuberté, une période critique du développement infantile qui ne dure que quelques jours chez les rongeurs et quelques mois chez l’humain, un changement majeur dans le contrôle de la sécrétion de la GnRH permet une production soutenue de cette neurohormone et la mise en place de la fonction de reproduction. La minipuberté se traduit par l’activation des neurones synthétisant la GnRH et l’induction d’un pic de gonadotrophines qui déclenche une stéroïdogenèse dans les gonades infantiles. Il en résulte une augmentation des stéroïdes gonadiques circulants, qui activent les neurones cérébraux exprimant leurs récepteurs et, en particulier, les neurones hypothalamiques produisant le monoxyde d’azote (NO), qui contrôlent à la fois l’amplitude et l’achèvement de la minipuberté. L’échec de l’activation infantile des neurones synthétisant le NO entraîne une altération de la minipuberté et des comorbidités reproductives, métaboliques, sensorielles et cognitives plus tard dans la vie. Celles-ci peuvent être prévenues par une exposition infantile au NO inhalé (figure créée avec BioRender.com).
|
Quant au contrôle de l’amplitude et de la fin de la minipuberté, il semble impliquer l’activation d’une population de neurones sécrétant du monoxyde d’azote (NO) par une boucle de rétroaction des œstrogènes sur l’hypothalamus [
4
]. La suppression expérimentale de la production de NO par ces neurones entraîne une minipuberté exacerbée. Celle-ci se produit naturellement chez les filles nées prématurément [
1
], chez lesquelles elle augmente le risque de retard pubertaire et de dysfonctionnement du cycle œstral à l’âge adulte [
4
]. Nous avons montré, dans un modèle murin, que la supplémentation en NO, par inhalation, pendant la période infantile (avant le sevrage) corrige les taux anormalement élevés de FSH pendant la minipuberté et prévient leurs conséquences néfastes [
4
].
Chez les garçons, les taux de gonadotrophines dans le sang atteignent également leur maximum entre un et trois mois d’âge, mais contrairement aux filles, les taux de LH prédominent sur ceux de la FSH [
1
]. Dans le sexe masculin, l’amplitude et la durée de la minipuberté semblent également contrôlées par l’activation des neurones hypothalamiques exprimant l’enzyme de synthèse du NO (
nitric oxide synthase 1
, NOS1) par les hormones stéroïdiennes sexuelles [
4
,
5
]. Chez les garçons aussi, les œstrogènes, et non la testostérone, sont responsables de cette activation.
Lors de la minipuberté, un changement se produit dans le contrôle de l’expression du gène codant la GnRH (
Gnrh1
) dans les neurones hypothalamiques qui la synthétisent. Ce changement implique des microARN (miARN) qui modulent l’expression des facteurs de transcription, agissant en tant que répresseurs du gène
Gnrh1
, et notamment CEBPB (
CCAAT/enhancer-binding protein beta
) dont l’activité est contrôlée par le NO [
6
] (
→
).
(→) (→) Voir la Synthèse de A. Messina
et al
.,
m/s
n° 5, mai 2017, page 506
Une altération de l’activation de ces microARN et de ces facteurs de transcription impliqués dans le contrôle de l’expression de
Gnrh1
pendant la minipuberté, peut conduire à une extinction progressive de l’expression de ce gène et à une altération de la sécrétion pulsatile de GnRH, ce qui peut entraîner des comorbidités en dehors du système reproducteur [
7
] (
→
).
→ Voir la Nouvelle de V. Prévot et N. Pitteloud,
m/s
n° 4, avril 2023, page 316
|
La minipuberté : une période critique pour le développement fonctionnel cérébral
La minipuberté semble également impliquée dans la maturation des fonctions sensorielles et cognitives, et leur maintien tout au long de la vie. Les résultats de recherches récentes suggèrent que la minipuberté peut affecter le développement fonctionnel du cerveau, notamment celui des fonctions sensorielles, telles que l’olfaction et l’audition, ainsi que celui des fonctions cognitives. La perte d’expression du gène
Nos1
chez des souris mutantes, ou la présence de mutations délétères dans ce gène chez des patients présentant un hypogonadisme hypogonadotrope congénital, entraîne des comorbidités olfactives, auditives et cognitives [
4
]. Cependant, chez les animaux déficients en NOS1, la compensation de l’insuffisance de NO pendant la période infantile, par inhalation de ce gaz, permet de restaurer une maturation sexuelle normale ainsi que les fonctions olfactives et cognitives à l’âge adulte [
4
]. Ces découvertes soulignent le rôle critique de l’activité de NOS1 pendant la période infantile pour le développement de l’organisme, incluant celui du cerveau.
|
Un effet bénéfique de la normalisation de la minipuberté chez les enfants prématurés ?
Environ un enfant sur dix naît prématurément, c’est-à-dire avant la fin de la 37
e
semaines de gestation. Chez ces nourrissons, la minipuberté est caractérisée par des taux de FSH circulante anormalement élevés [
1
]. Selon l’Organisation mondiale de la santé (OMS), ces enfants sont prédisposés à certaines maladies mentales (troubles du comportement et de l’apprentissage, autisme), ainsi qu’à certains troubles métaboliques (diabète, obésité), de la fertilité, ou cardiovasculaires [
8
–
10
]. Compte tenu de l’importance de la minipuberté pour le développement du système nerveux central chez la souris [
4
,
7
] et de l’effet bénéfique de sa normalisation par un traitement par inhalation de NO [
4
], un traitement a déjà été appliqué aux enfants nés prématurément pour favoriser la maturation et la vascularisation pulmonaire [
11
,
12
]. La prolongation de ce traitement chez ces enfants pendant la période minipubertaire pourrait avoir un effet bénéfique sur leur développement cérébral. Cette hypothèse est actuellement testée dans un essai clinique conduit conjointement au CHU de Lille et à l’hôpital pédiatrique d’Athènes (Grèce) dans le cadre du projet européen miniNO (
https://minino-project.com
). La découverte inattendue de l’implication de la minipuberté dans l’établissement des fonctions sensorielles et cognitives dans des modèles animaux, et le test actuel de sa pertinence pour la santé humaine, sont porteurs d’espoir pour améliorer la prise en charge des naissances prématurées et de certains troubles neurodéveloppementaux.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Kuiri-Hanninen
T
,
Sankilampi
U
,
Dunkel
L
.
Activation of the hypothalamic-pituitary-gonadal axis in infancy: minipuberty.
.
Horm Res Paediatr.
2014;
;
82
:
:73.
–
80
.
2.
Casoni
F
,
Malone
SA
,
Belle
M
,
et al.
Development of the neurons controlling fertility in humans: new insights from 3D imaging and transparent fetal brains.
.
Development.
2016;
;
143
:
:3969.
–
3981
.
3.
Sharif
A
,
Prevot
V
.
Les neurones produisant la gonadolibérine sculptent leur environnement neuroglial dans la petite enfance.
.
Med Sci (Paris).
2022;
;
38
:
:428.
–
30
.
4.
Chachlaki
K
,
Mesina
A
,
Delli
V
,
et al
.
NOS1 mutations cause hypogonadotropic hypogonadism with sensory and cognitive deficits that can be reversed in infantile mice.
.
Sci Transl Med.
2022;
;
14
:
:eabh2369.
.
5.
Delli
V
,
Dehame
J
,
Franssen
D
,
et al
.
Male minipuberty involves the gonad-independent activation of preoptic nNOS neurons.
.
Free Radic Biol Med.
2023;
;
194
:
:199.
–
208
.
6.
Messina
A
,
Langlet
F
,
Prevot
V
.
Les micro-ARN : nouveaux acteurs du contrôle hypothalamique de la fertilité.
.
Med Sci (Paris).
2017;
;
33
:
:506.
–
511
.
7.
Prévot
V
,
Pitteloud
N
.
Trisomie 21, GnRH et cognition.
.
Med Sci (Paris).
2023;
;
39
:
:316.
–
18
.
8.
D’Onofrio
BM
,
Class
QA
,
Rickert
ME
,
et al.
Preterm birth and mortality and morbidity: a population-based quasi-experimental study.
.
JAMA Psychiatry.
2013;
;
70
:
:1231.
–
1240
.
9.
Luu
TM
,
Katz
SL
,
Leeson
P
,
et al.
Preterm birth: risk factor for early-onset chronic diseases.
.
CMAJ.
2016;
;
188
:
:736.
–
746
.
10.
Moster
D
,
Lie
RT
,
Markestad
T
.
Long-term medical and social consequences of preterm birth.
.
N Engl J Med.
2008;
;
359
:
:262.
–
273
.
11.
Porta
NF
,
Steinhorn
RH
.
Pulmonary vasodilator therapy in the NICU: inhaled nitric oxide, sildenafil, and other pulmonary vasodilating agents.
.
Clin Perinatol.
2012;
;
39
:
:149.
–
164
.
12.
Soll
RF
.
Inhaled nitric oxide for respiratory failure in preterm infants.
.
Neonatology.
2012;
;
102
:
:251.
–
253
.
13.
Chachlaki
K
,
Garthwaite
J
,
Prevot
V
.
The gentle art of saying NO: how nitric oxide gets things done in the hypothalamus.
.
Nat Rev Endocrinol.
2017;
;
13
:
:521.
–
535
.
|