| |
| Med Sci (Paris). 39(8-9): 650–657. doi: 10.1051/medsci/2023092.Vers un consentement plus éclairé Rendre l’information accessible Diane Gozlan, Marion Mathieu,* Sandrine de Montgolfier,* Lucie Morillon,* Béatrice Demaret, Carole Pierrart, Chantal Aubert Fourmy, Dominique Lamarche, Frédérique Koulikoff, Frédérique Nowak, Jean-Michel Zucker, Jean-Pierre Malen, Flore Avram, Maï Panchal, Marie Lanta, Marie-France Prouvost, Myriam Maizeroi, Vincent Tronel, and Flavie Mathieu** Collège des relecteurs de l’Inserm, groupe de travail « Notices d’information », Inserm, Service sciences et société - Département information scientifique et communication
,
Paris
,
France |
Vignette (© Fanny Velardo).
Les quatre principes fondamentaux de la bioéthique sont l’autonomie, la bienfaisance, la non-malfaisance et la justice distributive [
1
]. Dans sa pratique, le principe d’autonomie implique que le consentement de la personne à un acte de soin ou à sa participation à une recherche soit donné de manière libre et éclairée. L’information délivrée à ces personnes nécessite donc d’être intelligible et adaptée au niveau de compréhension de chacune d’entre-elles.
|
Autonomie de la personne et complexité de compréhension Dans le cadre du soin comme dans celui de la recherche, l’utilisation de techniques toujours plus complexes rend l’information de plus en plus difficile à expliquer par les professionnels et à comprendre pour ses destinataires. Citons ainsi la technique de séquençage de l’ADN à très haut débit qui est désormais utilisée pour réaliser les examens génétiques. Dans l’objectif d’obtenir un consentement plus éclairé des personnes, il est donc important de modifier les pratiques en rendant accessible l’information délivrée aux participants à un projet de recherche et aux personnes à qui l’on propose des examens complexes, tels que ces examens génétiques.
En 2016, la France s’est dotée d’un plan national de mise en œuvre de la médecine génomique (Plan France Médecine Génomique 2025, PFMG2025) [
2
]. À ce jour, environ 21 000 prescriptions ont été effectuées dans le cadre du PFMG2025 et environ 11 500 comptes-rendus ont été remis. Ce plan tend à impliquer activement les patients dans leur parcours de soin et à développer leur capacité à choisir de réaliser ou non un examen génétique. Néanmoins, l’information délivrée lors de la proposition d’examens génétiques soulève de nombreuses questions éthiques, pour le présent et l’avenir de la personne à qui cette information est proposée ainsi que pour les membres de sa famille [
4
,
5
]. La délivrance de cette information par des professionnels de santé qui ne sont parfois pas généticiens, ou n’ont pas la disponibilité suffisante, peut conduire à une mauvaise compréhension ou interprétation des enjeux de ces examens par la personne concernée.
En 2009, le nouveau métier de conseiller en génétique a été créé [
6
] pour permettre de renforcer les équipes de généticiens. La dernière révision de la loi de bioéthique de 2021 [
7
] a étendu les missions de ces conseillers, avec l’impératif éthique du respect de l’autonomie de la personne dans le champ de la génétique [
8
], à la fois pour le soin et pour la recherche.
Pour les patients adultes, il est nécessaire qu’ils aient accès à des informations complètes, et lexicalement intelligibles et accessibles. Pour toutes les personnes, y compris les enfants ou les personnes sous tutelle, le cadre juridique français impose qu’une information adaptée à leur niveau de compréhension leur soit donnée, qu’il existe ou non une délégation du consentement au représentant légal [
8
–
10
]. Dans le contexte actuel du droit de la santé, on observe une tendance à donner une certaine autonomie aux mineurs et aux personnes sous tutelle. Ils peuvent ainsi participer au consentement si, en tant que patient, «
il est apte à exprimer sa volonté et à participer à la décision
» [
11
]. Dans le cadre de la recherche clinique, les recommandations européennes et la législation française prévoient pour les mineurs, que «
leur adhésion personnelle en vue de leur participation à la recherche impliquant la personne humaine est recherchée. En toute hypothèse, il ne peut être passé outre à leur refus ou à la révocation de leur acceptation
» [
12
].
|
De l’engagement des associations dans la relecture des notices d’information à la création de notices adaptées Les notices d’information sont des écrits remis aux personnes concernées en complément de l’information orale qui leur est délivrée par le professionnel. Aucun consensus sur la terminologie employée ou la structuration de la notice n’a été établi. Aussi, écrire ces notices tout en intégrant les dernières évolutions de la réglementation reste un véritable défi. Les contraintes dues aux processus législatifs sont telles que, trop souvent, ces notices sont peu compréhensibles, davantage comparables à des documents réglementaires qu’à des notices à visée explicative.
Dès le début des années 1990, des associations de malades se sont mobilisées afin de rendre ces notices plus intelligibles. Elles ont ainsi mis en place des comités de relecture dont l’objectif était non seulement d’assurer la lisibilité des documents remis aux personnes concernées, mais aussi d’alerter les professionnels sur l’acceptabilité des examens, voire de proposer des améliorations de la prise en charge des personnes participant à des projets de recherche [
13
](
→
).
(→)Voir le Repères de F. Mathieu
et al.
, m/s n° 6-7, juin-juillet 2023, page 558
Conscient de l’importance de ces relectures, l’Inserm a mis en place en 2007 le Collège des relecteurs
1
, seul comité institutionnel. Les retours des relecteurs et les conclusions des évaluateurs des organismes réglementaires dans le cadre de la recherche ont pointé la nécessité de créer des outils pour faciliter l’élaboration de notices conformes sur le plan réglementaire et compréhensibles. Cette demande a été réitérée par le Groupe de réflexion avec les associations de malades (le Gram) rattaché à la présidence de l’Inserm et par le comité de pilotage du PFMG2025. De nombreux cliniciens et chercheurs ont par ailleurs demandé un accès à des notices simplifiées afin de les utiliser comme supports lors de la délivrance de l’information orale, notamment dans le cadre des examens génétiques.
C’est pour répondre à ce besoin que le groupe de travail « Notices d’information » a été créé en 2020 sous l’impulsion du Collège des relecteurs de l’Inserm avec, comme méthode de travail, une démarche participative pour créer des notices répondant à cette demande. Deux objectifs ont été visés : 1) créer un groupe de travail associant tous les acteurs impliqués dans l’élaboration, l’évaluation et l’utilisation des notices d’information ; et 2) constituer des corpus de textes, des pictogrammes et des illustrations adaptés aux personnes concernées (majeures comme mineures) faisant consensus et validés par les instances réglementaires, tout en étant faciles à utiliser par les professionnels. Création et fonctionnement du groupe de travail
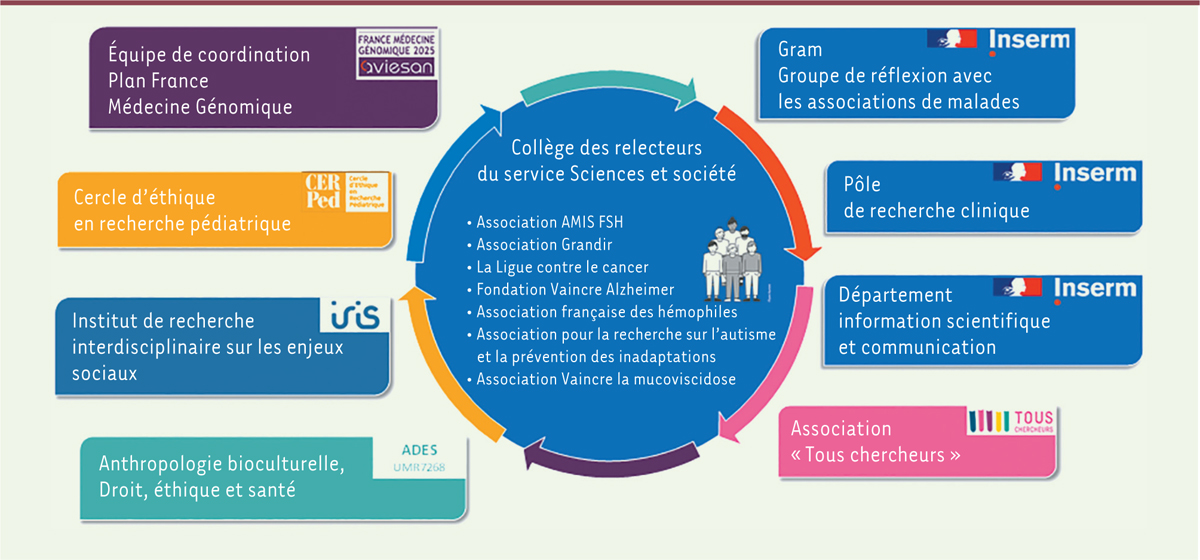
Afin d’associer tous les acteurs concernés par l’élaboration et l’utilisation des notices d’information, différentes personnes ont été sollicitées sur la base du volontariat pour leur expertise. Le groupe de travail, constitué en septembre 2020, compte une vingtaine de personnes (
Tableau I
) : des professionnels de santé et de la recherche (en santé publique, génétique, éthique et sociologie de la santé), des représentants d’associations de patients et de fondations de recherche, des juristes, des médiateurs scientifiques, des communicants et des graphistes. Le groupe, piloté par la responsable du Collège des relecteurs de l’Inserm, se réunit mensuellement depuis sa création. Les organismes et services impliqués dans le groupe de travail sont présentés dans la
Figure 1
.
 | Figure 1. Le groupe de travail « Notices d’information ». |
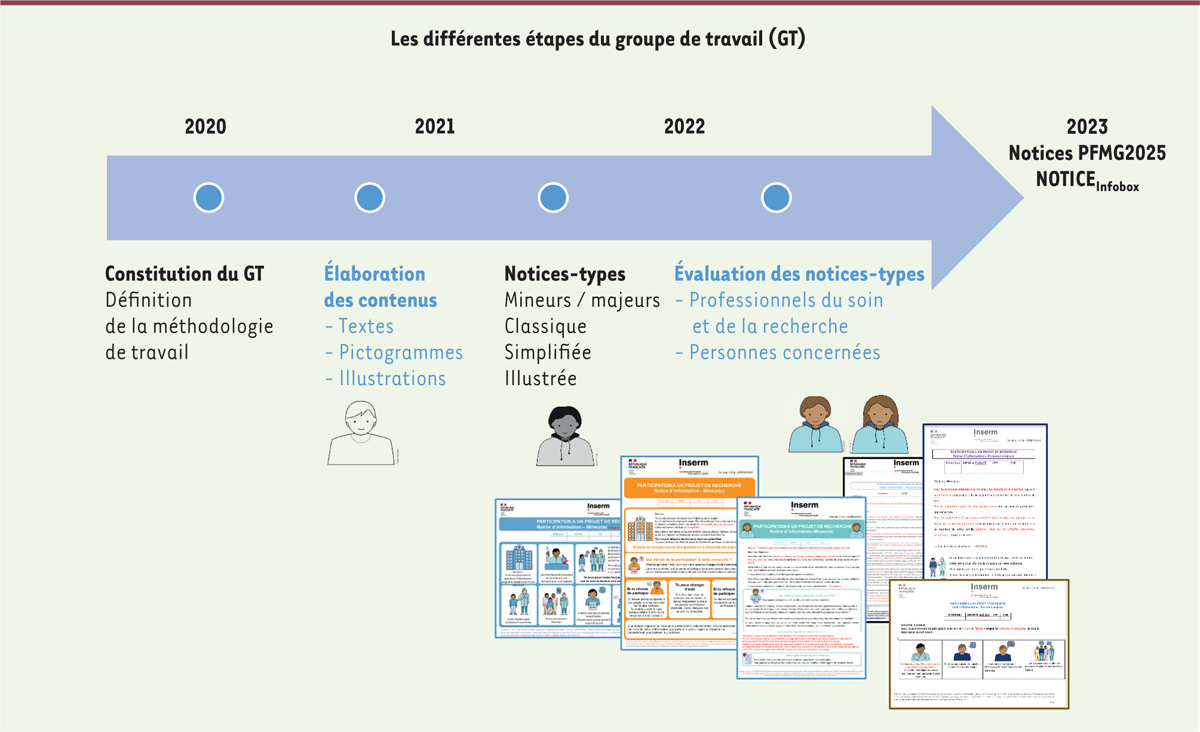
La méthode de travail du groupe a été définie, discutée et validée lors des premières réunions. Il était important d’obtenir un consensus à chaque étape du développement des contenus. Au vu de l’ampleur du travail à effectuer, des sous-groupes ont travaillé indépendamment entre ces réunions mensuelles. Les différentes étapes suivies par le groupe sont présentées dans la
Figure 2
.
 | Figure 2. Les différentes étapes du groupe de travail. |
Constitution d’un corpus de textes, de pictogrammes et d’illustrations L’élaboration des différents contenus a été réalisée selon trois séquences : 1) la conception ; 2) l’évaluation ; et 3) la validation. La conception ◗ Les niveaux de compréhension à envisager Pour les mineurs, une classification selon des tranches d’âge (moins de 6 ans, 6-11 ans, 12-18 ans) a d’abord été envisagée. Elle n’a cependant pas été retenue en raison du peu d’homogénéité de compréhension existant entre les mineurs d’une même tranche d’âge. Celle-ci peut s’expliquer notamment par des environnements socio-culturels différents ou la présence de troubles intellectuels plus ou moins sévères. De plus, une telle segmentation oriente le professionnel à utiliser la notice d’information en fonction de l’âge du mineur concerné et non de sa capacité à comprendre les informations qu’il lui délivre. L’élaboration de notices en fonction des classes d’âge pose également un problème lors du contrôle qualité des données de la recherche, la notice proposée devant être conforme à l’âge de l’enfant. Pour les adultes, l’élaboration d’une notice illustrée est apparue comme une nécessité. En effet, certains investigateurs proposent à des adultes présentant des difficultés de lecture, des notices destinées aux mineurs. Or, cette démarche est stigmatisante. Il est important que la notice illustrée permette de simplifier l’écrit sans infantilisation. Le groupe a initialement statué sur l’élaboration de contenus destinés à sept niveaux de compréhension : quatre notices-types pour les personnes majeures (classique, simplifiée, facile à lire et à comprendre, et illustrée), et trois pour les personnes mineures (jeunes enfants, pré-adolescents et adolescents). Tout en respectant les exigences éthiques et réglementaires, la sémantique, la charte graphique et le niveau de simplification du langage ont été définis et affinés pour chacun des niveaux de compréhension. Chaque notice était identifiable par une charte graphique particulière et par son niveau de compréhension.
Les notices ont été testées par des professionnels de terrain. Le choix du niveau de compréhension de la notice a été problématique pour certains d’entre eux. Par exemple, le professionnel pouvait choisir la notice illustrée destinée aux jeunes enfants pour délivrer l’information à un adolescent souffrant d’un déficit cognitif. Or, l’appellation «
Jeunes enfants
» mentionnée sur la notice est apparue stigmatisante pour l’adolescent. Le groupe a donc opté pour l’élaboration de deux notices, une pour les personnes majeures et une pour les personnes mineures, chacune déclinée en trois versions (classique, simplifiée et illustrée) sans que cette déclinaison ne soit mentionnée sur la notice.
◗ L’élaboration des textes
Les blocs thématiques (cadres réglementaires, type d’examens, finalité de l’examen, cible, langue, etc.) ont d’abord été élaborés avec l’objectif de favoriser la compréhension de la personne, tout en respectant les contraintes éthiques, juridiques et réglementaires, dans le but de favoriser son autonomie de consentement (ou rechercher l’assentiment pour un mineur). Pour chaque bloc thématique, les termes utilisés ont été discutés. Par exemple, concernant le choix entre « mutation génétique », « polymorphisme » ou « variant », c’est ce dernier terme qui a été retenu. En effet, un des impacts de la pandémie de la Covid 19 a été l’éducation de la population à certaines notions qui lui étaient jusqu’alors inconnues, en particulier celles de « variants génétiques » pour les souches virales, ou de « PCR » (
polymerase chain reaction
) pour les techniques d’analyse. Cette sémantique s’étant imposée dans le contexte de la crise, l’emploi de ce terme a été adopté afin de ne pas multiplier inutilement le vocabulaire technique utilisé.
La prise en charge de la personne et la réglementation sont différentes lorsqu’un examen est effectué dans le cadre du soin ou dans celui de la recherche. Deux sous-groupes de travail ont donc été constitués : l’un pour élaborer les blocs «
recherche
» et l’autre pour les blocs «
soin
». Les contenus des deux séries de blocs ont ensuite été harmonisés. Environ 2 000 blocs de textes ont ainsi été créés.
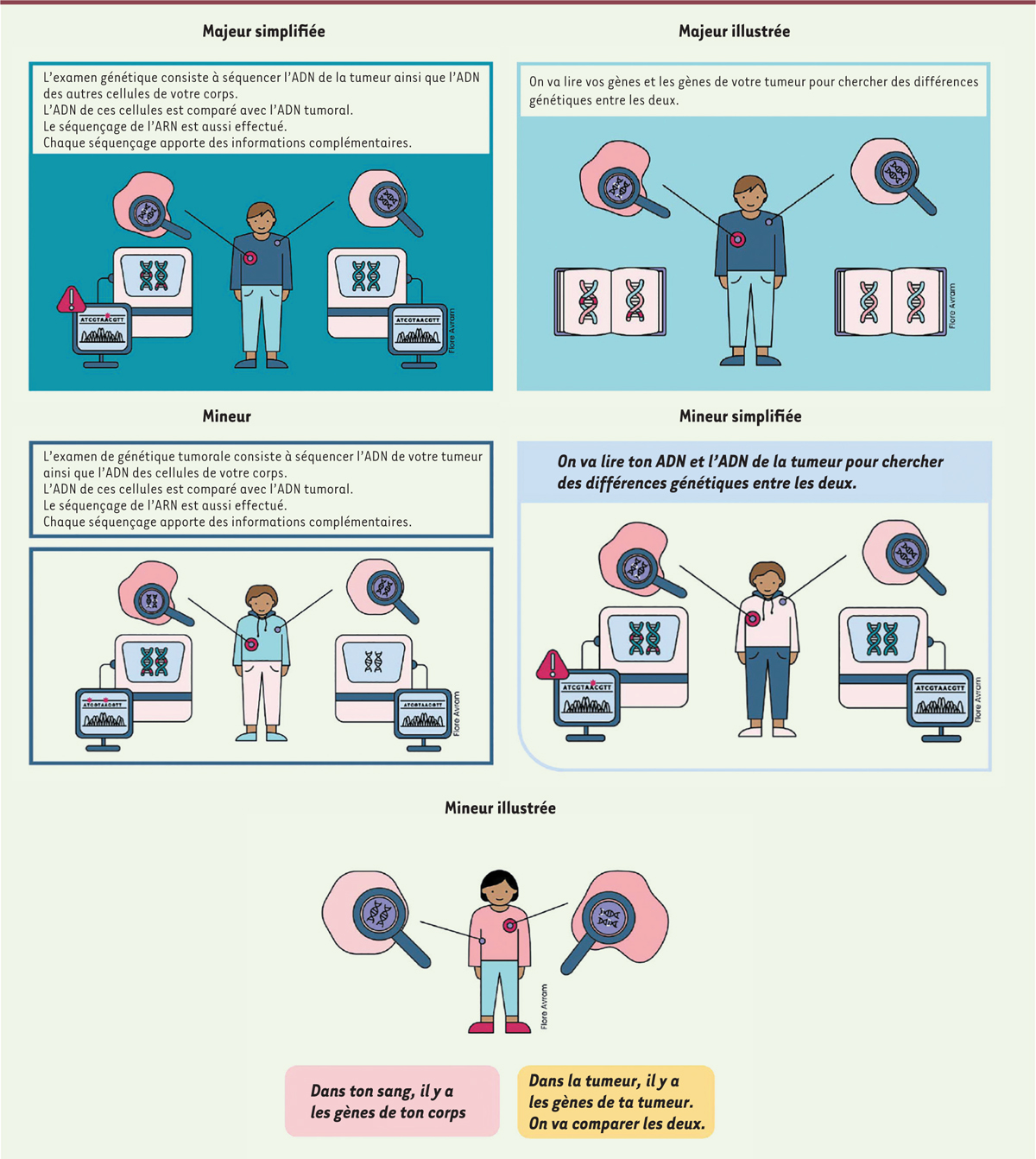
◗ Les pictogrammes et les illustrations
Les pictogrammes et les illustrations ont été réalisés selon la thématique abordée et le niveau de compréhension des personnes ciblées. Pour le séquençage du génome, par exemple, le groupe s’est appliqué à produire une représentation claire de ce qu’il est important de transmettre à la personne concernée (patient, proche ou participant à une recherche) tout en restant concis. Près de 600 pictogrammes et 85 illustrations ont ainsi été produits. Un exemple de texte et de pictogramme est présenté dans la
Figure 3
.
 | Figure 3.
Déclinaison selon le niveau compréhension : Qu’est-ce qu’un examen de génétique tumorale ?
(le niveau de compréhension « Majeur classique » n’est pas présenté puisque ce bloc ne contient que du texte).
|
◗ Des contenus aux notices-types Réglementairement, le test génétique et la recherche sont les deux seuls contextes nécessitant un consentement écrit. De nombreuses discussions ont porté sur les informations importantes à transmettre sur les notices destinées aux mineurs, comme l’utilisation de leurs données et de leurs échantillons biologiques. La notion de « transmission génétique à la descendance » a ainsi été abordée. Si cette information est importante et compréhensible pour les adultes, le contexte dans lequel il faut l’aborder avec les mineurs est difficile à déterminer. Par exemple, les adolescents ne sont pas forcément prêts à appréhender la possibilité de pouvoir transmettre une maladie.
Une phase pilote a été menée par le groupe sur les notices utilisées dans le cadre du PFMG2025 pour les examens de génétique constitutionnelle et les examens de génétique tumorale. Bien que les notices élaborées par un groupe de travail du PFMG2025 aient été validées pour leur contenu médical, scientifique et sur le plan réglementaire, elles restaient complexes et plutôt difficiles à comprendre. C’est pourquoi les notices « Majeur simplifiée », « Majeur illustrée », et les trois notices pour les mineurs se référant aux examens des caractéristiques génétiques ont été élaborées par le groupe : cinq concernaient la génétique constitutionnelle (pour les maladies héréditaires) et cinq la génétique somatique (pour les cancers). Ces notices sont à la disposition des cliniciens prescripteurs d’examens génétiques et des chargés de parcours génomique. Elles sont téléchargeables librement sur le site du PFMG2025
2
. Cette phase pilote sera élargie à d’autres examens effectués dans le cadre du soin ou pour d’autres types de prise en charge.
|
Des contenus à l’application Notice
InfoBox
©
Très vite, le groupe de travail a proposé de développer une application permettant d’automatiser la création de notices d’information. Celui-ci doit permettre : 1) de donner un accès gratuit des contenus aux investigateurs et aux cliniciens ; 2) de simplifier et faciliter la création de notices-types d’information selon le cadre (soin ou recherche), le type de la recherche, le type de notice souhaité (classique, simplifiée ou illustrée) pour les différents destinataires (personne majeure, mineure), les examens effectués dans le cadre du soin ou de la recherche ; 3) d’automatiser la création de versions pour les tuteurs légaux (parents, tuteurs) ou les curateurs ; 4) d’implémenter les évolutions de la réglementation de la recherche « en temps réel » ; 5) de simplifier la mise en conformité des notices des projets promus par l’Inserm.
Le développement du logiciel Notice
InfoBox
©
a été financé par l’Inserm. Son accès sera gratuit, sur demande justifiée
via
un formulaire disponible sur le site de l’Inserm. Les cliniciens ou les investigateurs pourront créer leurs propres notices-types pour six niveaux de compréhension et les personnaliser selon la catégorie de la recherche qu’ils effectuent (voir
Encadré
). Des notices-types d’information concernant le soin pourront également être élaborées par les cliniciens.
Tableau I.
| Nom |
Prénom |
Fonction(s) et appartenance(s) |
| Aubert Fourmy |
Chantal |
Secrétaire générale. Cercle d’éthique en recherche pédiatrique (CERPed), Paris, France |
|
| Avram |
Flore |
Artiste - auteure - Illustratrice scientifique et designer graphique free-lance |
|
| de Montgolfier |
Sandrine |
Maître de conférences en épistémologie et éthique des sciences
IRIS Institut de recherche interdisciplinaire sur les enjeux sociaux. UMR 8156 CNRS - Inserm U997 - EHESS – USPN, Campus Condorcet, Aubervilliers, France & université Paris Est, Créteil, France |
|
| Demaret |
Béatrice |
Présidente de l’association de parents d’enfants ayant des problèmes de croissance (Grandir), Asnières, France
Médecin hospitalier retraitée
Membre du Collège des relecteurs de l’Inserm, Paris, France |
|
| Gozlan |
Diane |
Cheffe de projet
Aviesan, équipe de coordination du PFMG2025, Paris, France |
|
| Koulikoff |
Frédérique |
Conseillère en identité visuelle
Inserm, Département de l’information scientifique et de la communication (DISC), Paris, France |
|
| Lamarche |
Dominique |
Membre de l’Association française des hémophiles, Paris, France
Membre du Comité de protection des personnes Île-de-France 3
Membre du Collège des relecteurs de l’Inserm, Paris, France |
|
| Lanta |
Marie |
Coordinatrice du comité de patients, Fondation Vaincre Alzheimer, Paris, France
Membre du Groupe de réflexion avec les Associations de malades de l’Inserm (Gram) |
|
| Maizeroi |
Myriam |
Animatrice Qualité
Inserm - Pôle Recherche Clinique, Paris, France |
|
| Malen |
Jean-Pierre |
Pédopsychiatre.
Autisme 75- IME « Cours de Venise », Paris, France
Membre de l’ARAPI (Association pour la recherche sur l’autisme et la prévention des inadaptations), Fondettes, France
Membre du Collège des relecteurs de l’Inserm, Paris, France |
|
| Mathieu |
Flavie* |
Docteur en santé publique. Épidémiologiste généticienne
Responsable du Collège des relecteurs de l’Inserm
Inserm, Service Sciences et société, DISC, Paris, France
Invitée permanente du Comité éthique de l’Inserm |
|
| Mathieu |
Marion |
Formatrice scientifique, Association Tous chercheurs, Marseille, France
Maître de conférence associée, Aix Marseille univ, CNRS, EFS, ADES, Marseille, France
Chargée de mission, Espace de réflexion éthique PACA-Corse, Marseille, France |
|
| Morillon |
Lucie |
Chargée de communication
Aviesan, équipe de coordination du PFMG2025, Paris, France |
|
| Nowak |
Frédérique |
Coordinatrice opérationnelle
Aviesan, équipe de coordination du PFMG2025, Paris, France |
|
| Panchal |
Maï |
Directrice générale et scientifique
Fondation Vaincre Alzheimer, Paris, France
Membre du Collège des relecteurs de l’Inserm, Paris, France |
|
| Pierrart |
Carole |
Responsable des affaires réglementaires et référente protection des données
Cheffe de projets, Inserm - Pôle Recherche Clinique, Paris, France |
|
| Prouvost |
Marie-France |
Membre de l’association Vaincre la Mucoviscidose, Paris, France
Membre du Collège des relecteurs de l’Inserm, Paris, France |
|
| Tronel |
Vincent |
Président de l’association les AMIS FSH, Tours, France
Membre du Collège des relecteurs de l’Inserm, Paris, France |
|
| Zucker |
Jean-Michel |
Président du Cercle d’éthique en recherche pédiatrique (CERPed), Paris, France |
Les membres groupe de travail « Notices d’information ».
*Coordinatrice du groupe de travail.
|
|
Les différentes catégories de recherche
– Essais cliniques de médicaments
– Investigation clinique sur les dispositifs médicaux
– RIPH1 : les recherches interventionnelles qui comportent une intervention sur la personne non justifiée par sa prise en charge habituelle
– RIPH2 : recherche impliquant la personne humaine à risques et contraintes minimes
– RIPH3 : recherche impliquant la personne humaine non interventionnelle
– Réutilisation de données (hors données du Système national des données de santé, SNDS)
– Recherche sur les données du SNDS
– Recherche scientifique hors santé (dont les Sciences humaines et sociales)
|
|
Évaluation et validation des notices-types
Dans une phase test, les notices-types élaborées et disponibles
via
l’application ont été soumises à des professionnels du soin et de la recherche, de l’éthique et de la réglementation et à des membres d’associations de patients.
Pour le soin, le groupe a sollicité des professionnels du réseau d’oncopédiatrie génétique, dans le cadre d’un projet de recherche financé par l’INCa [
14
], des généticiens prescripteurs d’examens génétiques pour le cancer, des utilisateurs des notices (chargés de parcours génomiques et prescripteurs du PFMG2025), et des représentants des filières de santé maladies rares.
Pour la recherche, des notices-types ont été créées pour permettre une évaluation simplifiée. Ces notices ont été évaluées par des chercheurs en génétique, le groupe de parents de l’Union des associations de parents d’enfants atteints de cancer ou de leucémie (UNAPECLE), les membres de la délégation à la protection des données de l’Inserm, et les membres du pôle de recherche clinique de l’Inserm. Les notices-types, amendées par le groupe, ont ensuite été adressées à différentes instances éthiques ou réglementaires. |
La conduite de ce projet a nécessité de définir une méthode de travail et d’associer, dès la mise en place du groupe de travail, l’ensemble des acteurs intervenant tout au long du processus d’élaboration, d’évaluation et d’utilisation d’une notice d’information dans le cadre du soin ou de la recherche. Cette démarche de co-construction, associant des personnes aux compétences différentes et représentant au plus près les intérêts des patients et des usagers, a permis d’assurer une démarche adaptée et acceptable par tous. La réglementation étant en perpétuelle évolution, il était indispensable de pouvoir s’appuyer sur un groupe pérenne. Cette pérennité permet une veille suivie de la réglementation mais aussi de faire évoluer les contenus selon les besoins des utilisateurs.
Au-delà de recommandations ou de modèles pouvant être rapidement obsolètes, la mise à disposition d’une application simple et intuitive, gratuite et accessible répond aux demandes des professionnels de santé et de la recherche. L’application Notice
InfoBox
©
est un dispositif innovant, outil concret allant au-delà de simples recommandations.
Notice
InfoBox
©
est mis à disposition des professionnels, chercheurs ou cliniciens, en français au cours de l’année 2023, pour créer des notices d’information en français, à partir du 1
er
octobre 2023 sur le site noticeinfobox.inserm.fr. À partir de 2024, il sera possible de créer des notices-types en différentes langues (français, anglais, espagnol, portugais et arabe) pour faciliter la compréhension des personnes non francophones et être utilisables dans le cadre de projets internationaux.
Une évaluation de l’application sera demandée à tous les utilisateurs et un questionnaire de satisfaction sera soumis aux destinataires des notices. Cette évaluation, en cours d’élaboration avec des équipes de recherche, permettra d’améliorer l’application et les notices régulièrement et d’être au plus près des besoins de chacun.
L’utilisation de notices standardisées permettra aux comités de relecture et aux instances d’évaluation de se concentrer sur le fond des notices d’information plutôt que sur leur forme. La création des notices adaptées à leur niveau de compréhension
via
l’application Notice
InfoBox
©
devrait favoriser l’autonomie de consentement des personnes à qui elles s’adressent.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Le projet a été subventionné par l’Inserm (DISC et plan France médecine génomique 2025). Le projet GeneInfoKid a été subventionné par l’INCa (N° 2018-127) et les cancéropôles d’Île-de-France et d’Occitanie.
|
Nous remercions vivement toutes les personnes qui ont participé à l’évaluation des notices-types : les professionnels du réseau d’oncopédiatrie génétique et l’ensemble des équipes cliniques partenaires du projet GeneInfoKid : l’Institut Gustave Roussy, l’Institut Curie, l’hôpital Robert-Debré, l’hôpital Trousseau et les CHU de Montpellier et de Toulouse ; Camille Saldana, conseillère en génétique au CHU de Rouen, et les chargé(e)s de parcours génomique et prescripteurs du plan France médecine génomique ; Dominique Stoppa-Lyonnet, Institut Curie, université Paris Cité ; le groupe de parents de l’UNAPECLE ; les membres (actuels et anciens) de la délégation à la protection des données de l’Inserm : Teodora Yovkova, Frédérique Lesaulnier et Chloé Garnerone ; Hélène Espérou et les membres du pôle Recherche Clinique de l’Inserm et François Hirsch, membre du Comité éthique de l’Inserm.
|
Footnotes |
3.
Ross
LF
,
Saal
HM
,
David
KL
,
et al.
Technical report: ethical and policy issues in genetic testing and screening of children.
.
Genet Med
.
2013;
;
15
:
:234.
–
245
.
4.
De Montgolfier
S
,
Hervouet
L
,
Le Tirant
S
,
et al.
Intégrer l’avis de l’enfant dans les décisions de soin : le cas du consentement aux investigations génétiques en oncopédiatrie.
.
Anthropologie & Santé
.
2021
;
:21.
.
https://doi.org/10.4000/anthropologiesante.9269
.
5.
Julia
S
,
Bertier
G
,
Cambon-Thomsen
A
.
Quand l’anticipation devient plurielle : la complexité des données génomiques à l’épreuve des pratiques professionnelles.
.
Revue française d’éthique appliquée
.
2016
;
:19.
–
28
.
6.
Code de la santé publique : Chapitre II : Profession de conseiller en génétique (Articles L1132–1 à L1132–7).
.
7. LOI n° 2021–1017 du 2 août 2021 relative à la bioéthique. 8.
Déclaration de Reykjavik – Considérations éthiques relatives à l’utilisation de la génétique dans les soins de santé, adoptée par la 56
e
Assemblée Médicale Mondiale, Santiago (Chili), octobre 2005, révisée par la 70
e
Assemblée générale, Tbilissi (Géorgie), octobre 2019.
9.
Convention pour la protection des Droits de l’homme et de la dignité de l’être humain à l’égard des applications de la biologie et de la médecine. Convention sur les Droits de l’homme et la biomédecine, STCE n° 164, Oviedo, 4 avril 1997.
10.
Code civil, Article 371–1.
11.
Rial-Sebbag
E
,
Farnos
C
.
La réalisation de tests génétiques chez le mineur : un patient vulnérable, parfois oublié
.
.
Droit, Santé et Société;
2016
; Juin :
:38.
–
44
.
12.
Code de santé publique, Article L1122–2.
13.
Mathieu
F
,
Lanta
M
,
Bungener
M
.
L’apport des patients dans la relecture des protocoles de recherche.
.
Med Sci (Paris)
.
2023;
;
39
:
:558.
–
63
.
14.
GeneInfoKid. Prédispositions génétiques aux pathologies malignes de l’enfant et séquençage de nouvelle génération : questions éthiques, légales et psychologiques. http://iris.ehess.fr/index.php?4230. INCa (AAP SHS 2018) – Cancéropole Île de France.
|