| |
| Med Sci (Paris). 39(8-9): 619–624. doi: 10.1051/medsci/2023095.Je mène donc tu suis Comment les cellules se coordonnent lors de migrations collectives Gregory Emery1,2* 1Unité de recherche en transport vésiculaire et signalisation cellulaire, Institut pour la recherche en immunologie et en cancérologie de l’université de Montréal (IRIC), Université de Montréal
,
Montréal
,
QuébecH3C 3J7
,
Canada 2Département de pathologie et biologie cellulaire, Faculté de médecine, Université de Montréal
,
Montréal
,
QuébecH3C 3J7
,
Canada |
Vignette (© Gregory Emery).
La migration cellulaire collective joue un rôle fondamental au cours du développement, dans l’homéostasie des tissus et de la cicatrisation [
1
–
4
]. Elle constituerait également un mode de migration communément utilisé par les cellules cancéreuses à diverses étapes de la cascade métastatique [
5
,
6
]. La migration cellulaire collective peut prendre des formes très variées, allant de cellules faiblement attachées à de larges flux de cellules, en passant par des petits
clusters
. Ces derniers sont particulièrement importants à comprendre car ils sont impliqués lors de la formation de métastases et peuvent être potentiellement une cible thérapeutique [
7
,
8
]. Dans cette revue, nous nous concentrerons sur la migration des cellules de bordure dans la chambre d’œuf de drosophile, un remarquable modèle d’étude de la migration de petits
clusters
cellulaires [
9
,
10
]. Les cellules de bordure forment en effet un groupe de six à dix cellules qui migre entre les cellules nourricières de la chambre d’œuf. Comme lors de nombreuses migrations collectives, le
cluster
est organisé en cellules
leaders
(ou cellules meneuses) et cellules suiveuses. En général, il n’y a qu’une seule ou deux cellules
leaders
qui forment des protrusions efficaces à l’avant du groupe, alors que les cellules suiveuses ne forment pas de protrusions stables et contribuent principalement à la migration en se contractant (
Figure 1
) [
10
–
12
].
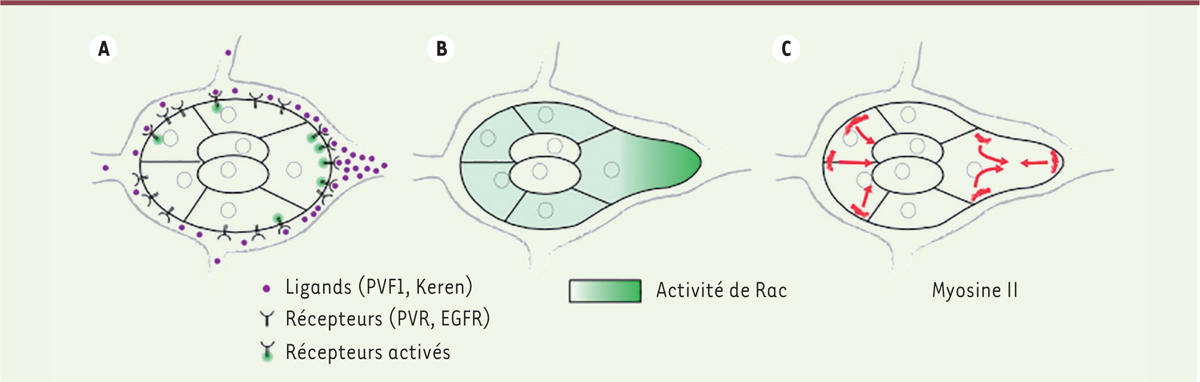
 | Figure 1.
A.
Un gradient de ligands des RTK (en violet) se forme entre les cellules nourricières. Il active les RTK préférentiellement à l’avant du
cluster
de cellules de bordure.
B.
La polarisation de la signalisation des RTK est transformée en une forte polarisation de Rac. Rac est actif dans toutes les cellules, mais son activité est beaucoup plus importante dans la cellule
leader
qui forme alors une protrusion. C. La myosine II induit une contractilité à l’arrière du
cluster
, à la fois à la base et à la pointe de la protrusion dans la cellule
leader
. Ces contractilités propulsent le
cluster
vers l’avant. PVR :
PDGF/VEGF receptor
, orthologue des récepteurs du PDGF (platelet-derived growth factor) et du VEGF (vascular endothelial growth factor) ; EGFR :
epithelial growth factor receptor.
|
|
L’architecture du cluster de cellules de bordure
La chambre d’œuf de drosophile est composée de cellules de la lignée germinale et de cellules somatiques, les cellules folliculaires [
13
]. Les cellules germinales sont aux nombres de 16. Elles proviennent d’une cellule germinale initiale qui se divise jusqu’au stade de 16 cellules. Toutefois, ces divisions sont incomplètes et les cellules restent toujours connectées par un canal de forme annulaire, riche en actine. Une de ces 16 cellules va devenir l’ovocyte, alors que les 15 autres cellules deviendront des cellules nourricières. Au cours de la croissance de la chambre d’œuf, le contenu des cellules nourricières se transfère dans l’ovocyte pour promouvoir sa croissance. Lors des premiers stades du développement de la chambre d’œuf, les cellules folliculaires entourent uniformément les cellules germinales en formant un épithélium. Deux cellules folliculaires se différencient en cellules polaires à l’extrémité antérieure ainsi qu’à l’extrémité postérieure de la chambre d’œuf. Les deux cellules polaires antérieures sécrètent le ligand
Unpaired
1
, qui agit à distance et active la voie de signalisation JAK (
Janus kinases
)/Stat (
signal transducer and activator of transcription
) dans les cellules environnantes. Quatre à huit de ces cellules se différencient en cellules de bordure et se joignent alors aux cellules polaires pour former le
cluster
de cellules de bordure [
14
]. Cet ensemble de cellules se détache du reste de l’épithélium folliculaire, tout en maintenant des jonctions adhérentes entre chaque cellule grâce à la DE-cadhérine, l’orthologue de la cadhérine épithéliale, qui permet également l’interaction avec les cellules nourricières qui entourent le
cluster
[
15
,
16
]. Tout au long de la migration, les cellules de bordure vont conserver une certaine polarité apico-basale héritée de l’épithélium folliculaire. Cette polarité va se mêler avec la polarité induite par le processus de migration [
17
].
|
Les cellules de bordure migrent par chimiotaxie
Pour migrer directionnellement, le
cluster
est attiré par des signaux émis par l’ovocyte. Ces signaux sont des ligands de récepteurs à activité tyrosine kinase (RTK), en particulier Pvf1, Spitz et Keren [
18
,
19
]. Ces ligands diffusent entre les cellules nourricières pour atteindre les cellules de bordure [
20
]. À la surface des cellules de bordure, ils activent les récepteurs tyrosine kinase PVR (
PDGF/VEGF receptor
), l’orthologue des récepteurs du PDGF (
platelet-derived growth factor
) et du VEGF (
vascular endothelial growth factor
), et de l’EGFR (
epithelial growth factor receptor
) [
21
,
22
]. Cela conduit à l’activation de la petite GTPase Rac par des facteurs d’échange de guanine (GEF), tels que Vav, qui se lie directement à PVR [
23
]. D’autres GEF (par exemple, le complexe DOCK/ELMO ou Cdep [
chondrocyte-derived ezrin-like domain-containing protein
]) sont aussi impliqués, mais leur mode d’activation n’a pas été clairement caractérisé [
24
,
25
]. L’activation de Rac joue plusieurs rôles, le principal étant la formation de protrusions à l’avant du groupe de cellules. Les protrusions sont contractiles et dynamiques, grâce à la présence de forces contractiles induite par la myosine II, à leur base et à leur extrémité [
26
–
29
]. Des extensions sont formées tout autour du
cluster
, mais seules les protrusions à l’avant sont étendues et relativement stables. Les autres extensions sont éphémères et ne semblent pas contribuer à la progression du groupe de cellules [
26
]. Curieusement, le rôle des protrusions formées à l’avant du groupe n’est pas clair. Des expériences d’optogénétique utilisant des formes activables et inactivables de Rac, ont montré que la formation de protrusions est suffisante pour guider la migration [
30
]. Elles semblent donc être capables de promouvoir le mouvement du
cluster
. Toutefois, la contractilité des cellules suiveuses est aussi importante pour la migration. Il a donc été proposé que la seule fonction des protrusions est d’ouvrir un chemin permettant la migration [
26
]. Quel que soit le rôle des protrusions principales, il est donc crucial que ces protrusions soient formées uniquement au moment et à l’endroit opportuns.
Comment l’avant du cluster et le front de migration sont-ils définis ? Les ligands des RTK sont sécrétés par l’ovocyte et diffusent dans les espaces entre les cellules nourricières. Il a été démontré qu’ils sont effectivement capables de diriger la migration : une source de ligands ectopique, induite à une position latérale de la chambre d’œuf, est en effet suffisante pour rediriger le
cluster
[
18
,
19
]. L’espace entre les cellules nourricières étant restreint, on peut imaginer qu’il se remplisse rapidement de ligands. La façon dont le gradient est maintenu reste peu clair. Une hypothèse qui expliquerait ce phénomène est qu’un mécanisme actif, tel qu’une endocytose de ligand par les cellules nourricières, maintient le gradient. Toutefois, à notre connaissance, cela n’a jamais été testé. Cependant, l’agencement des cellules nourricières est important et permet la formation de protrusions de façon préférentielle à certaines positions, en particulier à l’avant du groupe [
20
].
Le
cluster
semble donc être capable de détecter le gradient de ligands et d’y répondre de telle manière que les RTK actifs soient concentrés à l’avant du groupe de cellules et que seules une ou deux cellules mènent la migration et forment des protrusions efficaces. Le gradient de ligands s’étend dans l’ensemble de la chambre d’œuf. Comme chaque cellule est fortement ancrée aux autres par des jonctions adhérentes, leur surface, qui est à la périphérie du
cluster
, est exposée à ces ligands. Cependant, les cellules suiveuses ne réagissent pas comme les cellules
leaders
puisque l’activité des RTK et de Rac y est faible [
30
–
34
]. Ainsi, deux questions majeures se posent : 1) comment l’activité des RTK est-elle polarisée au niveau du groupe de cellules pour diriger la migration ; et 2) quel mécanisme assure que seule une ou deux cellules forment des protrusions.
|
Maintenance de l’activité RTK dans les cellules leaders
Les premiers éléments de réponses quant aux mécanismes maintenant les RTK actifs à l’avant du groupe de cellules ont été obtenus il y a près de vingt ans par le groupe de Pernille Rørth, alors à l’EMBL (
European Molecular Biology Laboratory
), Heidelberg, Allemagne. Ces auteurs ont montré que l’endocytose était importante pour la polarisation des RTK au niveau du
cluster
[
33
]. En perturbant les voies d’endocytose, la quantité de RTK actifs exprimés à la membrane des cellules augmente tout autour du groupe. Le
cluster
ne peut alors plus se diriger car la différence d’activité des RTK entre l’avant et l’arrière est insuffisante. Ces résultats indiquent que l’endocytose contrôle les niveaux de RTK présents à la membrane plasmique, possiblement différemment dans les cellules
leaders
. Ces expériences confirment donc l’importance d’avoir un mécanisme actif pour maintenir les RTK à l’avant du groupe. Toutefois, elles n’ont pas permis de déterminer si le trafic des récepteurs eux-mêmes est régulé par endocytose, et s’ils étaient préférentiellement recyclés à la membrane plasmique dans les cellules
leaders
ou préférentiellement dégradés dans les cellules suiveuses.
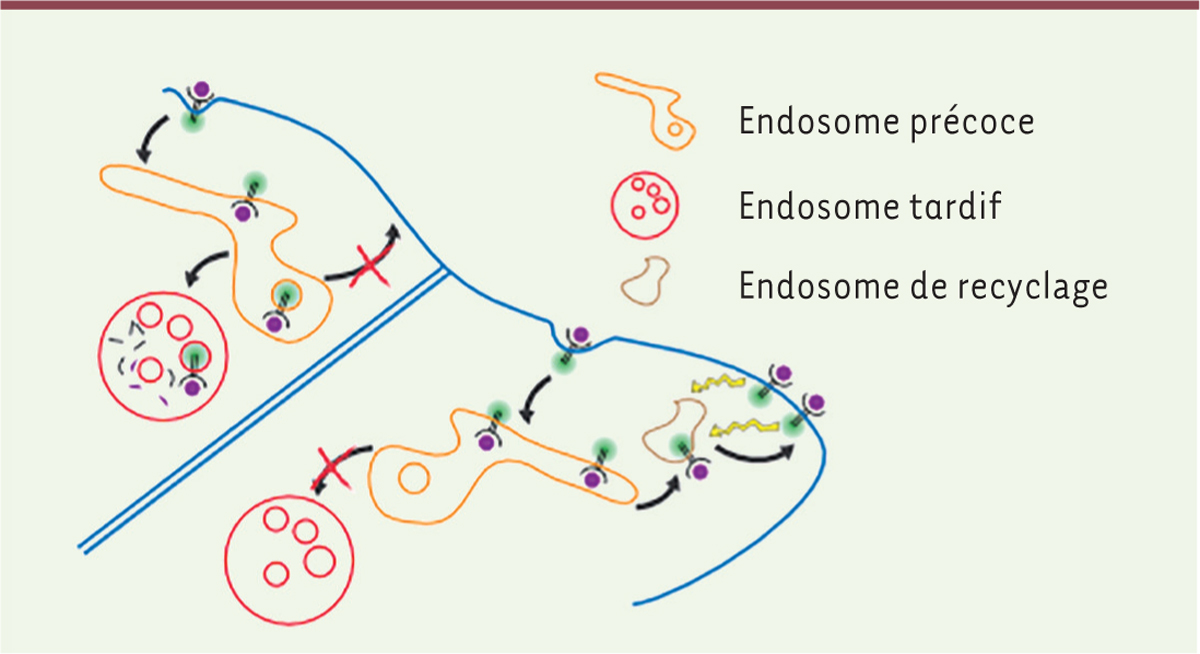
Des études ultérieures ont montré que le trafic des RTK est bel et bien différent dans les cellules
leaders
, dans lesquelles les RTK sont efficacement recyclés à la membrane plasmique, alors que dans les autres cellules, ils semblent être préférentiellement dégradés [
31
,
34
–
36
] (
Figure 2
), ce qui modifie l’équilibre des RTK actifs en faveur des cellules
leaders
. Les protéines qui ont été impliquées dans ce mécanisme sont les petites GTPases Rab5 et Rab11 [
31
], leurs régulateurs, tels que leurs protéines activatrices de GTPase (GAP) respectives Rn-Tre et Evi5 [
35
], le facteur d’échange Sprint qui agit sur Rab5 [
33
], et le complexe de l’exocyste, qui est un effecteur de Rab11 [
31
,
35
,
36
]. Notons que l’activité RTK pourrait avoir un effet rétroactif sur l’endocytose en promouvant le recyclage, ce qui pourrait expliquer que le trafic des RTK est différent dans les cellules
leaders
[
36
]. Comme la voie d’endocytose, et le trafic vésiculaire en général, jouent d’autres rôles dans la migration des cellules de bordure [
29
,
32
,
37
–
39
], il est difficile de déterminer leurs effets spécifiques sur les RTK. Pour comprendre plus précisément comment le trafic vésiculaire est régulé, des cribles, dirigés sur les régulateurs du trafic vésiculaire, ont été effectués. Ils ont permis d’augmenter notre compréhension de la régulation des GTPases Rab [
35
] dans les cellules de bordure, et ont identifié des régulateurs d’autres aspects de la migration de ces cellules [
38
]. Il reste toutefois beaucoup de régulateurs du trafic vésiculaire à caractériser dans les cellules de bordure et dans d’autres types de migrations collectives.
 | Figure 2.
Dans les cellules suiveuses
(à gauche), les RTK sont endocytés et préférentiellement envoyés dans la voie de dégradation lysosomale. Le recyclage dans ces cellules est réduit (indiqué par un « x » rouge). Au contraire, dans les cellules
leaders
, le transport des RTK dans les endosomes tardifs et les lysosomes est faible, et le recyclage est favorisé. Les RTK eux-mêmes agissent, probablement de façon indirecte, sur la voie de recyclage (flèches jaunes).
|
|
Inhibition de la formation de protrusions dans les cellules suiveuses
Même si l’activité des RTK est concentrée à l’avant du groupe, les autres cellules ne sont pas entièrement dépourvues d’activité RTK. Mais alors, pourquoi ces cellules ne forment-elles pas de protrusions robustes ? Il semble qu’un mécanisme permette d’identifier lorsqu’une cellule possède une activité élevée de Rac. Cette cellule devient alors une cellule
leader
qui transmet cette information aux autres cellules. Elles deviennent alors des cellules suiveuses et ne formeront plus de protrusion. Ce phénomène a été mis en évidence grâce à une utilisation élégante d’outils d’optogénétique pour moduler l’activité de la GTPase Rac [
30
]. En effet, l’inhibition locale de Rac dans la cellule
leader
induit la formation de protrusions ectopiques dans les cellules suiveuses. Au contraire, l’activation par optogénétique de Rac dans une cellule suiveuse transforme celle-ci en nouvelle cellule
leader
. Cette cellule va alors interagir avec les autres cellules du
cluster
afin qu’elles inhibent leur capacité à former des protrusions, y compris l’ancienne cellule
leader
qui cesse alors de former des extensions [
30
].
Comment le niveau d’activité de Rac est-il détecté ? Quels sont les signaux qui inactivent Rac dans les cellules suiveuses, et comment sont-ils transférés d’une cellule à l’autre ? Les réponses à toutes ces questions sont peu claires, mais il semble qu’une structure supracellulaire d’actine soit impliquée [
32
]. Cette structure est présente à la périphérie du
cluster
et est rendue continue d’une cellule à l’autre par les jonctions adhérentes qui relient les cellules de bordure entre elles. Elle utiliserait la contractilité pour bloquer de nouvelles protrusions [
15
,
17
,
29
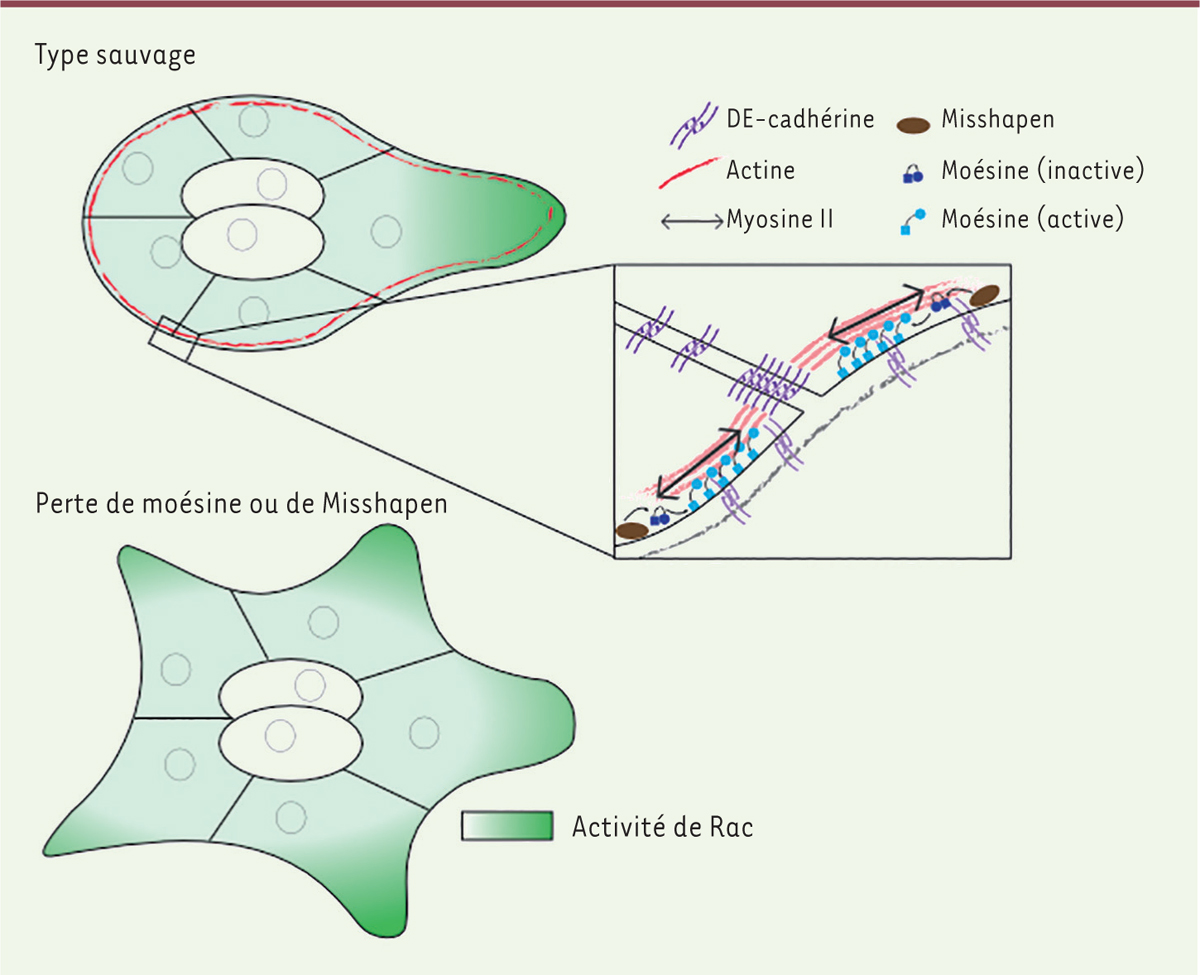
]. Cette structure est ancrée au cortex par la moésine [
32
], une protéine de la famille des ERM (ezrine, radixine, moésine) qui, lorsqu’elle est activée, lie à la fois l’actine filamenteuse et la membrane plasmique. En absence de l’activation de la moésine à la périphérie du
cluster
, la structure supracellulaire d’actine ne peut pas se former, et la coordination entre les cellules est perdue [
29
,
32
]. En l’absence de moésine activée, toutes les cellules sont donc capables d’activer Rac et de former des protrusions. La moésine est généralement phosphorylée par des sérine/thréonine kinases de la famille des Ste-20 kinases (
sterile 20 protein
). Chez la drosophile, alors que c’est la Ste-20 kinase Slik qui agit habituellement sur la moésine [
40
,
41
], c’est une autre Ste-20 kinase, Misshapen, qui active la moésine dans les cellules de bordure [
29
] (
Figure 3
).
 | Figure 3.
La phosphorylation de la moésine par Misshapen
, à la périphérie du groupe de cellules de bordure, entraîne la formation d’une structure supracellulaire d’actomyosine qui est rendue continue d’une cellule à l’autre par la DE-cadhérine. En absence de moésine phosphorylée, toutes les cellules sont capables de former des protrusions et présentent une forte activité de Rac. Comment l’actine supracellulaire contrôle-t-elle l’activité de Rac dans les cellules suiveuses reste inconnu.
|
Quel mécanisme inhibe-t-il l’activité de Rac pour éviter la formation de protrusions dans les cellules suiveuses ? Les GTPases Rac et Rho sont connues comme étant fréquemment antagonistes l’une de l’autre (par exemple, voir [
42
–
45
]). Rho agit principalement sur la contractilité de l’actomyosine [
46
]. Dans le cadre de la migration des cellules de bordure, cette contractilité est nécessaire pour que le
cluster
se détache de l’épithélium de cellules folliculaires, pour contracter l’arrière du groupe de cellules, et pour la dynamique des protrusions [
26
,
29
,
47
]. Les défauts de l’activité de contractilité, de la formation de protrusions par Rac et de l’actine supracellulaire semblent souvent associés [
17
,
26
,
29
]. Cela est dû, en partie, au fait qu’en absence de contractilité, les protrusions, même mineures, ne peuvent se contracter, ce qui conduit à un excès de longues protrusions. La contractilité de l’actomyosine est précisément contrôlée spatio-temporellement par la phosphatase PP1 (
protein phosphatase 1
) [
28
], par la protéine de polarité Par1 [
47
], et par Arf6 et sa GAP, Drongo [
38
]. Il est séduisant de penser que Rac et Rho sont antagonistes dans les cellules suiveuses. Toutefois, la hiérarchisation de Rac et de Rho n’est pas aussi triviale qu’anticipé, comme l’a démontré récemment le groupe de Xiaobo Wang (CNRS UMR 5088 – université de Toulouse, Centre de biologie intégrative). En effet, dans une étude récente [
48
], ces auteurs ont décrit le fait que la contractilité Rho-dépendante requiert un certain niveau d’activation de Rac dans les cellules suiveuses pour promouvoir la polymérisation de filaments d’actine. L’activité Rac n’est donc pas simplement antagoniste à celle de Rho, et elle ne peut pas être entièrement inhibée dans les cellules suiveuses pour avoir une migration efficace. Identifier l’ensemble des régulateurs des GTPases Rho est donc capital pour comprendre la régulation de la contractilité ainsi que la formation des protrusions et leur dynamique.
|
La migration des cellules de bordure chez la drosophile est un modèle qui a permis d’identifier de nombreux mécanismes moléculaires régulant la migration collective de cellules en
cluster
. Il s’agit d’un modèle relativement simple, dans un organisme qui est facilement manipulable génétiquement et qui est accessible à des analyses très précises d’imagerie, y compris en temps réel. Ce modèle a révélé le haut degré de complexité nécessaire à la régulation de la migration collective. À côté des processus que nous avons décrits, l’implication d’autres voies de signalisation a été mise en évidence dans des processus aussi divers que la différenciation des cellules de bordure, la cinétique de leur migration [
49
,
50
], et l’ancrage des cellules après leur migration [
51
].
Les découvertes réalisées chez la drosophile dans la migration des cellules de bordure sont-elles pertinentes pour comprendre des processus importants pour la santé humaine ? En particulier, est-ce que les cascades moléculaires utilisées chez la drosophile pourraient être exploitées pour cibler la migration des cellules cancéreuses allant former des métastases ? La réponse est complexe. En effet, de nombreuses migrations de cellules cancéreuses ressemblent à la migration des cellules de bordure : une migration en petit groupe, l’implication de récepteurs tyrosine kinase, le maintien de contacts entre cellules, la hiérarchisation entre cellules
leaders
et cellules suiveuses, le contrôle des GTPases de la famille Rho et de la formation de protrusions [
1
,
6
,
7
,
52
,
53
]. Il y a toutefois des différences. Par exemple, les cellules de bordure n’utilisent pas d’adhérences focales. Il est donc difficile de généraliser, mais certaines découvertes semblent néanmoins particulièrement intéressantes. En particulier, l’implication de la kinase Misshapen dans la coordination des cellules de bordure [
29
] pourrait révéler la fonction de ses orthologues dans la progression de cancers spécifiques. En effet, les trois orthologues humain de Misshapen, MAP4K4 (
mitogen-activated protein kinase kinase kinase kinase 4
), MINK1 (
Misshapen like kinase 1
) et TNIK (
TRAF2 and NCK [non-catalytic region of tyrosine kinase] interacting kinase
), ont tous été reliés à la formation de métastases [
54
–
59
]. MAP4K4 semble jouer un rôle important dans diverses migrations, y compris des migrations de cellules cancéreuses et des migrations collectives, comme la migration de cellules endothéliales [
60
,
61
]. Bloquer l’activité de MAP4K4 pourrait avoir un double effet anti-métastatique en bloquant à la fois la migration des cellules tumorales et la néovascularisation nécessaire à la croissance de la tumeur.
|
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Friedl
P
,
Gilmour
D
.
Collective cell migration in morphogenesis, regeneration and cancer.
.
Nat Rev Mol Cell Biol
.
2009;
;
10
:
:445.
–
457
.
2.
Mayor
R
,
Etienne-Manneville
S
.
The front and rear of collective cell migration.
.
Nat Rev Mol Cell Biol
.
2016;
;
17
:
:97.
–
109
.
3.
Aman
A
,
Piotrowski
T
.
Cell migration during morphogenesis.
.
Dev Biol
.
2010;
;
341
:
:20.
–
33
.
4.
Rothenberg
KE
,
Fernandez-Gonzalez
R
.
Forceful closure: cytoskeletal networks in embryonic wound repair.
.
Mol Biol Cell
.
2019;
;
30
:
:1353.
–
1358
.
5.
Thiery
JP
.
Metastasis: alone or together?
.
Curr Biol
.
2009;
;
19
:
:R1121.
–
R1123
.
6.
Khalil
AA
,
Friedl
P
.
Determinants of leader cells in collective cell migration.
.
Integr Biol (Camb)
.
2010;
;
2
:
:568.
–
574
.
7.
Yamamoto
A
,
Doak
AE
,
Cheung
KJ
.
Orchestration of Collective Migration and Metastasis by Tumor Cell Clusters.
.
Annu Rev Pathol
.
2023;
;
18
:
:231.
–
56
.
8.
Aramini
B
,
Masciale
V
,
Arienti
C
,
et al.
Cancer Stem Cells (CSCs), Circulating Tumor Cells (CTCs) and Their Interplay with Cancer Associated Fibroblasts (CAFs): A New World of Targets and Treatments.
.
Cancers (Basel)
.
2022
;
:14.
.
9.
Stuelten
CH
,
Parent
CA
,
Montell
DJ
.
Cell motility in cancer invasion and metastasis: insights from simple model organisms.
.
Nat Rev Cancer
.
2018;
;
18
:
:296.
–
312
.
10.
Peercy
BE
,
Starz-Gaiano
M
.
Clustered cell migration: Modeling the model system of Drosophila border cells.
.
Semin Cell Dev Biol
.
2020;
;
100
:
:167.
–
76
.
11.
Montell
DJ
,
Yoon
WH
,
Starz-Gaiano
M
.
Group choreography: mechanisms orchestrating the collective movement of border cells.
.
Nat Rev Mol Cell Biol
.
2012;
;
13
:
:631.
–
645
.
12.
Roberto
GM
,
Emery
G
.
Directing with restraint: Mechanisms of protrusion restriction in collective cell migrations.
.
Semin Cell Dev Biol
.
2022;
;
129
:
:75.
–
81
.
13.
Spradling
A
.
Developmental genetics of oogenesis. In: The development of Drosophila melanogaster.
.
Bate
M
,
Martinez Arias
A
(Eds).
NewYork:
:
Cold Spring Harbor;
,
1993
.
14.
Silver
DL
,
Montell
DJ
.
Paracrine signaling through the JAK/STAT pathway activates invasive behavior of ovarian epithelial cells in Drosophila.
.
Cell
.
2001;
;
107
:
:831.
–
841
.
15.
Cai
D
,
Chen
SC
,
Prasad
M
,
et al.
Mechanical feedback through E-cadherin promotes direction sensing during collective cell migration.
.
Cell
.
2014;
;
157
:
:1146.
–
1159
.
16.
Niewiadomska
P
,
Godt
D
,
Tepass
U
.
DE-Cadherin is required for intercellular motility during Drosophila oogenesis.
.
J Cell Biol
.
1999;
;
144
:
:533.
–
547
.
17.
Wang
H
,
Guo
X
,
Wang
X
,
et al.
Supracellular Actomyosin Mediates Cell-Cell Communication and Shapes Collective Migratory Morphology.
.
iScience
.
2020;
;
23
:
:101204.
.
18.
McDonald
JA
,
Pinheiro
EM
,
Montell
DJ
.
PVF1, a PDGF/VEGF homolog, is sufficient to guide border cells and interacts genetically with Taiman.
.
Development
.
2003;
;
130
:
:3469.
–
3478
.
19.
McDonald
JA
,
Pinheiro
EM
,
Kadlec
L
,
et al.
Multiple EGFR ligands participate in guiding migrating border cells.
.
Dev Biol
.
2006;
;
296
:
:94.
–
103
.
20.
Dai
W
,
Guo
X
,
Cao
Y
,
et al.
Tissue topography steers migrating Drosophila border cells.
.
Science
.
2020;
;
370
:
:987.
–
90
.
21.
Duchek
P
,
Rørth
P
.
Guidance of cell migration by EGF receptor signaling during Drosophila oogenesis.
.
Science
.
2001;
;
291
:
:131.
–
133
.
22.
Duchek
P
,
Somogyi
K
,
Jékely
G
,
et al.
Guidance of cell migration by the Drosophila PDGF/VEGF receptor.
.
Cell
.
2001;
;
107
:
:17.
–
26
.
23.
Fernandez-Espartero
CH
,
Ramel
D
,
Farago
M
,
et al.
GTP exchange factor Vav regulates guided cell migration by coupling guidance receptor signalling to local Rac activation.
.
J Cell Sci
.
2013;
;
126
:
:2285.
–
2293
.
24.
Bianco
A
,
Poukkula
M
,
Cliffe
A
,
et al.
Two distinct modes of guidance signalling during collective migration of border cells.
.
Nature
.
2007;
;
448
:
:362.
–
365
.
25.
Campanale
JP
,
Mondo
JA
,
Montell
DJ
.
A Scribble/Cdep/Rac pathway controls follower-cell crawling and cluster cohesion during collective border-cell migration.
.
Dev Cell
.
2022;
;
57
:
:2483.
–
96.e4
.
26.
Mishra
AK
,
Mondo
JA
,
Campanale
JP
,
Montell
DJ
.
Coordination of protrusion dynamics within and between collectively migrating border cells by myosin II.
.
Mol Biol Cell
.
2019;
;
30
:
:2490.
–
2502
.
27.
Aranjuez
G
,
Burtscher
A
,
Sawant
K
,
et al.
Dynamic myosin activation promotes collective morphology and migration by locally balancing oppositional forces from surrounding tissue.
.
Mol Biol Cell
.
2016;
;
27
:
:1898.
–
1910
.
28.
Chen
Y
,
Kotian
N
,
Aranjuez
G
,
et al.
Protein phosphatase 1 activity controls a balance between collective and single cell modes of migration.
.
Elife
.
2020
;
:9.
.
29.
Plutoni
C
,
Keil
S
,
Zeledon
C
,
et al.
Misshapen coordinates protrusion restriction and actomyosin contractility during collective cell migration.
.
Nat Commun
.
2019;
;
10
:
:3940.
.
30.
Wang
X
,
He
L
,
Wu
YI
,
et al.
Light-mediated activation reveals a key role for Rac in collective guidance of cell movement in vivo.
.
Nat Cell Biol
.
2010;
;
12
:
:591.
–
597
.
31.
Assaker
G
,
Ramel
D
,
Wculek
SK
,
et al.
Spatial restriction of receptor tyrosine kinase activity through a polarized endocytic cycle controls border cell migration.
.
Proc Natl Acad Sci U S A
.
2010;
;
107
:
:22558.
–
22563
.
32.
Ramel
D
,
Wang
X
,
Laflamme
C
,
et al.
Rab11 regulates cell-cell communication during collective cell movements.
.
Nat Cell Biol
.
2013;
;
15
:
:317.
–
324
.
33.
Jékely
G
,
Sung
HH
,
Luque
CM
,
Rørth
P
.
Regulators of endocytosis maintain localized receptor tyrosine kinase signaling in guided migration.
.
Dev Cell
.
2005;
;
9
:
:197.
–
207
.
34.
Janssens
K
,
Sung
HH
,
Rørth
P
.
Direct detection of guidance receptor activity during border cell migration.
.
Proc Natl Acad Sci U S A
.
2010;
;
107
:
:7323.
–
7328
.
35.
Laflamme
C
,
Assaker
G
,
Ramel
D
,
et al.
Evi5 promotes collective cell migration through its Rab-GAP activity.
.
J Cell Biol
.
2012;
;
198
:
:57.
–
67
.
36.
Wan
P
,
Wang
D
,
Luo
J
,
et al.
Guidance receptor promotes the asymmetric distribution of exocyst and recycling endosome during collective cell migration.
.
Development
.
2013;
;
140
:
:4797.
–
4806
.
37.
Colombie
N
,
Choesmel-Cadamuro
V
,
Series
J
,
et al.
Non-autonomous role of Cdc42 in cell-cell communication during collective migration.
.
Dev Biol
.
2017;
;
423
:
:12.
–
18
.
38.
Zeledon
C
,
Sun
X
,
Plutoni
C
,
Emery
G
.
The ArfGAP Drongo Promotes Actomyosin Contractility during Collective Cell Migration by Releasing Myosin Phosphatase from the Trailing Edge.
.
Cell Rep
.
2019;
;
28
:
:3238.
–
48.e3
.
39.
Cobreros-Reguera
L
,
Fernández-Miñán
A
,
Fernández-Espartero
CH
,
et al.
The Ste20 kinase misshapen is essential for the invasive behaviour of ovarian epithelial cells in Drosophila.
.
EMBO Rep
.
2010;
;
11
:
:943.
–
949
.
40.
Hipfner
DR
,
Keller
N
,
Cohen
SM
.
Slik Sterile-20 kinase regulates Moesin activity to promote epithelial integrity during tissue growth.
.
Genes Dev
.
2004;
;
18
:
:2243.
–
2248
.
41.
Carreno
S
,
Kouranti
I
,
Glusman
ES
,
et al.
Moesin and its activating kinase Slik are required for cortical stability and microtubule organization in mitotic cells.
.
J Cell Biol
.
2008;
;
180
:
:739.
–
746
.
42.
Chauhan
BK
,
Lou
M
,
Zheng
Y
,
Lang
RA
.
Balanced Rac1 and RhoA activities regulate cell shape and drive invagination morphogenesis in epithelia.
.
Proc Natl Acad Sci U S A
.
2011;
;
108
:
:18289.
–
18294
.
43.
Martin
E
,
Ouellette
MH
,
Jenna
S
.
Rac1/RhoA antagonism defines cell-to-cell heterogeneity during epidermal morphogenesis in nematodes.
.
J Cell Biol
.
2016;
;
215
:
:483.
–
498
.
44.
Comunale
F
,
Causeret
M
,
Favard
C
,
et al.
Rac1 and RhoA GTPases have antagonistic functions during N-cadherin-dependent cell-cell contact formation in C2C12 myoblasts.
.
Biol Cell
.
2007;
;
99
:
:503.
–
517
.
45.
Shoval
I
,
Kalcheim
C
.
Antagonistic activities of Rho and Rac GTPases underlie the transition from neural crest delamination to migration.
.
Dev Dyn
.
2012;
;
241
:
:1155.
–
1168
.
46.
Zegers
MM
,
Friedl
P
.
Rho GTPases in collective cell migration.
.
Small GTPases
.
2014;
;
5
:
:e28997.
.
47.
Majumder
P
,
Aranjuez
G
,
Amick
J
,
McDonald
JA
.
Par-1 controls myosin-II activity through myosin phosphatase to regulate border cell migration.
.
Curr Biol
.
2012;
;
22
:
:363.
–
372
.
48.
Zhou
S
,
Li
P
,
Liu
J
,
et al.
Two Rac1 pools integrate the direction and coordination of collective cell migration.
.
Nat Commun
.
2022;
;
13
:
:6014.
.
49.
Wang
X
,
Wang
H
,
Liu
L
,
et al.
Temporal Coordination of Collective Migration and Lumen Formation by Antagonism between Two Nuclear Receptors.
.
iScience
.
2020;
;
23
:
:101335.
.
50.
Manning
L
,
Sheth
J
,
Bridges
S
,
et al.
A hormonal cue promotes timely follicle cell migration by modulating transcription profiles.
.
Mech Dev
.
2017;
;
148
:
:56.
–
68
.
51.
Miao
G
,
Godt
D
,
Montell
DJ
.
Integration of Migratory Cells into a New Site In Vivo Requires Channel-Independent Functions of Innexins on Microtubules.
.
Dev Cell
.
2020;
;
54
:
:501.
–
15.e9
.
52.
Friedl
P
,
Sahai
E
,
Weiss
S
,
Yamada
KM
.
New dimensions in cell migration.
.
Nat Rev Mol Cell Biol
.
2012;
;
13
:
:743.
–
747
.
53.
Haeger
A
,
Wolf
K
,
Zegers
MM
,
Friedl
P
.
Collective cell migration: guidance principles and hierarchies.
.
Trends Cell Biol
.
2015;
;
25
:
:556.
–
566
.
54.
Bai
Z
,
Yao
Q
,
Sun
Z
,
et al.
Prognostic Value of mRNA Expression of MAP4K Family in Acute Myeloid Leukemia.
.
Technol Cancer Res Treat
.
2019;
;
18
:
:1533033819873927.
.
55.
Gao
X
,
Chen
G
,
Gao
C
,
et al.
MAP4K4 is a novel MAPK/ERK pathway regulator required for lung adenocarcinoma maintenance.
.
Mol Oncol
.
2017;
;
11
:
:628.
–
639
.
56.
Gao
X
,
Gao
C
,
Liu
G
,
Hu
J
.
MAP4K4: an emerging therapeutic target in cancer.
.
Cell Biosci
.
2016;
;
6
:
:56.
.
57.
Kim
JW
,
Berrios
C
,
Kim
M
,
et al.
STRIPAK directs PP2A activity toward MAP4K4 to promote oncogenic transformation of human cells.
.
Elife
.
2020
;
:9.
.
58.
Hirozane
T
,
Masuda
M
,
Sugano
T
,
et al.
Direct conversion of osteosarcoma to adipocytes by targeting TNIK.
.
JCI Insight
.
2021
;
:6.
.
59.
Torres-Ayuso
P
,
An
E
,
Nyswaner
KM
,
et al.
TNIK is a therapeutic target in Lung Squamous Cell Carcinoma and regulates FAK activation through Merlin.
.
Cancer Discov
.
2021;
;
11
:
:1411.
–
23
.
60.
Tripolitsioti
D
,
Kumar
KS
,
Neve
A
,
et al.
MAP4K4 controlled integrin beta1 activation and c-Met endocytosis are associated with invasive behavior of medulloblastoma cells.
.
Oncotarget
.
2018;
;
9
:
:23220.
–
23236
.
61.
Vitorino
P
,
Yeung
S
,
Crow
A
,
et al.
MAP4K4 regulates integrin-FERM binding to control endothelial cell motility.
.
Nature
.
2015;
;
519
:
:425.
–
430
.
|